紫草素对宫颈癌细胞株Caski 侵袭迁移及Wnt/β-catenin 信号通路的影响
2021-11-03刘丛丽董金菊周双玉
刘丛丽,董金菊,周双玉
1 湖北医药学院附属襄阳市第一人民医院西区妇产科,湖北 襄阳441000;2 南漳县妇女儿童医院妇产科
宫颈癌是最常见的妇科恶性肿瘤之一,随着Pap 涂片技术的推广,宫颈癌的发生率和死亡率明显降低,但是其全球病死率依然仅次于乳腺癌,居女性肿瘤第二位,而且近年来发病有年轻化趋势[1-3]。现代医学研究发现宫颈癌的发生是一个多步骤、多因素发展过程,包括抑癌基因的缺失失活、原癌基因的表达、细胞周期蛋白调节的异常、端粒及端粒酶功能异常等多种因素[4-5]。临床治疗以手术、化疗、放疗或新辅助化疗为主,易造成机体免疫功能下降,甚至出现并发症而导致死亡。因此,寻找低毒、高效、专一的抗宫颈癌药物为该疾病相关研究之一。
紫草素(shikonin)是从紫草科植物紫草的根中提取的一种有效成分,其化学结构为萘醌类化合物,具有抗炎、抗病毒、抗氧化、抗肿瘤等作用[6]。目前,其表现出很好的抗肿瘤特性,对乳腺癌、卵巢癌、子宫内膜癌等都有抑制癌细胞增殖的作用[7-9],但对宫颈癌细胞的增殖、侵袭迁移及信号通路方面的研究较少。
本研究探讨紫草素对人宫颈癌细胞Caski 侵袭迁移及Wnt/β-catenin信号通路的影响。
1 材料与方法
1.1 实验细胞Caski 细胞购于中国科学院典型培养物保藏委员会细胞库。细胞用含10% 胎牛血清的高糖型DMEM 培养基培养于37℃、5%CO2培养箱中,待细胞融合度达到80%时以1∶3传代。
1.2 实验试剂MTT(IM0280,Solarbio,中国);DMSO(D8372,Solarbio,中 国);Transwell 小 室(MCHT24H48,Millipore,美国);Matrigel 基质胶(356234,BD,美国);DMEM 高糖培养基(11965084,Hyclone,美国);FBS(10099141,Hyclone,美国);RIPA 裂解液(P0013B,Beyotime,中国江苏);SDSPAGE凝胶试剂盒(P0012A,Beyotime,中国江苏);Trizol(9109,Takara,日 本);逆 转 录 试 剂 盒(RR047A,Takara,日本);实时定量PCR 试剂盒(RR820L,Takara,日本);兔抗β-Catenin 单克隆抗体(ab52372,Abcam,英国);兔抗p-β-Catenin单克隆抗体(ab27798,Abcam,英国);山羊抗兔二抗(A0208,Beyotime,中国江苏)。
引物GSK-3β:5′-CACCTCTGGCTACCATCCTTAT-3′;5′-ATTATTGGTCTGTCCACGGTCT-3′;Wnt2B:5′-GTGTCCTGGCTGGTTCCTTA-3′;5′-AGCTGGTGCAAAGGAAAGAA-3′。
1.3 实验方法
1.3.1 MTT 细胞增殖实验 取对数生长期细胞消化成单细胞悬液,计数后配制成1.5×105/mL悬液,以每孔100 加入到96 孔板中,37℃、5%CO2细胞培养箱培养24 h 后,以每孔0、2、4、8、16 μg/mL 的浓度加入紫草素,每组设6 个平行孔,加入相同体积的溶媒作为空白对照,分别处理24、48、72 h后,每孔加入20 μL MTT 溶液(5 mg/mL,即0.5% MTT),继续培养4 h 后,弃去上清,每孔加入150 μL DMSO溶解MTT,于490 nm处检测OD值,计算抑制率。
1.3.2 细胞侵袭实验 将Transwell 小室放入24孔板,4℃预冷后,上室加入1∶4稀释的Matrigel基质胶,待凝固后上室加入无血清培养基配制的细胞悬液400 μL,细胞数为1.5×105个,下室加入20% FBS 培养基,待细胞沉降后上室每孔加入一定浓度紫草素,每组设6 个平行孔,加入相同体积溶媒作为空白对照,处理24 h 后,取出小室,PBS漂洗后-20℃预冷甲醇固定5 min,用棉签轻轻拭去上室未迁移细胞,结晶紫染色5 min,PBS 漂洗,拍照,计数。
1.3.3 细胞迁移实验 将Transwell 小室放入24 孔板,上室加入无血清培养基配制的细胞悬液400 μL,下室加入20% FBS 培养基,待细胞沉降后上室每孔加入一定浓度的紫草素,每组设6 个平行孔,加入相同体积的溶媒作为空白对照,处理24 h后,取出小室,PBS漂洗后-20℃预冷甲醇固定5 min,用棉签轻轻拭去上室未迁移的细胞,结晶紫染色5 min,PBS漂洗,拍照,计数。
1.3.4 qPCR 实验 取对数生长期细胞,加入合适终浓度紫草素,加入相同体积溶媒作为空白对照,处理24 h 后,加入1.5 mL Trizol 于冰上吹打细胞,室温静置5 min,13 000 rpm离心5 min,吸取上清液,加入氯仿,静置离心,吸取上清液加入异丙醇,静置离心,弃去上清液,75% 乙醇清洗沉淀,离心弃上清,保留沉淀干燥,用DEPC 水溶解。然后按照Takara 反应试剂盒依次经过去除基因组DNA反应、反转录反应和RT-PCR进行扩增,扩增程序为:预变性:95℃、10 min、1循环数;扩增:95℃、15 s,60℃、15 s,72℃、30 s、40循环数。
1.3.5 Western bloting 实验 取对数生长期细胞,加入合适终浓度紫草素,加入相同体积的溶媒作为空白对照,处理24 h后,加入RIPA裂解液,置于冰上研碎至匀浆后,4℃放置30 min,13 000 rpm离心10 min,取一部分上清液,BCA 试剂盒检测蛋白浓度,另一部分上清液加入4×上样缓冲液,煮沸变性后加到4%浓缩胶浓缩,10%分离胶分离,经过转膜、封闭、4℃孵育一抗、室温孵育二抗、ECL 发光液显色、X医用胶片显影、定影等,最后拍照分析。
1.4 统计学方法采用SPSS 21.0 统计软件分析数据,计量资料以xˉ±s表示;多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 紫草素对Caski 细胞增殖的抑制作用对照组Caski 细胞生长活跃,经不同浓度(2、4、8、16 μg/mL)紫草素处理后,细胞生长呈现不同的抑制作用。在同一时间下,随着紫草素浓度的升高,其对Caski 细胞增殖抑制率越大,相同浓度下,对Caski 细胞作用时间越长,抑制率越大,因此,紫草素对Caski 细胞增殖抑制作用具有时间-浓度依赖性。见表1。
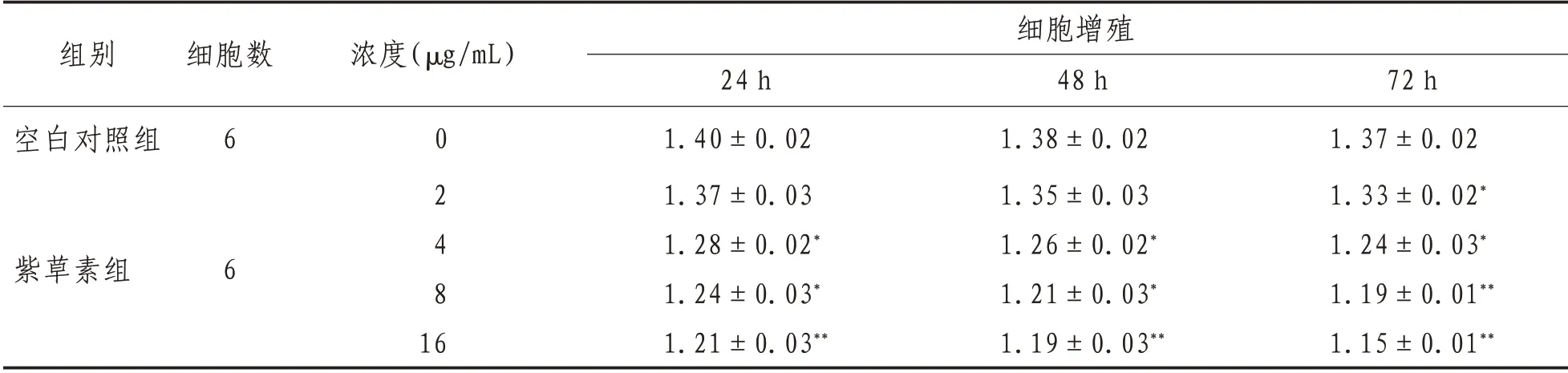
表1 紫草素对Caski细胞增殖的抑制作用(xˉ± s)
2.2 紫草素对侵袭Caski 细胞的抑制作用随紫草素浓度的升高,Caski 细胞侵袭数目越少,与空白对照组相比,2 μg/mL紫草素差异显著(P<0.05),4、8、16 μg/mL 紫草素差异极显著(P<0.01)。见图1。
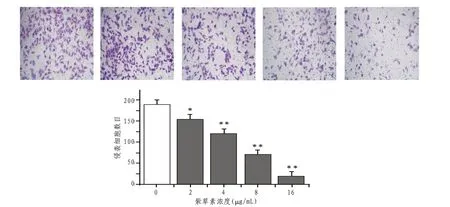
图1 紫草素对Caski细胞侵袭的影响
2.3 紫草素对Caski 细胞迁移的抑制作用随紫草素浓度的升高,Caski细胞迁移数量越少,与空白对照组比较,2 μg/mL处理组差异显著(P<0.05),4、8、16 μg/mL 紫草素差异极显著(P<0.01)。见图2。
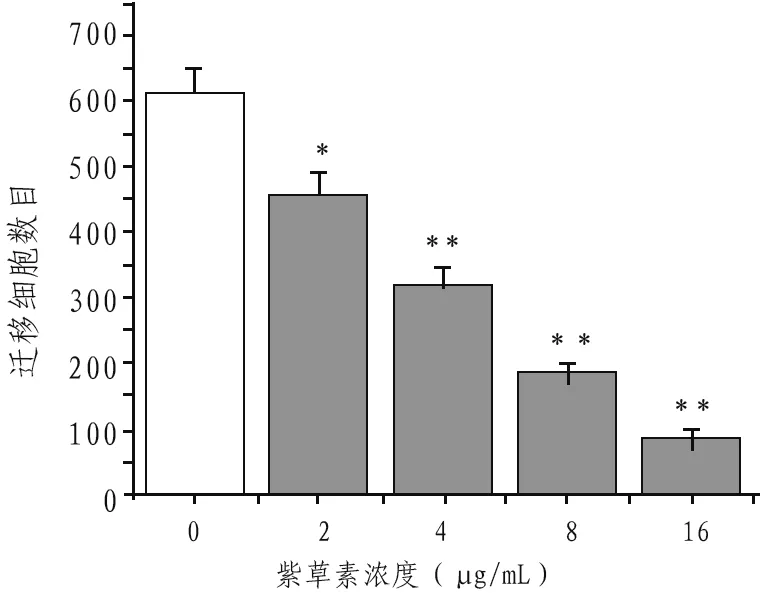
图2 紫草素对Caski细胞迁移的影响
2.4 紫草素对Caski 细胞GSK-3β、Wnt mRNA 表达的促进作用与空白对照组相比,随着紫草素浓度的升高,Caski 细胞内GSK-3βmRNA 含量逐渐升高,Wnt mRNA含量逐渐减少(P<0.01)。见图3。
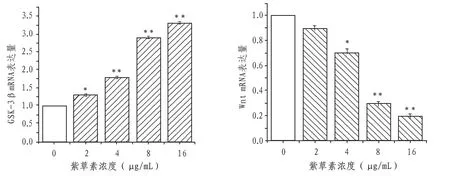
图3 各组细胞GSK-3β、Wnt mRNA表达量变化情况
2.5 紫 草 素 对Caski 细 胞β -Catenin、p- β -Catenin 的影响随着紫草素处理浓度的升高,Caski 细胞内β-Catenin 蛋白越少,p-β-Catenin蛋白越多,其中与空白对照组相比,8、16 μg/mL紫草素差异显著(P<0.01)。见图4。
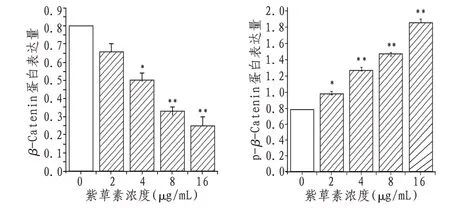
图4 各组细胞β-Catenin、p-β-Catenin蛋白变化情况
3 讨论
紫草素已在白血病、肝癌、胃癌、乳腺癌等癌症方面表现出良好的抗癌作用[10-14]。但紫草素对宫颈癌的抗癌能力方面研究报道较少,本研究发现紫草素可浓度-时间依赖性抑制人宫颈癌细胞系Caski细胞的增殖。
癌症发生侵袭迁移是癌症恶化的标志,抑制癌症的侵袭迁移对预防癌症恶化具有重要意义。本研究发现紫草素可有效抑制Caski 细胞的侵袭迁移,并表现出一定剂量依赖性。Wnt是Wnt信号通路的胞外信号,与Wnt 受体结合可激活该通路,本研究发现紫草素可抑制Caski细胞Wnt mRNA表达,因此,紫草素首先通过抑制Wnt分泌使Caski细胞Wnt 信号通路处于低活性状态。Wnt 信号通路的调节关键在于胞内β-Catenin 的稳定与含量,当β-Catenin 水平低下时,Wnt 通路关闭;反之,Wnt通路开启。而维持β-Catenin 稳定的关键蛋白是GSK-3β,在无Wnt 信号刺激情况下,胞质内GSK-3β能与其他蛋白例如APC、Axin 等以复合物形式磷酸化β-Catenin 氨基末端Ser/Thr 位点,使β-Catenin 泛素化降解,维持细胞内β-Catenin 低水平状态。在Wnt 信号刺激情况下,由细胞分泌的Wnt蛋白与细胞表面受体FZD和LRP5/6结合后触发细胞内信号转导:细胞内蛋白Dsh(dishevelled)被活化,活化的Dsh 与Axin 及Frat1 结合,后两者与GSK-3β和APC 基 因 形 成 复 合 物,Frat1 介 导GSK-3β从Axin脱离,不能磷酸化β-Catenin,导致β-Catenin 水平升高并激活下游转录因子,促进转移相关因子高表达,进而促进肿瘤转移[15]。本研究发现紫草素可诱导Caski 细胞内GSK-3βmRNA 表达。随着Caski 细胞内GSK-3β表达量的增多,其与更多的β-Catenin 结合,打破胞内β-Catenin 磷酸化平衡反应,使更多β-Catenin 磷酸化降解,而且随着紫草素浓度的增高,Caski 细胞内β-Catenin 含量越少,p-β-Catenin 含量越多。大量β-Catenin 被紫草素诱导降解,导致β-Catenin 在细胞内积累受阻,抑制β-Catenin 转移到细胞核与转录因子TCF 相结合,进一步抑制靶基因如VEGF、基质金属蛋白酶等侵袭迁移相关因子的表达激活。
综上所述,紫草素可通过促进Caski 细胞Wnt/β-Catenin 通路中GSK-3βmRNA 表达和p-β-Catenin 蛋白表达,抑制Wnt mRNA 表达和β-Catenin 蛋白表达,从而抑制Caski 细胞的侵袭迁移。
