黄海棠内生真菌Phomopsis prunorum次级代谢产物及其α-葡萄糖苷酶抑制活性研究
2021-11-03夏桂汝宋文敏张植焱杨天荷郭志勇张雪晴
夏桂汝,宋文敏,张植焱,杨天荷,郭志勇,2,张雪晴,2*
1三峡大学生物与制药学院 天然产物研究与利用湖北省重点实验室;2三峡大学生物与制药学院 中国轻工业功能酵母重点实验室,宜昌 443002
拟茎点霉属(Phomopsis)真菌是一类常见的植物病原菌,可引起多种作物的严重病害;同时,该属中部分种也是重要的植物内生真菌,广泛存在于自然界大部分植物体内。Phomopsis属真菌作为植物内生真菌能够产生结构多样的活性次级代谢产物,包括α-吡喃酮类[1]、萜类[2]、生物碱类[3]和细胞松弛素[4]等,这些化合物不仅可以发挥抗真菌[5]、抗肿瘤[6]、神经保护[7]和α-葡萄糖苷酶抑制[8]等药理活性,还可用于细胞生长调节剂[9]等,在医药和农业领域都具有非常广阔的应用前景。
黄海棠(HypericumascyronL.)是滕黄科金丝桃属植物,全草药用,具有止血镇痛、抗菌消炎[10]等功效。对黄海棠化学成分的研究已有陆续报道,主要为黄酮类[11]、萜类[12]和多环多异戊烯基取代的间苯三酚类[13]等。但是有关黄海棠内生真菌次级代谢产物的研究还鲜有报道。本课题组在前期从神农架地区黄海棠植物叶片中获得一株内生真菌Phomopsisprunorum(F4-3),经小规模发酵培养,发现其大米发酵产物结构类型丰富。前期研究从该真菌P.prunorum(F4-3)中发现了新的没药烷型倍半萜类及异香豆素类化合物,显示较好的抗农业致病菌活性[14]。本研究进一步对该真菌P.prunorum(F4-3)的大米发酵产物展开研究,并对分离获得的次级代谢产物进行生物活性评价,以期发现结构类型新颖、药理活性显著的化合物。
1 仪器和材料
1.1 仪器与试剂
Bruker UltrashiedTM400 MHz Plus核磁共振谱仪;Dionex Ultimate 3 000型高效液相色谱仪;Waters 1525型半制备型高效液相色谱仪;JASCO P-1020全自动旋光仪;紫外光谱仪(上海谱元仪器有限公司);Nicoler Auatar-FT360红外光谱仪;Q-TOF高分辨质谱仪;Tecan酶标仪;96孔板(sigma-Aldrich);薄层色谱硅胶和正相柱色谱硅胶(青岛海洋化工有限公司);反相柱色谱硅胶(Unicorn;45~60 μm);Sephadex LH-20凝胶;ACE C18色谱柱(10 mm × 250 mm);提取分离所用试剂均为分析纯试剂;高效液相所用试剂均为色谱纯试剂;α-葡萄糖苷酶购买于sigma-Aldrich公司;对硝基-α-D-葡萄糖苷、阿卡波糖、1-脱氧野尻霉素、环丙沙星和链霉素购买于上海安耐吉有限公司。
1.2 菌种与培养基
真菌P.prunorum(F4-3)分离自黄海棠植物叶片,该植物于2017年5月采自中国湖北省神农架地区,经三峡大学生物与制药学院王玉兵教授鉴定为植物HypericumascyronL.叶片(标本编号GZY201705),真菌菌株经形态学及分子生物学鉴定,确定为Phomopsisprunorum(Genebank登录号:MN959460),植物标本及菌株保藏在三峡大学生物与制药学院天然产物研究与利用湖北省重点实验室。
PDA培养基:菌株保藏和活化均采用PDA固体培养基,培养基配方为:土豆200 g/L,葡萄糖10 g/L,琼脂2.0%,pH7.2,灭菌后冷却备用。
大米培养基:1 000 mL锥形瓶中内装80 g大米,120 mL蒸馏水,经121 ℃,0.1 MPa高温灭菌20 min后冷却备用。
2 实验方法
2.1 菌株发酵
真菌在PDA固体培养基中活化后,接种到5瓶装有150 mL PDA液体培养基的500 mL锥形瓶中,置于28 ℃,200 rpm的摇床上培养2~3天获得发酵种子液。将种子液以5%的接种量接到大米培养基中,发酵50瓶,在25~28 ℃室内条件下静置培养40天。
2.2 提取、分离与鉴定
真菌P.prunorum(F4-3)在大米培养基上发酵结束后,分别采用乙酸乙酯和氯仿/甲醇1∶1的混合溶液进行浸泡,将有机相进行合并,经减压浓缩获得粗浸膏24.7 g。粗浸膏经减压硅胶柱层析(流动性采用石油醚-乙酸乙酯,极性从小到大)分成了不同极性的5个组分Fr.1~Fr.5,分别为90%石油醚-乙酸乙酯组分,70%石油醚-乙酸乙酯组分,50%石油醚-乙酸乙酯组分,30%石油醚-乙酸乙酯组分,纯乙酸乙酯组分。对组分Fr.2进行正相硅胶柱色谱分离(石油醚/乙酸乙酯 = 3∶1)和凝胶柱色谱分离,获得化合物3(5.7 mg)和4(6.5 mg)。对组分Fr.3进行分离,经过反复的正相硅胶柱色谱和凝胶柱色谱分离,最后通过半制备HPLC(甲醇/水 = 45%)获得化合物1(tR= 11.8 min,2.5 mg)和2(tR=12.6 min,1.8 mg)。对组分Fr.4经反相硅胶柱梯度洗脱(甲醇/水= 30%→80%)获得5个亚组分Fr.4-1~Fr.4-5,进一步对组分Fr.4-2和Fr.4-3经半制备HPLC分离获得化合物5(乙腈/水=25%,tR=8.5 min,2.7 mg)和6(乙腈/水=40%,tR=21.5 min,3.1 mg)。化合物结构采用一维、二维核磁(NMR)以及质谱(MS)等波谱学方法并结合文献数据比对进行了鉴定。
2.3 α-葡萄糖苷酶抑制活性测试
α-葡萄糖苷酶抑制活性在PBS缓冲液(0.1 M KH2PO4-K2HPO4,pH 6.8)中进行,选择对硝基-α-D-葡萄糖苷(PNPG)为反应底物[15]。将2 μL待测样品溶液(DMSO溶解),58 μL PBS缓冲液,30 μL用0.01 M PBS稀释后的α-葡萄糖苷酶(0.2 U/mL),以及30 μL PNPG(1.25 mM)加入到96孔板,反应15 min,用酶标仪测试在405 nm下的吸光度。阳性药选用阿卡波糖和1-脱氧野尻霉素,阴性对照选用DMSO。
2.4 抗菌活性测试
抗菌活性采用微量稀释法[16]进行测试。测试菌株包括植物病原菌丁香假单胞菌Pseudomonassyringaepv.lachrymans和柑橘溃疡病菌Xanthomonascitrisubsp.citri(由中国农业科学院烟草研究所提供),金黄色葡萄球菌Staphylococcusaureus,蜡状芽孢杆菌Bacilluscereus,大肠杆菌Escherichiacoli,和海洋病原菌副溶血弧菌Vibrioparahaemolyticus和鳗弧菌Vibrioanguillarum(由河北大学药学院提供)。细菌在LB培养基中于37 °C下培养8 h,然后将菌液稀释至106CFU/mL待用。将待测化合物,稀释后的菌液加入96孔板,37 °C下恒温培养12 h,使用酶标仪测试在630 nm波长下的吸光度,计算化合物的最小抑菌浓度MIC值。阳性药选用环丙沙星和链霉素,阴性对照选用DMSO。
3 结果与分析
3.1 化合物结构鉴定


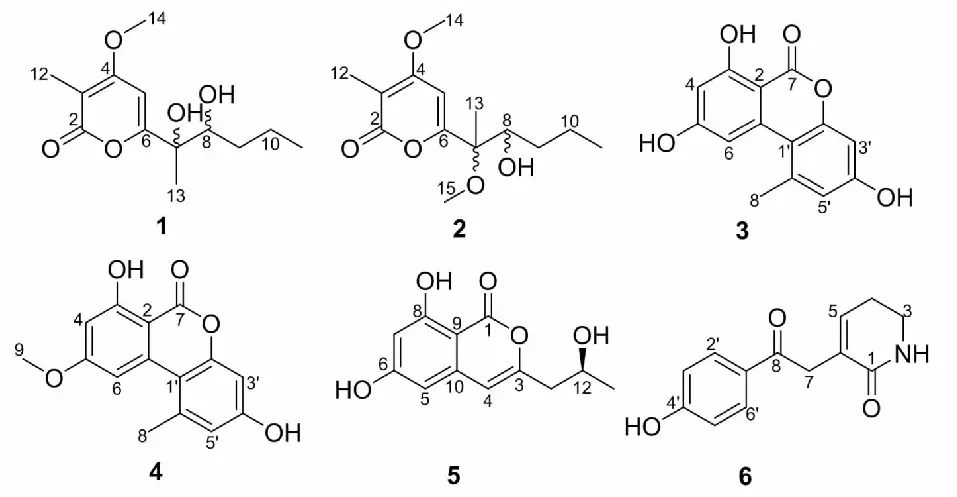
图1 化合物1~6的化学结构Fig.1 Chemical structures of compounds 1-6

表1 化合物1和2的1H NMR(400 MHz)和13C NMR(100 MHz)数据(CD3OD)Table 1 1H NMR (400 MHz) and 13C NMR (100 MHz) data of 1 and 2 (CD3OD)
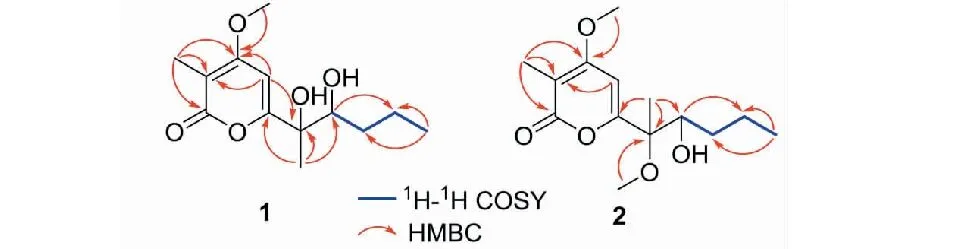
图2 化合物1和2的1H-1H COSY和HMBC相关Fig.2 The 1H-1H COSY and HMBC correlations for compounds 1 and 2
化合物3无色针状(CH3OH);ESI-MS:m/z259.06 [M + H]+;分子式为C14H10O5;1H NMR(400 MHz,CD3OD)δ:7.24(1H,d,J= 2.0 Hz,H-6),6.69(1H,d,J= 2.3 Hz,H-5′),6.60(1H,d,J= 2.3 Hz,H-3′),6.34(1H,d,J= 2.0 Hz,H-4),2.76(3H,s,H-8);13C NMR(100 MHz,CD3OD)δ:167.8(C-7),166.9(C-5),166.2(C-3),159.9(C-4′),154.5(C-2′),140.0(C-6′),139.8(C-1),118.6(C-5′),111.0(C-1′),105.9(C-6),102.8(C-3′),102.2(C-4),98.8(C-2),25.8(C-8)。以上数据与文献[18]报道基本一致,确定化合物3为alternariol。
化合物4白色固体(CH3OH);ESI-MS:m/z273.08 [M + H]+;分子式为C15H12O5;1H NMR(400 MHz,CD3OD)δ:7.28(1H,d,J= 2.0 Hz,H-6),6.70(1H,d,J= 2.3 Hz,H-5′),6.61(1H,d,J= 2.3 Hz,H-3′),6.55(1H,d,J= 2.0 Hz,H-4),3.92(3H,s,H-9),2.77(3H,s,H-8);13C NMR(100 MHz,CD3OD)δ:168.2(C-5),166.9(C-7),166.3(C-3),160.0(C-4′),154.5(C-2′),139.9(C-6′),139.7(C-1),118.7(C-5′),110.8(C-1′),104.9(C-6),102.8(C-3′),101.4(C-4),100.0(C-2),56.3(C-9),25.7(C-8)。以上数据与文献[19]基本一致,确定化合物4为alternariol 9-methyl ether。

化合物6白色固体(CH3OH);ESI-MS:m/z232.10 [M + H]+;分子式为C13H13NO3;1H NMR(400 MHz,CD3OD)δ:7.94(2H,d,J= 8.8 Hz,H-3′,5′),6.87(2H,d,J= 8.8 Hz,H-2′,6′),6.60(1H,t,J= 4.3 Hz,H-5),3.93(2H,br s,H-3),3.45(2H,t,J= 7.3 Hz,H-4),2.43(2H,dd,J= 11.5,7.2 Hz,H-7);13C NMR(100 MHz,CD3OD)δ:198.5(C-8),168.4(C-1),164.0(C-4′),141.0(C-5),132.0(C-3′,5′),131.1(C-6),129.7(C-1′),116.3(C-2′,6′),40.5(C-3),40.4(C-7),25.2(C-4)。以上数据与文献[21]报道基本一致,因此鉴定化合物6为3-(2-(4-hydroxyphenyl)-2-oxoethyl)-5,6-dihydropyridin-2(1H)-one。
3.2 α-葡萄糖苷酶抑制活性测试结果
对化合物1~6进行α-葡萄糖苷酶抑制活性评价,发现仅化合物3表现出中等的抑制活性(见表2),其IC50为43.4 μM,强于阳性药1-脱氧野尻霉素(IC50= 158.0 μM)和阿卡波糖(IC50= 528.9 μM)的抑制活性。其他化合物均未见明显的抑制活性。

表2 化合物3对α-葡萄糖苷酶抑制活性结果(n = 3)Table 2 The inhibitory activity of 3 against α-glucosidase (n = 3)
3.3 体外抗菌活性测试
对化合物1~6还进行了抗菌活性评价,选取7株菌株,包括2株革兰氏阳性菌:金黄色葡萄球菌S.aureus和蜡状芽孢杆菌B.cereus,以及5株革兰氏阴性菌:丁香假单胞菌P.syringaepv.lachrymans,柑橘溃疡病菌X.citrisubsp.citri,大肠杆菌E.coli,副溶血弧菌V.parahaemolyticus和鳗弧菌V.anguillarum,以上化合物均没有表明出明显的抗菌活性,MIC值均大于50 μM。
4 结论
本研究采用硅胶柱色谱、凝胶柱色谱和半制备HPLC等现代色谱分离技术从药用植物黄海棠内生真菌P.prunorum(F4-3)中分离获得6个次级代谢产物,包括2个新的α-吡喃酮类化合物和已知的2个二苯并α-吡喃酮类化合物、1个异香豆素类化合物和1个生物碱类化合物。α-吡喃酮类化合物1和2其侧链结构均含有邻二羟基片段,化合物4~6为首次从该属真菌中分离获得。药理活性评价显示,仅化合物3具有中等的α-葡萄糖苷酶抑制活性,化合物1~6均未见明显的抗菌活性。据文献报道,化合物3还具有一定的细胞毒活性和DPPH自由基清除活性(IC50为46.5 μM)[22],化合物3对多种植物病原菌有弱的抗菌活性[23]。本研究并未分离到与黄海棠化学成分结构相近的化合物,可能是由于在实验室普通培养条件下,许多与次级代谢产物合成途径有关的基因簇处于沉默状态[24],后续还将尝试通过改变培养基种类或在培养基中添加化学表观遗传修饰剂等诱导菌株相关沉默基因的表达,增加次级代谢产物结构多样性,提高发现结构新颖、活性显著化合物的概率。
