NGAL、KIM-1、Th17细胞检测对脓毒症AKI患者预后的评估
2021-11-03杨火保刘进生郑彩罚
杨火保 刘进生 郑彩罚
脓毒症是急诊科常见的危重情况之一,据统计全世界每年有2 500 万脓毒症患者,有近800 万人因此失去生命,脓毒症致死率高于乳腺癌、艾滋病、前列腺癌三种疾病总和[1]。脓毒症常会引起多器官功能障碍,其中急性肾损伤(Acute kidney injury,AKI)是导致患者死亡率上升的重要原因之一。研究显示,脓毒症患者中有近40%可并发AKI,且脓毒症所引起的AKI 预后比常规AKI 差,存活率低,存活患者常会伴有慢性肾脏损害,对患者预后健康与生活质量均有严重不良影响[2]。连续性肾脏代替治疗(Continuous renal replacement therapy,CRRT)是目前治疗AKI 常用手段,作为体外循环血液净化方式,CRRT 是具有良好血流动力学稳定性的肾脏代替治疗模式,可有效改善多脏器功能。有研究表明,使用脓毒症AKI 相关生物标记物可在一定程度上为患者预后评估提供参考,但对于多种生物标记物联合应用是否可提高对脓毒症AKI 患者预后价值的研究较少[3]。基于此,本研究将分析中性粒细胞明胶酶相关脂质运载蛋白(Neutrophil gelatinase associated lipocalin,NGAL)、尿肾损伤分子-1(Kidney damage molecule-1,KIM-1)、外周血Th17 细胞在脓毒症AKI患者中的表达情况,以期了解三者联合检测对脓毒症AKI 患者经CRRT 治疗预后的评估价值。
1 资料与方法
1.1 一般资料
收集2019年1月 至2020年3月69 例在本院行CRRT 治疗的脓毒症AKI 患者设为AKI 组,其中男41 例,女28 例,平均年龄为(52.16±6.80)岁。纳入标准:①临床资料完整;②符合《国际严重脓毒症和脓毒性休克治疗指南》中相关诊断标准[4];并符合AKI 诊断标准:48 h 内血清肌酐水平升高≥26.5 μmol/L,或增加≥基线水平50%;持续6 h 尿量<0.5 mL/(kg·h)[5]。排除标准:①合并存在心、肝、肾等严重原发性疾病;②为终末期肾脏疾病者;③长期进行血液透析治疗者;④近3 个月有使用免疫抑制剂治疗者。另选取68 例于本院同期行CRRT 治疗的单纯AKI 患者作为对照组,其中男39 例,女29 例,平均年龄为(52.33±6.54)岁,两组患者在一般资料比较差异无统计学意义(P>0.05)。本研究经医院医学伦理委员会批准通过,受试者或其家属均签署知情同意书。
1.2 方法
1.2.1 CRRT 治疗方法
患者均使用连续静脉血过滤模式进行治疗,在患者股静脉或颈内静脉建立血管通路,使用美国BM25 机器以及德国1.3 m2AV600 聚巩膜滤器进行治疗。血流量在200~250 mL/h,置换液流量为30~35 mL(kg·h)。根据患者具体情况选择抗凝以及超滤量。
1.2.2 分组
将AKI 组患者根据病情严重程度进行分组,以急性生理与慢性健康状况评分(Acute physiology and chronic health score,APACHE II)评价[6]:轻度组28 例:APACHEⅡ评分<10 分,中度组19 例:APACHE Ⅱ评分:10 分~20 分,重度组:APACHEⅡ评分22 例:>20 分。
1.2.3 预后情况
治疗后随访30 d 记录患者在此期间生存情况,根据此分为存活组和死亡组。
1.2.4 NGAL、KIM-1 联合外周血Th17 细胞检测
在患者确诊入院后次日清晨空腹抽取静脉血液4 mL,并收集尿液5 mL,使用离心机3 000 r/min 离心后获取血清及尿液上清液,血清用于检测NGAL、Th17 细胞,尿液用于检测KIM-1。血清NGAL(试剂盒为上海邦景实验有限公司提供)及KIM-1(试剂盒为上海一研生物科技有限公司提供)使用双抗体夹心酶标免疫法进行检测;Th17 细胞水平采用流式细胞仪检测。实验步骤严格按照试剂配套说明书进行。
1.3 统计学方法
采用SPSS 22.0 统计软件进行统计分析,计量资料采用()表示,组间比较采用t检验,多组间比较采用F检验;计数资料采用n(%)表示,采用χ2检验;绘制受试者工作特征(ROC)曲线分析NGAL、KIM-1 联合外周血Th17 细胞检测对脓毒症AKI 者预后评估价值,以P<0.05 为差异具有统计学意义。
2 结果
2.1 AKI组与对照组NGAL、KIM-1、Th17水平比较
AKI 组NGAL、KIM-1、Th17 水平明显高于对照组,差异均有统计学意义(P<0.05)。见表1。
表1 AKI组与对照组NGAL、KIM-1、Th17水平比较(±s)Table 1 Comparison of NGAL,KIM-1 and Th17 levels between the observation group and the control group(±s)

表1 AKI组与对照组NGAL、KIM-1、Th17水平比较(±s)Table 1 Comparison of NGAL,KIM-1 and Th17 levels between the observation group and the control group(±s)
组别对照组AKI 组t 值P 值n 68 69--NGAL(ng/mL)19.26±3.59 37.19±7.18 18.444<0.001 KIM-1(μg/mL)18.26±3.16 26.58±4.97 11.673<0.001 Th17(%)3.16±0.11 4.19±0.41 20.017<0.001
2.2 不同病情程度脓毒症AKI 者NGAL、KIM-1、Th17 水平比较
NGAL、KIM-1、Th17 在不同病情程度脓毒症AKI 患者中表达情况均为:重度组>中度组>轻度组,差异均有统计学意义(P<0.05)。见表2。
表2 不同病情程度脓毒症AKI 者NGAL、KIM-1、Th17 水平比较(±s)Table 2 Comparison of NGAL,KIM-1 and Th17 levels in patients with sepsis AKI of different severity(±s)
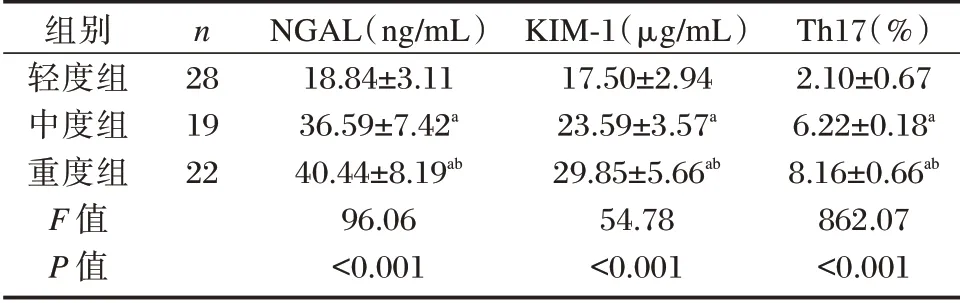
表2 不同病情程度脓毒症AKI 者NGAL、KIM-1、Th17 水平比较(±s)Table 2 Comparison of NGAL,KIM-1 and Th17 levels in patients with sepsis AKI of different severity(±s)
注:a为与轻度组比较,P<0.05;b为与中度组比较,P<0.05。
组别轻度组中度组重度组F 值P 值n 28 19 22 NGAL(ng/mL)18.84±3.11 36.59±7.42a 40.44±8.19ab 96.06<0.001 KIM-1(μg/mL)17.50±2.94 23.59±3.57a 29.85±5.66ab 54.78<0.001 Th17(%)2.10±0.67 6.22±0.18a 8.16±0.66ab 862.07<0.001
2.3 不同预后脓毒症AKI 者NGAL、KIM-1、Th17水平比较
69 例患者30 d 后死亡17 例,存活52 例,死亡组脓毒症AKI 者NGAL、KIM-1、Th17 水平明显高于存活组,差异均有统计学意义(P<0.05)。见表3。
表3 不同预后脓毒症AKI 者NGAL、KIM-1、Th17 水平比较(±s)Table 3 Comparison of NGAL,KIM-1 and Th17 levels in AKI patients with sepsis(±s)
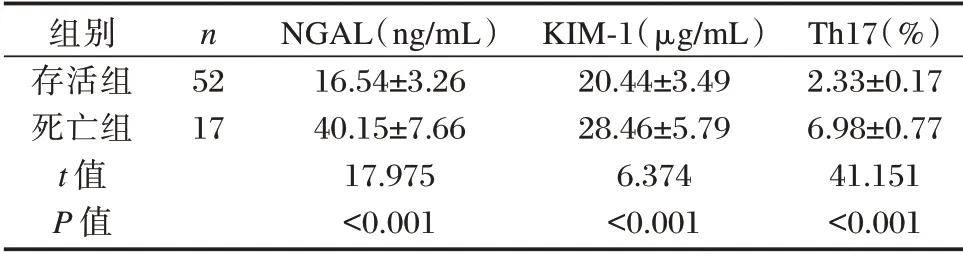
表3 不同预后脓毒症AKI 者NGAL、KIM-1、Th17 水平比较(±s)Table 3 Comparison of NGAL,KIM-1 and Th17 levels in AKI patients with sepsis(±s)
组别存活组死亡组t 值P 值n 52 17 NGAL(ng/mL)16.54±3.26 40.15±7.66 17.975<0.001 KIM-1(μg/mL)20.44±3.49 28.46±5.79 6.374<0.001 Th17(%)2.33±0.17 6.98±0.77 41.151<0.001
2.4 NGAL、KIM-1 联合外周血Th17 细胞检测对脓毒症AKI 者预后评估价值
ROC 结果示,ROC 结果显示,NGAL+KIM-1+Th17 评估脓毒症AKI 者预后时AUC 为0.829,明显高于三者单独检测(P<0.05)。见表4及图1。
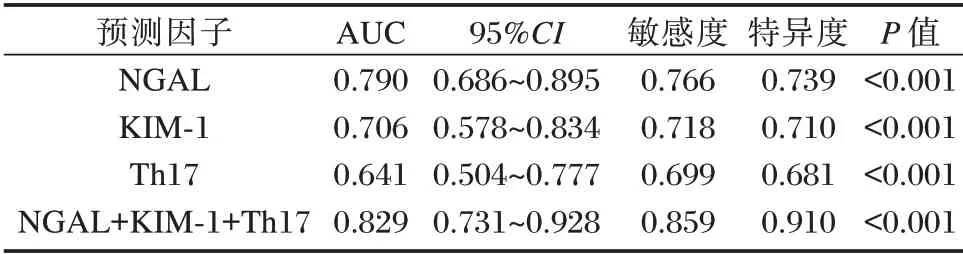
表4 NGAL、KIM-1 联合外周血Th17 细胞检测对脓毒症AKI 者预后评估价值Table 4 prognostic value of NGAL,KIM-1 combined with Th17 cell detection in patients with septic Aki
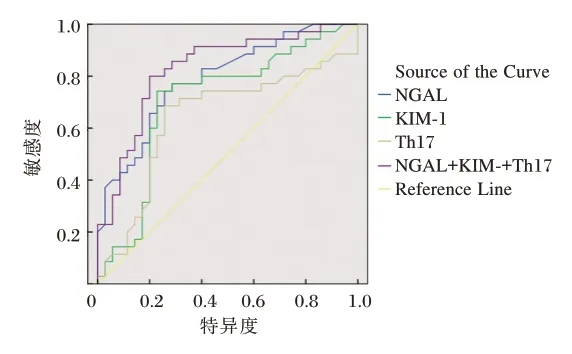
图1 ROC 曲线Figure 1 ROC curve
3 讨论
以往有研究发现,导致脓毒症合并AKI 高死亡风险和此病缺乏有效的预后评估指标有关,寻找合适的评估指标可降低脓毒症合并AKI 死亡风险[7]。
NGAL 于1993年在中性粒细胞中被发现,在正常的肾脏组织中其表达水平低,但如果出现肾毒性物质或肾脏出现缺血性损伤可导致肾小管升支粗段中NGAL 分泌迅速增高,通常在3 h 后可在尿液或血清中检测到NGAL,其表达升高明显早于尿N-乙酰B-D 氨基葡萄糖苷酶、血肌酐等因子[8]。文献研究显示,NGAL 可作为早期诊断AKI 的生物标志物,且敏感性、特异性均较高[9]。王元真等人[11]通过建立动物模型,发现NGAL 为最早出现在肾脏上皮中的蛋白质,且稳定性好,在出现肾损伤后数小时内可在尿液和血液中被检测到。国内外均有研究显示,AKI 损伤程度、损伤持续时间与NGAL 含量成正比,NGAL 水平增加,AKI 损伤越严重,NGAL水平逐渐下降恢复正常,AKI 也可得到一定恢复[10-11]。KIM-1 属于跨膜糖蛋白,由黏蛋白、免疫球蛋白组成。在正常的肾脏组织中KIM-1 几乎不表达,但在出现AKI 后细胞外的KIM-1 就会脱落,可在尿液中检出[12]。KIM-1 作为磷脂酰丝氨酸(Phosphatidylserine,PS)的受体,可有效识别脂蛋白和PS,从而清除凋亡细胞,减缓炎症反应,达到修复组织的目的。有研究通过建立缺血性肾病大鼠模型,检测大鼠尿液中KIM-1 含量,发现KIM-1 在尿液中表达明显上升[13]。刘瑞清等人[14]研究发现,KIM-1水平变化与肾脏管状细胞受损程度存在正相关,KIM-1 对肾损伤早期诊断价值高于传统生物标记物。邓欣雨等人[15]研究显示,脓毒症发生发展过程中炎症反应发挥着关键的作用,淋巴细胞作为重要效应器,有着刺激炎症反应、调节免疫应答的作用,可通过分化出多种特异性T 细胞并表达多种炎性因子参与到脓毒症的发生、发展中。Th17 属于辅助性T 细胞亚群,可分泌出IL-17,促进中性粒细胞、单核细胞等炎性因子聚集在感染部位。在感染性或自身免疫性疾病中,患者外周血Th17、IL-17 水平均明显升高,且和患者病情严重程度存在密切的联系。
本研究结果提示NGAL、KIM-1、Th17 可能参与脓毒症AKI 发展过程。进一步分析,发现随着脓毒症AKI 患者病情进展,NGAL、KIM-1、Th17 水平为明显上升趋势。且在治疗后30 d 随访中发现,预后生存组NGAL、KIM-1、Th17 水平明显低于预后死亡组,与以往研究结果相符[16]。说明三者水平变化与脓毒症AKI 病情进展密切相关,可为患者预后情况评估提供参考依据。行ROC 曲线分析说明NGAL、KIM-1、Th17 可为脓毒症AKI 患者治疗预后评估提供一定参考信息,可作为脓毒症AKI 患者预后预测的理想生物指标。
综上所述,NGAL、KIM-1、外周血Th17 细胞水平变化与脓毒症AKI 患者病情变化密切相关,三者联合可进一步提高对脓毒症AKI 患者经CRRT治疗短期预后的预测能力。
