LMR、MCL1、DKK1与多发性骨髓瘤患者骨损伤及预后相关性
2021-11-03朱太岗李月红张飞虎董漫玉杜小雷
朱太岗 李月红 张飞虎 董漫玉 杜小雷
多发性骨髓瘤(multiple myeloma,MM)属血液系统恶性肿瘤常见类型之一,发病率约为10.0%[1],相关研究显示[2],其发生、发展与骨髓造血微环境密切相关,可上调破骨细胞活化因子、成骨细胞抑制因子表达,破坏骨细胞代谢平衡,诱发骨质疏松、溶骨性骨折等多发性骨髓瘤骨病(multiple myeloma bone disease,MBD),严重影响患者生存质量。髓样细胞白血病蛋白1(myeloidcellleukemia-1,MCL1)为骨髓瘤细胞重要生长因子,既往研究已证实[3],其在细胞凋亡、血液系统恶性肿瘤发病过程中起着重要作用。Dickkopf-1(DKK1)是癌基因Wnt 信号通路中抑制因子,在恶性肿瘤骨转移、骨相关病变中扮演着重要角色[4]。淋巴细胞与单核细胞比值(lymphocyte-to-monocyte ratio,LMR)能反映机体抗肿瘤免疫功能,参与肿瘤微环境调控过程[5]。目前,有关LMR、MCL1、DKK1 与MM 患者骨损伤及对预后的预测价值临床尚未完全明确。为此,本研究拟探讨LMR、MCL1、DKK1与MM 患者骨损伤的相关性及与预后的关系,以期为临床评估病情程度、预测预后提供一定参考依据。详情如下。
1 资料和方法
1.1 一般资料
选取安徽省皖北煤电集团总医院血液内科2015年3月至2020年3月118 例MM 患者作为研究对象,其中女43 例,男75 例,年龄平均(56.39±4.45)岁。
纳入标准:①均符合MM 诊断标准[6],并经骨X 线片、血免疫球蛋白(Immuno globulin,Ig)、骨髓象等检查确诊;②均为初诊,且预计生存期≥3 个月;③所有研究对象均签署知情同意书;排除标准:①近期有放化疗、激素治疗史者;②合并严重肝肾等重要脏器器质性损害者;③合并自身免疫系统疾病或全身感染性疾病者;④严重心理障碍或精神异常者。
1.2 方法
1.2.1 临床病理特征收集
采用调查问卷方式收集所有研究对象性别、年龄、M 蛋白分型、Durie-Salmon 分期、国际分期系统(international staging system,ISS)分期、骨髓浆细胞比例、MBD 分级[7]、血红蛋白(hemoglobin,Hb)、乳酸脱氢酶(Lactate Dehydrogenase,LDH)、β2-微球蛋白(β2-microglobin,β2-MG)、血肌酐等资料。其中MBD 分级0 级为无骨骼影像学异常,1 级为严重弥漫性骨质疏松,2 级为一个解剖学部位发生一个或多个溶骨性损害,3 级为多个解剖学部位发生多个溶骨性损害,4 级为严重溶骨性损害并发病理性骨折;Hb、LDH、β2-MG、血肌酐均采用罗氏诊断产品(上海)有限公司COBAS INTEGRA 800 型全自动生化分析仪检测。
1.2.2 LMR、MCL1、DKK1 检测
所有研究对象均于入院第2 d 清晨空腹取肘静脉血5 mL:①采用德国Sysmex 2100 型全自动血细胞分析仪检测淋巴细胞计数与单核细胞计数,计算LMR;②静置30 min 后,3 000 r/min 离心15 min,离心半径10 cm,取上层血清,放于-80℃低温保存,采用德国CobasE601 型电化学发光免疫分析仪测定血清MCL1 水平;采用卡迈舒(上海)生物科技有限公司酶联免疫吸附试验试剂盒测定血清DKK1 水平。
1.2.3 治疗方法
所有研究对象均给予以化疗为主的综合治疗,化疗方案为长春新碱+蒽环类+地塞米松+沙利度胺。
1.3 统计学方法
采用统计学软件SPSS 22.0 处理数据,正态计量资料以()表示,两组间比较用t检验,多组间采用单因素方差分析,组内两两比较采用SNK-q检验;计数资料用n(%)表示,采用χ2检验;LMR、MCL1、DKK1 与骨损伤相关性分析采用Spearman相关系数模型;MM 患者预后不良的影响因素采用Cox 多因素回归分析;不同LMR、MCL1、DKK1表达患者3年生存率采用Kaplan-Meier 法绘制生存曲线,组间比较采用Log-rank 检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同临床病理特征患者LMR、MCL1、DKK1表达
不同性别、年龄、M 蛋白、Durie-Salmon 分期、ISS 分期、骨髓浆细胞比例、血肌酐患者LMR、MCL1、DKK1 表达比较,差异无统计学意义(P>0.05);不 同Hb、LDH、β2-MG、MBD 分 级 患者LMR、MCL1、DKK1 表达比较,差异有统计学意义(P<0.05)。见表1。
表1 比较不同临床病理特征患者LMR、MCL1、DKK1 表达(±s)Table 1 the expressions of LMR,MCL1 and DKK1 in patients with different clinicopathological features were compared(±s)
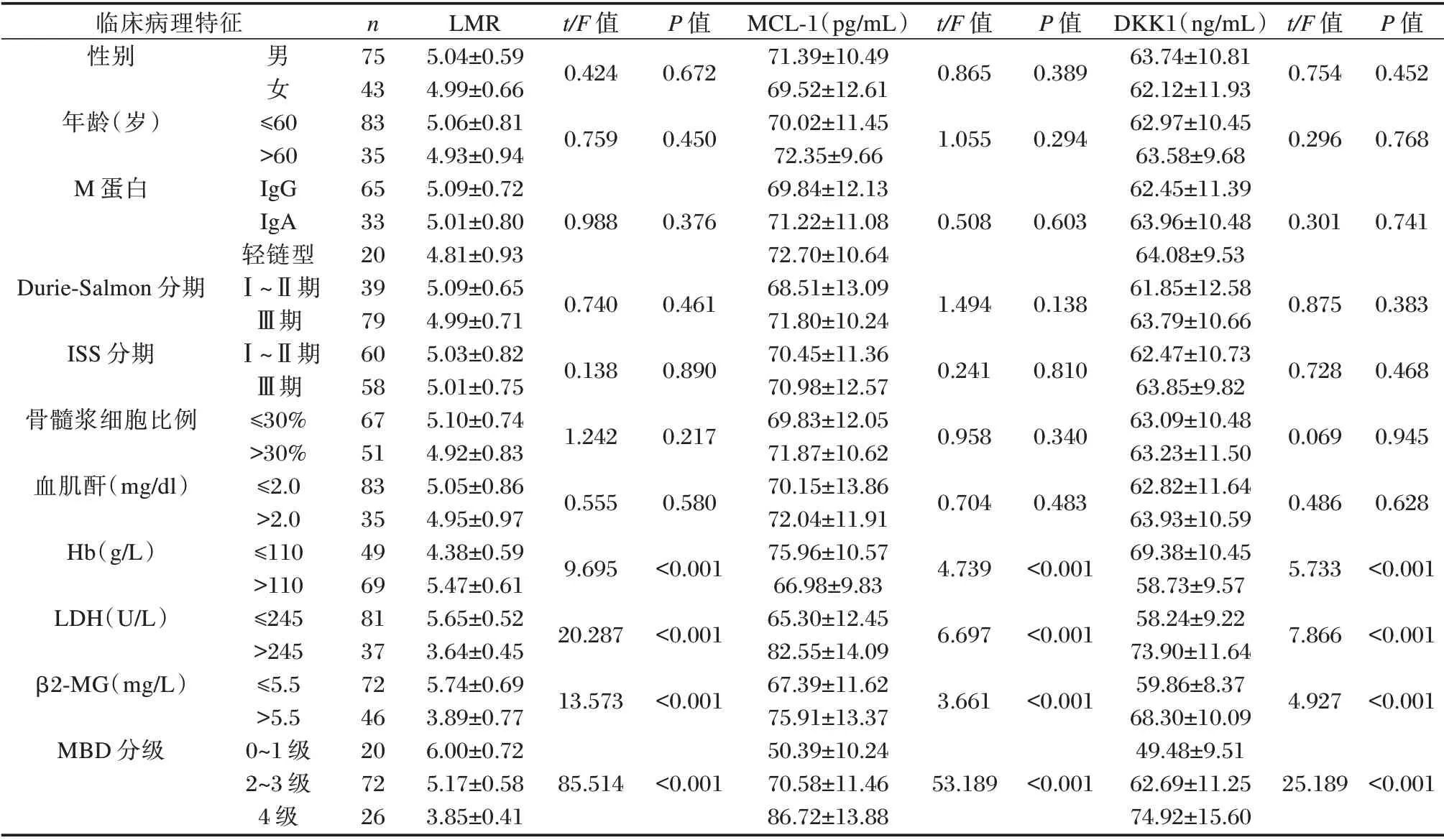
表1 比较不同临床病理特征患者LMR、MCL1、DKK1 表达(±s)Table 1 the expressions of LMR,MCL1 and DKK1 in patients with different clinicopathological features were compared(±s)
临床病理特征性别n男女t/F 值0.424 P 值0.672 t/F 值0.865 P 值0.389 t/F 值0.754 P 值0.452年龄(岁)0.759 0.450 1.055 0.294 0.296 0.768 M 蛋白0.988 0.376 0.508 0.603 0.301 0.741 Durie-Salmon 分期0.740 0.461 1.494 0.138 0.875 0.383 ISS 分期0.138 0.890 0.241 0.810 0.728 0.468骨髓浆细胞比例1.242 0.217 0.958 0.340 0.069 0.945血肌酐(mg/dl)0.555 0.580 0.704 0.483 0.486 0.628 Hb(g/L)9.695<0.001 4.739<0.001 5.733<0.001 LDH(U/L)20.287<0.001 6.697<0.001 7.866<0.001 β2-MG(mg/L)13.573<0.001 3.661<0.001 4.927<0.001 MBD 分级≤60>60 IgG IgA轻链型Ⅰ~Ⅱ期Ⅲ期Ⅰ~Ⅱ期Ⅲ期≤30%>30%≤2.0>2.0≤110>110≤245>245≤5.5>5.5 0~1 级2~3 级4 级75 43 83 35 65 33 20 39 79 60 58 67 51 83 35 49 69 81 37 72 46 20 72 26 LMR 5.04±0.59 4.99±0.66 5.06±0.81 4.93±0.94 5.09±0.72 5.01±0.80 4.81±0.93 5.09±0.65 4.99±0.71 5.03±0.82 5.01±0.75 5.10±0.74 4.92±0.83 5.05±0.86 4.95±0.97 4.38±0.59 5.47±0.61 5.65±0.52 3.64±0.45 5.74±0.69 3.89±0.77 6.00±0.72 5.17±0.58 3.85±0.41 85.514<0.001 MCL-1(pg/mL)71.39±10.49 69.52±12.61 70.02±11.45 72.35±9.66 69.84±12.13 71.22±11.08 72.70±10.64 68.51±13.09 71.80±10.24 70.45±11.36 70.98±12.57 69.83±12.05 71.87±10.62 70.15±13.86 72.04±11.91 75.96±10.57 66.98±9.83 65.30±12.45 82.55±14.09 67.39±11.62 75.91±13.37 50.39±10.24 70.58±11.46 86.72±13.88 53.189<0.001 DKK1(ng/mL)63.74±10.81 62.12±11.93 62.97±10.45 63.58±9.68 62.45±11.39 63.96±10.48 64.08±9.53 61.85±12.58 63.79±10.66 62.47±10.73 63.85±9.82 63.09±10.48 63.23±11.50 62.82±11.64 63.93±10.59 69.38±10.45 58.73±9.57 58.24±9.22 73.90±11.64 59.86±8.37 68.30±10.09 49.48±9.51 62.69±11.25 74.92±15.60 25.189<0.001
2.2 LMR、MCL1、DKK1 与骨损伤的相关性
经Spearman 相关性分析,MCL1(r=0.656)、DKK1(r=0.694)与MBD 分级呈正相关,LMR(r=-0.712)与MBD 分级呈负相关(P均<0.05)。
2.3 LMR、MCL1、DKK1 与MM 患者3年生存率的关系
随访3年,脱落9 例。以表1中LMR、MCL1、DKK1均值为界限,将患者分为LMR低表达(≤5.02)、高表达(>5.02)、MCL1 低表达(≤70.71 pg/mL)、高表达(>70.71 pg/mL)和DKK1 低表达(≤63.15 ng/mL)、高表达(>63.15 ng/mL)患者。采用K-M法进行分析显示,LMR 低表达、MCL1 高表达、DKK1 高表达患者3年生存率低于LMR 高表达、MCL1 低表达、DKK1 低表达患者,差异有统计学意 义(χ2=11.917,P<0.001;χ2=11.042,P<0.001;χ2=7.716,P=0.005)。见图1。
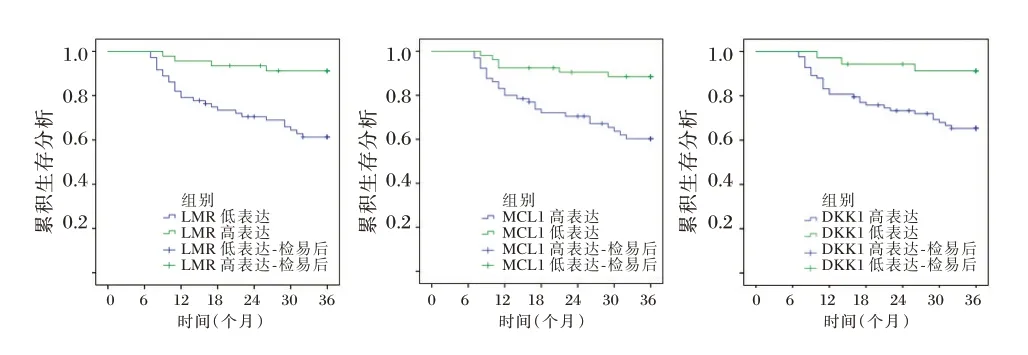
图1 LMR、MCL1、DKK1 与MM 患者3年生存率的关系Figure 1 Relationship between LMR,MCL1,DKK1 and 3-year survival rate in MM patients
2.4 MM 患者预后的影响因素
以MM 患者预后为因变量(生存=0,死亡=1),以Durie-Salmon 分期、ISS 分期、骨髓浆细胞比例、LDH、Hb、血肌酐、MBD 分级、LMR、MCL1、DKK1为自变量,应用Cox 多因素分析,结果显示,MBD分级、Hb、LMR、MCL1、DKK1 是MM 患者预后的影响因素(P<0.05)。见表2。

表2 MM 患者预后的Cox 多因素分析Table 2 Cox multivariate analysis of poor prognosis in MM patients
3 讨论
淋巴细胞计数、单核细胞计数是评估机体免疫状态的指标,二者比值通过抑制局部免疫,促进肿瘤血管形成,参与肿瘤微环境调控,可诱导肿瘤细胞异常增殖,促进肿瘤细胞转移[8]。程盼盼等[9]研究已证实,LMR 与MM 患者疾病进展及预后相关。MBD 分级是评估MM 患者骨损伤程度的重要指标,其分级越高说明MM 患者病情越严重。本研究结果表明LMR 可作为评估MM 骨损伤的重要指标。另外,有学者还指出,LMR 是预测恶性肿瘤患者临床预后的一个强有力生物标志物[10]。本研究中,LMR 低表达可能降低MM 患者3年生存率。杨万波等[11]研究亦指出,低LMR 预示着骨质瘤临床预后较差。分析上述结果产生机制可能与炎症反应所致淋巴细胞计数减少和单核细胞产生的肿瘤相关巨噬细胞增多,影响宿主抗肿瘤免疫应答作用,导致肿瘤细胞生长速度加快有关。提示LMR 对MM 患者预后具有一定预测价值。
MCL1 是线粒体凋亡通路中重要因子,通过抑制bax、BH3 蛋白表达,可参与细胞周期调节,发挥癌基因作用。朱婕等[12]通过120 例MM 患者发现,MCL1 与MM 临床分期存在正相关,可用于评价患者骨损伤,支持本研究结果。提示MCL1 有望成为评估MM 患者骨损伤的潜在指标。近年来,诸多研究表明DKK1 在溶骨性或成骨性骨质破坏、骨吸收增加等病理进程中起着重要作用[13-14]。韩东海等[15]观点认为,DKK1 水平会随着MM 病情加重而上升,对MM 病情变化具有一定的预测价值。本研究经Spearman 相关性分析可知,DKK1 与MM 患者MBD 分级存在正相关关系,这可能是由于DKK1水平升高可抑制骨髓间充质干细胞向成骨细胞分化,间接刺激局部破骨细胞活性,破坏骨代谢平衡,诱导骨质吸收,形成恶性循环,促进骨髓瘤细胞存活和生长,最终加快MM 病情进展。推测抑制DKK1 表达可能是缓解MM 患者骨损伤的有效靶点。本研究还表明,MCL1、DKK1 高表达患者3年生存率低于MCL1、DKK1 低表达患者,这可能归因于MCL1、DKK1 表达过度上调可抑制骨髓瘤细胞凋亡,促进肿瘤细胞异常增殖,进而加重患者肿瘤细胞负荷,促进肿瘤细胞转移,从而引起预后不良。进一步经Cox 多因素回归分析显示,MCL1、DKK1 高表达是MM 患者死亡的独立危险因素。提示临床可根据MCL1、DKK1 表达防范MM 死亡。
综上所述,LMR、MCL1、DKK1 与MM 患者骨损伤存在一定相关性,且均为患者预后的影响因素,可为临床制定个性化治疗方案、预测预后提供新思路。但本研究纳入样本量少,缺少部分患者遗传学资料,因此较难明确LMR、MCL1、DKK1 水平与遗传学异常的关系,未来仍有待进一步扩大样本量、完善远期随访资料进行验证。
