12种花生品种黄曲霉毒素B1污染风险评估
2021-11-03广林秋君吴限鑫郭春景王建忠
李 广林秋君吴限鑫郭春景王建忠
(农业农村部农产品质量安全风险评估实验室(沈阳) /辽宁省农业科学院农业质量标准与检测技术研究所,辽宁 沈阳 110161)
花生(ArachisHypogaeaL.)是世界上最重要的油料和经济作物,在亚洲、北美洲等地区均有分布,是人类重要的蛋白质和食用油来源[1]。花生在我国具有悠久的栽植历史,在对外贸易重占有重要的比重[2]。辽宁是我国重要的花生种植区域,辽宁省花生向来以口感好、品质佳、且无黄曲霉毒素等诸多优点著称,在国内外市场上均有很高盛誉[3]。近年来,随着国家供给侧结构调整以及花生价格持续走高,辽宁省花生种植面积逐年加大,已成为继玉米和水稻之后的第三大主栽作物[4]。
花生含有丰富的营养物质,在收获前和收获后的贮藏加工过程易遭受黄曲霉侵染而导致黄曲霉毒素污染,从而影响花生生产、加工和出口贸易,危害人们的健康[5]。黄曲霉(Aspergillusflavus)是一种腐生型好氧真菌,也是研究报道最多的黄曲霉毒素产生菌[6]。黄曲霉毒素是目前发现的致癌力最强的天然物质,主要包含黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)等类型,对人和动物肝脏具有较强破坏作用,可诱导原发性肝癌等疾病,具有剧毒性、致突变性、强致癌性等特点,其中AFB1毒性和致癌性最强[7]。黄曲霉毒素污染问题一直深受世界各国关注,并制定了一系列限量标准,欧盟规定直接食用的花生中AFB1限量为2.0 μg/kg,日本规定所有食品中AFB1含量不得超过10 μg/kg[8]。我国也对食品中AFB1含量制定了限量标准[9],见表1。
本研究通过将黄曲霉接种于12种常见花生品种,在接种后检测不同花生品种对黄曲霉抗性,并通过高效液相色谱—柱后衍生法检测不同花生品种黄曲霉毒素B1含量,以期为不同花生品种黄曲霉污染风险评估奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试花生品种
LH20、LH29、LH940、LH744,由辽宁省农业科学院风沙地改良利用研究所提供;HH15、HH22、HH40、HH9102,由河南省农业科学院提供;SH9、SH14、SH33、SH48,由山东省农业科学院提供。
1.1.2 供试菌株
黄曲霉sy15,由中国农业科学院油料作物研究所提供。
1.1.3 供试培养基
马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g、葡萄糖20 g、琼脂粉13~15 g、蒸馏水1 000 ml。
1.1.4 供试设备及试剂
安捷伦1200型高效液相色谱仪、C18色谱柱(250mm×4.6 mm,5 μm)、AURA光化学柱后衍生器、黄曲霉毒素免疫亲和柱。
黄曲霉毒素B1标准溶液(2 μg/ml)、甲醇(色谱纯)、乙腈(色谱纯)、超纯水。
1.2 方法
1.2.1 黄曲霉孢子悬浮液制备
将黄曲霉种接种PDA平板上,置于恒温培养箱28 ℃培养48 h,向其中加入无菌水(含0.1 g/100 ml吐温80和0.1 g/100 ml琼脂粉),震荡混匀,调节孢子悬浮液浓度为1×105cfu/ml。
1.2.2 黄曲霉室内接种
花生荚果手工去壳,每个品种选取大小一致、成熟、饱满、健康、无破损的花生种子50粒,70%酒精表面消毒1 min,无菌ddH2O冲洗3次,将花生种子置于无菌培养皿中,加入5 ml黄曲霉孢子悬浮液,轻摇培养皿,将黄曲霉孢子悬浮液均匀分布在花生种子上,封口膜封口,以加入5 ml无菌水(含0.1 g/100ml吐温80和0.1 g/100 ml琼脂粉)的处理作为空白对照,每个处理3次重复。接种后的花生种子置于培养箱中,28 ℃,湿度80%~90%黑暗培养7 d,测定侵染率并计算侵染指数。
1.2.3 评价标准
花生种子感染程度(N)分5级[6]:0级,种子表面无黄曲霉;1级,种子表面黄曲霉覆盖率15%以下;2级,种子表面黄曲霉覆盖率16%~30%;3级,种子表面黄曲霉覆盖率31%~50%;4级,种子表面黄曲霉覆盖率50%以上。
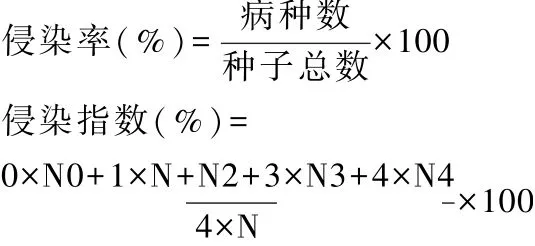
N0、N1、N2、N3、N4分别代表0、1、2、3、4级花生种子数,N代表花生种子总数。
抗性分级标准[9]:免疫(I),不发病;高抗(HR),侵染指数<20%;中抗(MR),20%≤侵染指数<30%;中感(MS),30%≤侵染指数<50%;高感(HS),侵染指数≥50%。
1.2.4 HPLC-柱后衍生法检测花生中黄曲霉毒素B1含量
1.2.4.1 色谱条件
流动相甲醇—乙腈—水(40∶18∶42),进样量20 μl,流速1.0 ml/min,荧光检测器激发波长360 nm,发射波长450 nm。
1.2.4.2 黄曲霉毒素B1标准溶液稀释
将2 μg/ml黄曲霉毒素B1标准溶液加入甲醇稀释成100 ng/ml的溶液,备用。
1.2.4.3 待测样品制备
分别称取未接种花生和感病后花生各10 g,分别加入NaCl 2 g,80%乙腈溶液50 ml,高速匀质搅拌器(25 000 r/min)搅拌5 min,过滤,量取滤液10 ml,加入磷酸盐缓冲液40 ml混匀,玻璃纤维滤纸过滤。取滤液20 ml,以自然重力通过免疫亲和柱,以30 ml超纯水加压洗脱亲和柱,弃去洗脱液,再用2 ml甲醇洗脱,收集洗脱液。
1.2.4.4 样品检测
将黄曲霉毒素B1标准液与待测样品洗脱液氮吹干,1 ml流动相复溶,玻璃纤维滤纸过滤,转入进样瓶,以1.2.3.1的色谱条件进行检测。
1.2.5 数据分析
数据用SPSS 24软件进行差异显著性分析(Duncan’s test);Excel作图。
2 结果与分析
2.1 黄曲霉室内接种
黄曲霉sy15可不同程度侵染12份花生品种,如表2所示,侵染率均大于50%,但侵染率与侵染指数无明显相关性。12份供试花生品种对黄曲霉的抗性水平表现为:高抗品种2份,分别为LH744和SH9,占供试品种的16.7%;中抗品种3份,分别为LH29、LH940和SH33,占供试品种的25%;中感品种5份,分别为HH15、HH40、HH9102、SH14、SH48,占供试品种的41.7%;高感品种2份,分别为LH20和HH22,占供试品种的16.7%,未发现免疫品种。

表2 不同品种花生的侵染率与侵染指数Table 2 Infection rate and infection index of different peanut varieties
2.2 黄曲霉毒素B1检测
采用HPLC-柱后衍生法检测花生中黄曲霉毒素B1含量,结果显示12份花生品种接种黄曲霉后,黄曲霉毒素B1含量差异显著,其中HH22花生品种黄曲霉毒素B1含量最高,达 378.14 μg/kg,其次是 LH29,达365.10 μg/kg,SH48花生品种黄曲霉毒素B1含量最低,为27.92 μg/kg。
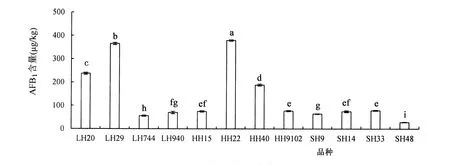
图1 不同品种花生黄曲霉毒素B1含量Figure 1 AFB1content of different peanut varieties
3 讨论
花生是最容易受黄曲霉侵染的作物之一,黄曲霉污染严重威胁花生制品的安全和消费者的健康,是制约花生产业发展最重要的因素之一[10]。供试的12份花生品种均可受到黄曲霉侵染,但不同品种侵染率和侵染指数不同,且侵染率与侵染指数无显著相关性,即有些品种容易受黄曲霉侵染,但发病程度较低,有些品种相对不易受黄曲霉侵染,但一旦侵染,发病程度较高。花生对黄曲霉抗性存在两种类型:一是对侵染的抗性,主要依靠种皮的特性及完整度等特点抵御黄曲霉菌的入侵和定殖[11];另一种是对产毒的抗性,主要是抑制黄曲霉侵染后产生毒素,这种抗性与黄曲霉的侵染率无相关性[12]。本研究证实了不同花生品种抗黄曲霉的侵染性和抗产毒性不同,且提供了一种花生黄曲霉毒素的检测方法,为不同花生品种黄曲霉污染风险评估奠定基础。
