鸭儿芹CjDFR基因的克隆、表达及与花青素含量的关系
2021-11-03钟秀来王天文谭国飞孟平红
王 堃, 钟秀来, 罗 庆, 王天文, 谭国飞, 孟平红
(贵州省农业科学院 园艺研究所, 贵州 贵阳 550006)
0 引言
【研究意义】鸭儿芹(CryptotaeniajaponicaHassk.)是伞形科多年生野生草本植物,又名三叶芹、鸭脚板等,世界范围内均有分布,通常生于山沟及林下较阴湿的地方[1]。鸭儿芹含有丰富的营养成分及药用价值,是一种优良的药食同源性植物[2-3]。植物中花青素可使植物呈不同颜色,其强抗氧化能力有益于人体健康[4-5]。对不同鸭儿芹材料中花青素的合成基因CjDFR及含量进行研究,可为鸭儿芹的进一步开发及利用提供依据。【前人研究进展】编码二氢黄酮醇还原酶(DFR,dihydroflavonol reductase)的DFR基因是处于花青素合成途径下游基因群中重要的基因,其催化二氢黄酮醇形成不稳定的无色花青素,对植物花色形成有重要作用[6]。目前,对DFR基因的研究中,焦淑珍等[7]通过RACE技术克隆了葡萄风信子花瓣中的2条DFR基因,通过对其研究分析表明,DFR与葡萄风信子的蓝色形成密切相关;张波等[8]克隆贵妃芒果中的DFR基因发现,绿色果皮中的DFR基因表达量较黄色果皮中高;KIM等[9]的研究显示,DFR基因是导致洋葱红、黄颜色差异的基因;AHMED等[10]对芜菁的12个DFR基因进行研究表明,这些基因与花青素的生物合成及抗寒、抗冻性相关;LO PIERO等[11]发现,与红橙相比非红橙品种的DFR基因表达明显下降;HELARIUTTA等[12]证实了DFR基因在花冠中的表达与花青素的积累模式有关。【研究切入点】目前,DFR已在多种植物中被分离鉴定,但鸭儿芹中DFR的研究尚未见报道。【拟解决的关键问题】探明不同颜色鸭儿芹材料中花青素的含量及其调控基因CjDFR,为进一步开发鸭儿芹中花青素及不同品种鸭儿芹的综合利用提供新思路。
1 材料与方法
1.1 材料
1.1.1 鸭儿芹 3种鸭儿芹材料分别为圆叶鸭儿芹(RL)、浅裂叶鸭儿芹(LL)和深裂叶鸭儿芹(DL),均搜集于贵州省野生环境,其中圆叶绿色材料的叶柄和叶片均为绿色,浅裂叶鸭儿芹和深裂叶鸭儿芹的叶柄颜色较叶片偏紫,但深裂叶鸭儿芹叶片及叶柄紫色较浅裂叶鸭儿芹明显(图1)。3种材料已经过2年的自交提纯,性状稳定,保存于贵州省农业科学院园艺研究所伞形科课题组。
2019年8月种植于贵州省农业科学院园艺研究所试验地中,试验地肥力中等,自然生长。2019年11月,分别取3种不同材料鸭儿芹叶及叶柄,用锡箔纸包裹,液氮速冻后,保存于-80℃冰箱中,用于花青素含量的测定和RNA的提取。

注:A,圆叶鸭儿芹;B,浅裂叶鸭儿芹;C,深裂叶鸭儿芹。
1.1.2 试剂 无氯仿型植物总RNA提取试剂盒购自百泰克生物技术有限公司(北京),Nanodrop ND-1000分光光度计购自Nanodrop Technologies Inc.(美国),HiScript 1stStrand cDNA试剂盒购自诺唯赞生物科技股份有限公司(南京),高保真PCR聚合酶Taq Plus Master Mix Ⅱ(诺唯赞生物科技有限公司,南京),回收的目的片段基因试剂盒购自TaKaRa Bio Inc(大连),荧光PCR试剂盒为AceQ qRCR SYBR Green Master Mix购自诺唯赞生物有限公司(南京)。
1.2 花青素的提取及含量测定
从-80℃冰箱中取3种不同材料的鸭儿芹叶片和叶柄,放在研钵中,使用液氮分别将其充分磨成粉末后,取约2 g粉末放入25 mL 0.1%甲醇的酒精溶液中,室温黑暗条件放置8 h。用0.25 μm膜过滤后,使用紫外分光光度计分别在波长为530 nm、620 nm和650 nm下的吸光度值。测得结果按照公式:OD=(OD530-OD620)-0.1(OD650-OD620),算出吸光度值,再根据0.1个吸光度值为1个花青素单位,算出花青素含量[13]。
1.3 鸭儿芹材料总RNA的提取及cDNA的合成
植物总RNA使用无氯仿型植物总RNA提取试剂盒,按照说明书分别提取2个材料的总RNA。提取的RNA使用琼脂糖浓度为1.5%(v/v)检测其纯度,使用Nanodrop ND-1000分光光度计检测其浓度。提取的RNA使用HiScript 1stStrand cDNA试剂盒,按照说明书进行cDNA的合成。合成的cDNA利用灭菌的ddH2O稀释15倍后,保存于-20℃冰箱中,用于CjDFR表达水平的检测。
1.4 鸭儿芹CjDFR基因的克隆
将反转录的鸭儿芹cDNA用灭菌的ddH2O稀释15倍后,用于基因克隆模板。克隆引物参考鸭儿芹转录组数据库获得的鸭儿芹CjDFR基因序列(T1_Unigene.35992)[14]。克隆正向引物CjDFR-F:5′-ATGGAGGAAAAGAGAACCGTGTGTG-3′,反向引物CjDFR-R:5′-TTATGAGATCAAACCCTTTTCTC-3′。克隆采用高保真PCR聚合酶Taq Plus Master Mix Ⅱ,克隆测序为94℃预变性5 min;然后按照94℃变性30 s,55℃退火30 s,72℃延伸1.2 min,32个循环后,于72℃延伸5 min;最后12℃条件下保存。PCR产物经过1.2%琼脂糖凝胶电泳鉴定正确后,使用Axygen胶回收试剂盒按照说明书,回收目的片段基因。
回收的目的片段基因,按照试剂盒说明书,连接到pMD19-T载体上。连接载体利用42℃热激的方法转化至大肠杆菌DH5α,涂布于含有氨苄青霉素(浓度100 mg/L)的LB固体培养基中,37℃倒置黑暗培养12~14 h。挑取饱满的单菌落于含有氨苄青霉素(浓度100 mg/L)的LB液体培养基中,37℃摇床中培养6~8 h。取1 μL菌液进行菌液PCR检测,将菌液PCR检查正确的单菌落,送到基因测序公司进行测序。
1.5 DFR进化树分析
利用伞形科植物芹菜[15]、欧芹[16]、水芹[17]等转录组数据库,寻找各伞形科植物的DFR蛋白序列。另外,利用NCBI蛋白数据库,分别查找茄科、豆科、禾本科、十字花科、蔷薇科、藜科、芍药科、桑科、葡萄科植物(表1)。利用MEGA软件NJ计算方法构建3种鸭儿芹DFR翻译的蛋白序列与查找的26个物种DFR蛋白序列的同源进化树。
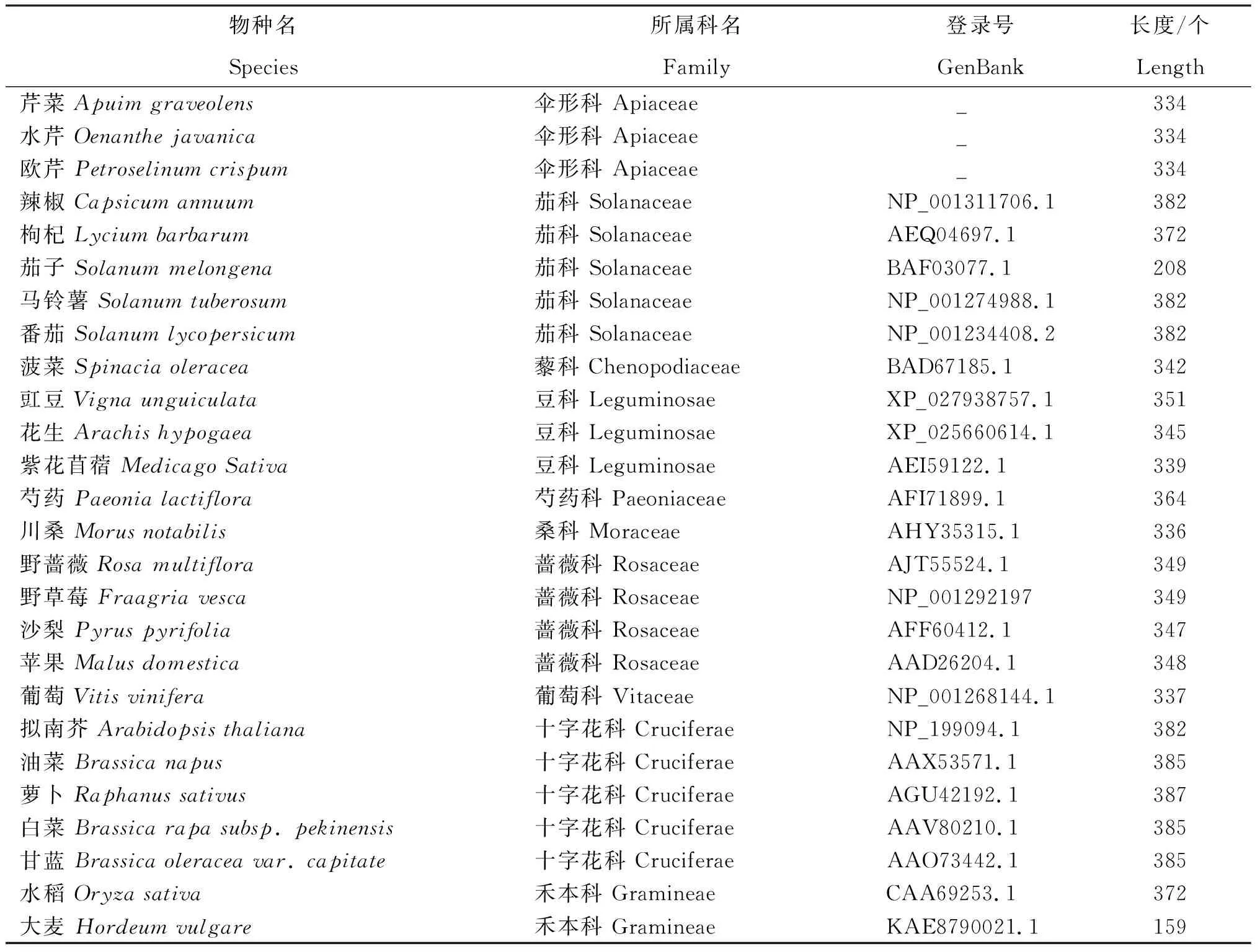
表1 不同物种DFR蛋白信息
1.6 CjDFR基因表达分析
CjDFR基因在3种材料中的表达水平,采用实时荧光定量PCR进行检测。使用CFX Connect PCR检测系统(Bio-Rad, Hercules, CA)仪器检测,使用的荧光PCR试剂盒为AceQ qRCR SYBR Green Master Mix(诺唯赞生物有限公司,南京)。检测体系20 μL:荧光酶10 μL,正反引物各0.5 μL,灭菌的ddH2O 7 μL,稀释的cDNA模板2 μL。反应程序为95℃预变性5 min;95℃变性10 s,55℃退火30 s,40个循环;65℃到95℃间每10 s升高0.5℃做熔解曲线;最后8℃保存。CjDFR基因检测引物根据测序结果设计,其正向引物CjDFR-F:5′-ATGGAGGAAAAGAGAACCGTGTGTG-3′,反向引物CjDFR-R:5′-TTATGAGATCAAACCCTTTTCTC-3′。使用鸭儿芹CjActin为内参基因,正向引物:5′- CTGCAAAGAGCAGCTCTTCTGTGGA -3′,反向引物:5′- TGTAAGTTGTCTCGTGGATTCCTGC-3′[14]。相对定量,使用参照基因ΔCT法,表达差异等于2-ΔCT,ΔCT=CT目标基因-CTactin。相对定量是基于处理和对照间,目标基因对参考基因表达量的比较。每个样设置3次独立重复。
1.7 数据处理
使用Excel 2007分析统计数据,利用IBM Statistics 20.0分析显著性。
2 结果与分析
2.1 鸭儿芹的花青素含量
由图2可见,3种鸭儿芹材料花青素整体含量呈显著性差异(P< 0.05),圆叶鸭儿芹叶片中花青素含量为0.050 mg/100g,叶柄中为0.002 mg/100g,含量较低;深裂叶鸭儿芹中对应组织花青素含量最高,叶片和叶柄分别为2.276 mg/100g和10.929 mg/100g。此外,浅裂叶鸭儿芹和深裂叶鸭儿芹叶柄的花青素含量均显著高于叶片。
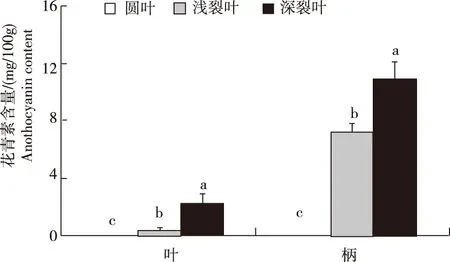
图2 3种鸭儿芹叶、柄中的花青素含量
2.2 鸭儿芹CjDFR基因克隆
经测序,3个材料的该基因CDS长度均为1 005 bp(图3),可编码334个氨基酸。3种鸭儿芹CjDFR碱基序列比对结果显示一致性高达99.54%,存在14个位点差异(图4)。由碱基序列推导的氨基酸序列同源性为98.90%,出现11个位点差异。

注:克隆引物用黑色箭头标注。

图4 圆叶、浅裂叶与深裂叶鸭儿芹CjDFR蛋白序列
2.3 鸭儿芹DFR进化树
由图5可见,在26个物种DFR蛋白与鸭儿芹CjDFR构建的进化树中,各科植物DFR进化均处在各自的分枝上,进化非常保守,如茄科的辣椒、枸杞、茄子、马铃薯和番茄,豆科的豇豆、花生和紫花苜蓿,蔷薇科的野蔷薇、野草莓、沙梨和苹果,十字花科的拟南芥、油菜、萝卜、白菜和甘蓝,禾本科的水稻和大麦等,均能聚在一起。伞形科植物鸭儿芹与芹菜、水芹、欧芹等植物,亲缘关系较近。同时,从进化树上看圆叶类型鸭儿芹与深裂型鸭儿芹DFR进化更近,水芹为中国原产物种与外来物种芹菜进化距离较近,表明水芹和芹菜之间DFR具有类似的进化关系。
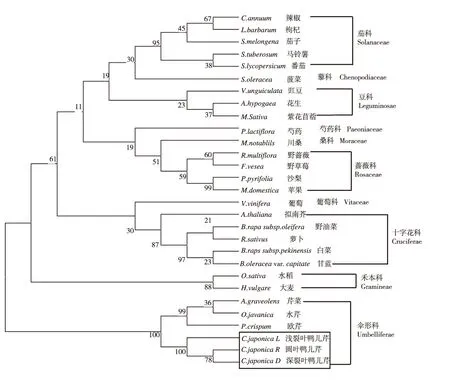
注:NJ树枝上的数字为bootstrap值。自检:1000次重复。
2.4 CjDFR基因的表达
由图6可见,CjDFR在3种材料的叶和柄的表达量有显著差异,在浅裂和深裂叶鸭儿芹柄、叶中表达水平均显著高于对应的圆叶鸭儿芹,且2种材料的该基因在叶柄中的表达水平高于叶片。圆叶鸭儿芹2个组织中CjDFR表达水平均极显著低于浅裂叶鸭儿芹和深裂叶鸭儿芹。
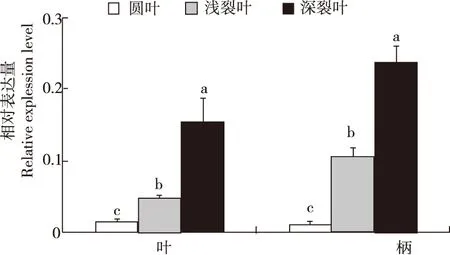
注:同一部位不同小写字母表示达显著性差异。
3 讨论
鸭儿芹是我国传统的药食两用植物,从鸭儿芹叶和茎中提取的酚酸类物质如木犀草素、芹菜素、对香豆酸、没食子酸和绿原酸等,具有抗氧化、抗菌和消炎作用[16]。此外,鸭儿芹中粗纤维、粗蛋白质、粗脂肪和Vc等物质含量高于菠菜、生菜等常见栽培蔬菜,属于营养价值非常高的一类蔬菜[18]。目前对鸭儿芹的研究主要在栽培生产上[19],对其中活性物质的研究较少,在合成机制方面的研究更少。
花青素是植物中重要的呈色色素之一,是决定植物的叶、花和果实颜色的重要色素[20-21],除调控颜色外,花青素在植物抗逆性方面也有重要作用[22-23],花青素的合成途径也是目前研究最清晰的植物次生代谢途径之一。3种鸭儿芹材料存在颜色差异,其中叶柄的颜色差异较叶片更为明显,通过对叶柄和叶片进行花青素含量测定,结果显示花青素含量与植株颜色呈正相关,即颜色偏紫色的深裂叶鸭儿芹花青素含量最高,颜色偏青白色的圆叶鸭儿芹花青素含量最低,且叶柄的含量大于叶片,这也与鸭儿芹植株地上部的颜色一致。在对五叶草莓的研究中发现,花青素在红色五叶草莓果实中的含量高于白色五叶草莓[24],与该研究结果类似。
DFR是花青素合成途径中的重要酶之一,试验克隆得到的3个不同颜色鸭儿芹CjDFR,通过基因和氨基酸序列比对一致性分别高达99.54%和98.90%,基因序列存在14个位点差异,氨基酸序列为11个,差异可能是由于品种及生长环境的差异引起。DFR广泛存在于各个植物中,且DFR在不同科属植物中进化相对保守。鸭儿芹CjDFR与其他伞形科植物的DFR相距较近,处在同一分支上,推测伞形科植物中DFR的功能相似;鸭儿芹DFR与辣椒、枸杞等十字花科植物相聚较远,其余各科植物也都处在各自的分支,表明DFR在进化上非常保守,这与王如凤等[25]对桑树中MmDFR的研究结果一致。另外,原产中国的伞形科植物水芹与外来物种芹菜DFR进化距离较近,而芹菜在中国相对水芹又被为“旱芹”,可能中国的水芹与外来物种“旱芹”之间存在某种进化关系。
3种鸭儿芹材料的CjDFR在叶片和叶柄中均有表达,且呈显著性差异,其差异与植株不同组织中花青素含量的差异相一致,表明CjDFR表达可能与花青素的积累密切相关。DFR的表达与花青素含量的关系同植物种类有关,如紫甘薯中IbDFR的表达与花青素含量显著相关[26];而在荔枝中,DFR基因表达与果皮中的花青素含量无明显联系。同时,其他基因与DFR基因一起相互作用影响植物花青素含量,如LUO等[27]研究FLS和DFR基因产物竞争共同的底物,从而分别指导黄酮醇和花色苷的生物合成,进而确定花朵的白色与红色。DFR过量表达能够增加植物花青素含量,如POLASHOCK等[28]将蔓越莓DFR基因转入烟草中,蔓越莓DFR基因的过表达增加了烟草模型系统中的花的花色素沉着,使其呈深粉色(对照为浅粉白色),与LIU等[29]对紫小麦的研究结果一致。
4 结论
对圆叶鸭儿芹、浅裂叶鸭儿芹和深裂叶鸭儿芹中花青素含量进行测定,并克隆了其花青素合成调控基因CjDFR, 3种不同颜色的鸭儿芹材料在外观颜色、叶形及花青素含量方面存在一定差异,其中花青素含量与材料颜色深浅呈正相关,同时CjDFR的表达量也与鸭儿芹花青素含量呈正相关。通过研究不同颜色鸭儿芹品种中花青素的含量及合成,为进一步开发鸭儿芹中花青素及不同品种鸭儿芹的综合利用提供参考。
