2株临床分离烟曲霉菌株病原学检测及分子鉴定方法比较与分析*
2021-11-02杜伟勤王淑峰
杜伟勤,王淑峰,薛 婷
1.吕梁市人民医院医学检验科,山西吕梁 033000;2.山西医科大学第一医院医学检验科,山西太原 030001;3.山西医科大学第一医院呼吸与危重症医学科,山西太原 030001
烟曲霉是曲霉菌属中最常见一类机会致病性真菌,呈世界性分布,通过空气传播,可在免疫力低下患者中引起危及生命的侵袭性肺曲霉菌病(IPA)。唑类抗真菌药物是临床预防和治疗IPA的首选药物。近年研究发现,烟曲霉对唑类药物的耐药性日益严峻,且耐唑类药物烟曲霉引起的IPA病死率高达100%[1]。然而,临床上由于缺乏早期、快速、敏感和有效的烟曲霉检测方法,IPA患者通常无法及时诊断,进而导致治疗延误。因此,本研究对临床分离的烟曲霉菌株进行病原学检测和分子生物学鉴定,并比较了不同检测方法之间的差异,期望能够辅助临床提升诊断效率,为临床治疗提供依据。
1 材料与方法
1.1菌株来源 收集山西医科大学第一医院临床疑似肺曲霉菌感染患者痰液标本,经痰涂片、革兰染色镜检,形态学初步鉴定为曲霉菌。
1.2主要试剂 亚甲蓝染液 (珠海贝索生物技术有限公司),六次甲基四胺、四硼酸钠(辽宁永强医药器械化玻有限公司),氯化金溶液(Sangon Biotech公司),甜菜碱(Sigma公司),Bst DNA聚合酶 (New England BioLabs),100×羟基萘酚蓝(HNB)溶液(北京百奥莱博科技有限公司),E.coli DH5α感受态细胞,pMDTM18-T Vector Cloning试剂盒、Premix TaqTM(Ex TaqTMVersion 2.0 plus dye)、DNA Marker、琼脂糖凝胶回收试剂盒(Tiangen公司)。
1.3方法
1.3.1涂片制备及培养 无菌棉签挑取脓性痰液60~100 μL于干燥洁净载玻片右侧2/3处,均匀涂抹10 mm×20 mm左右卵圆形痰膜,自然干燥;迅速通过酒精灯外焰 3~4 次,加热固定待用。接种环挑取脓性痰液2环,直接压片法制备痰液涂片,待镜检。将适量痰液加入10 mL无菌生理盐水的离心管中,剧烈振荡15 s,3 500 r/min离心15 min,弃上清;重复上述步骤,接种环取沉淀分别接种于Sabouraud培养基和真菌显色培养基,置于28 ℃培养箱中,每天观察菌落生长情况。
1.3.2亚甲蓝染色 亚甲蓝溶液染色1 min,双蒸水漂洗,自然干燥后,镜检。
1.3.3改良GMS染色 (1)冰甲醇固定;(2)过碘酸染色5 min,双蒸水洗3 次,甩干;(3)载玻片置于加热板上,GMS工作液覆盖菌膜,加热3~5 min (此过程中避免GMS工作液干涸),直至涂片颜色变为深褐色,冷却后双蒸水洗3次,甩干;(4)滴加氯化金溶液,作用约15 s,菌膜颜色由深褐色变为灰白色,双蒸水洗3次,甩干;(5)硫代硫酸钠固定3 min,双蒸水洗3次,晾干,镜检。
1.3.4提取烟曲霉DNA 分别取痰液2 mL,加入4倍体积生理盐水洗涤,3 500 r/min 离心10 min,重复上述步骤3次,加入2 mL真菌细胞壁裂解液[100 mmol/L Tris-HCl,pH值8.0,1.0% 十二烷基硫酸钠(SDS),10 mmol/L EDTA,100 mmol/L NaCl]中,剧烈振荡15 s,静置5 min,加10 mg/mL蛋白酶K 10 μL,56 ℃ 6 h,酚-氯仿法提取DNA。
1.3.5PCR扩增 以1.3.4中提取的DNA为模板,所用引物见表1,分别进行PCR扩增,反应体系为25 μL(Premix Taq酶12.5 μL,10.0 mmol/L引物各1 μL,双蒸水8.5 μL),扩增条件为95 ℃变性5 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,共30个循环,72 ℃延伸8 min。琼脂糖凝胶电泳检测PCR产物并回收。阳性对照为本实验室保存的烟曲霉菌株,阴性对照为无菌双蒸水。

表1 PCR扩增引物[2-4]
1.3.6TA克隆 采用Nanodrop分光光度计检测胶回收DNA的浓度。10 μL反应体系:pMD18-T Vector 1 μL,DNA (10 ng) 1 μL,RNase-free Water 3 μL,Solusion 5 μL。然后于16 ℃放置过夜,第2天将其加入E.coli DH5α感受态细胞中,轻弹试管底部混匀,置于冰上静置30 min;42 ℃水浴60 s,冰浴1~2 min后,加入890 μL LB 液体培养基中,37 ℃、225 r/min恒温振荡培养60 min;混匀后取100 μL,涂布于含1 μg/mL氨苄西林的LB固体培养基上,待菌液吸收完全,37 ℃恒温培养箱过夜培养。菌落PCR鉴定所用引物为通用引物,扩增体系和条件同1.3.5。琼脂糖凝胶回收后双向测序。
1.4环介导等温扩增(LAMP)扩增 以1.3.5中提取的DNA为模板进行LAMP扩增,所用引物见表2。25 μL反应体系如下:5 μmol/L F3/B3各1 μL,40 μmol/L FIP/BIP各1 μL,10 mmol/L dNTPs 3.5 μL,Betaine 2 μL,100 mmol/L Mg2+1 μL,Bst DNA 聚合酶1 μL,10×Thermo Pol Buffer 2.5 μL,DNA模板 2 μL,加Nuclease-free Water至25 μL。扩增条件为63 ℃ 1 h,扩增产物分别通过观察白色沉淀,琼脂糖凝胶电泳,可视化(在上述反应体系中加入25×HNB 1 μL)及real-time LAMP (在上述反应体系中加入10 μmol/L SYTO-9.0 0.5 μL)进行检测。阳性对照为本实验室保存的烟曲霉菌株,阴性对照为无菌双蒸水。

表2 LAMP扩增所用引物[2]
2 结 果
2.1病原学检测结果
2.1.1培养特性 2株烟曲霉在真菌显色培养基培养,开始为白色菌落;培养3 d后,菌落边缘呈白色,中心为蓝绿色;培养8 d后,菌落呈深绿色。
2.1.2直接压片法结果 痰涂片直接压片结果可见典型呈45°分枝的鹿角样曲霉菌菌丝。
2.1.3亚甲蓝染色 痰涂片亚甲蓝染色结果见图1,可见烟曲霉子囊孢子和典型呈45°分枝的鹿角样菌丝。
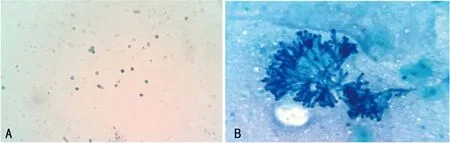
注:A为烟曲霉子囊孢子(×400);B为鹿角样菌丝(×400) 。
2.1.4改良GMS染色 改良GMS染色结果见图2,可见烟曲霉培养物子囊孢子(图2A),痰涂片可见典型呈45°分枝的鹿角样菌丝(图2B);图2C和图2D分别显示烟曲霉培养物在油镜和40倍镜下的烟曲霉顶囊,呈烧瓶状,可见分生孢子梗,偶见分枝。

注:A为烟曲霉子囊孢子(×400);B为鹿角样菌丝(×100);C为烟曲霉顶囊(×1 000);D为烟曲霉顶囊(×400)。
2.2分子鉴定结果
2.2.1TA克隆测序结果 本研究中分离的2株烟曲霉不同基因扩增测序结果分别与Genbank已公布序列经Blast分析结果显示,rodA基因的同源性为100.00%;anxc4的基因测序结果显示第30位存在T/C突变,其与Genbank已公布的烟曲霉anxc4同源性大于99.75%(其中C3与KU575847等同源性为100.00%,C4与KU575763的同源性为100.00%)。β-tub基因测序结果与Genbank已公布的烟曲霉β-tub基因同源性为100.00%(Genebank No.KU714964);ITS基因测序结果与Genbank已公布的烟曲霉ITS基因同源性为100.00%(Genebank No.MT297633);cyp51B基因测序结果与Genbank已公布的烟曲霉cyp51B基因同源性为100.00%(如MF070895);cyp51A基因测序结果与Genbank已公布的烟曲霉cyp51A基因同源性为100.00%(如MT468488)。见表3。
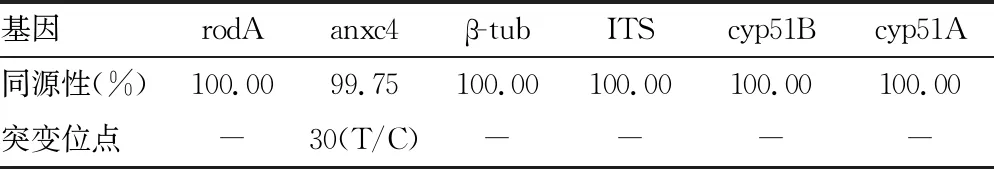
表3 2两株烟曲霉不同基因同源性分析结果
2.2.2LAMP检测结果 LAMP扩增后,离心,可见阴性对照无白色沉淀,阳性对照与本研究所收集的标本可观察到白色沉淀;LAMP反应体系中加入HNB溶液,恒温扩增后,可视化检测结果阴性对照为紫色,阳性对照与阳性标本为蓝色;上述扩增产物于2%琼脂糖凝胶进行琼脂糖凝胶电泳,阳性对照与阳性标本为LAMP扩增典型梯度条带,阴性对照无条带;real-time LAMP扩增结果显示,阴性对照无扩增,为一水平直线,阳性对照和阳性标本出现“S”型荧光扩增曲线,见图3。白色沉淀、HNB可视化检测结果、琼脂糖凝胶电泳结果与real-time LAMP荧光扩增曲线结果一致,提示LAMP能准确快速鉴定疑似IPA患者呼吸道分泌物中烟曲霉基因。
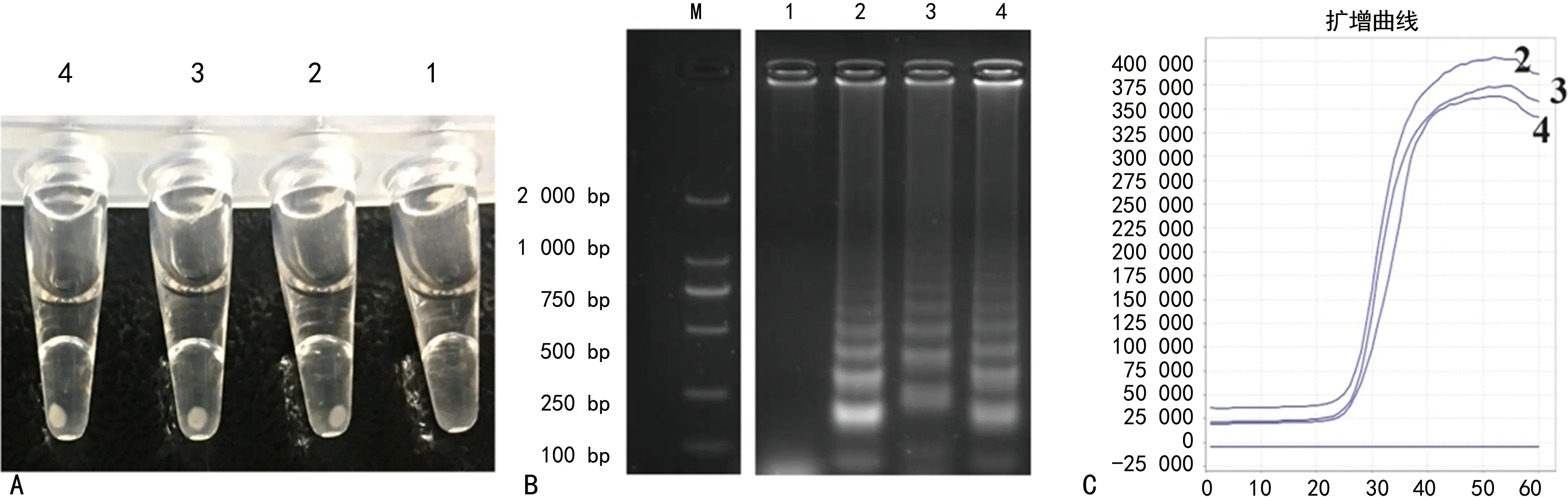
注:A为白色沉淀;B为琼脂糖凝胶电泳结果;C为real-time LAMP 检测结果;M为DL 2 000 DNA Marker,1为阴性对照,2为阳性对照,3、4为阳性标本。
3 讨 论
烟曲霉广泛存在于自然界,是IPA最常见的一类机会性致病真菌[3-4]。近年来,随着烟曲霉易感人群诸如恶性肿瘤、器官移植受者等免疫机能低下患者的增加,IPA发病率呈逐年上升趋势,其病死率在50%以上[5-6]。快速、准确鉴定烟曲霉,对于严重感染者及时诊断、防治及改善预后至关重要。本研究对本院2例疑似IPA患者的痰液分别进行普通真菌培养、真菌显色培养、直接压片镜检、亚甲蓝染色镜检、改良GMS染色镜检等病原学检测,同时提取其DNA,应用rodA、anxc4、β-tub、ITS、cyp51A和cyp51B基因进行PCR、LAMP、TA克隆、分子鉴定,确定致病菌株为烟曲霉。尽管传统的病原学培养方法检测烟曲霉感染的金标准,但其耗时长,灵敏度低;真菌显色培养菌落颜色虽出现白色-蓝绿色-深绿色的转变,但需要3~8 d随时观察菌落生长状况,且不易与其他曲霉菌菌落形态显色区分;直接压片镜检、亚甲蓝染色镜检虽可见烟曲霉子囊孢子和鹿角样菌丝,但较难与其他曲霉菌形态区分,且镜检时菌丝易与黏液混淆;GMS染色法是检测真菌感染常用的一种染色方法,本研究对传统GMS染色方法进行了改良,缩短了染色时间,镜检可见烟曲霉特征性的顶囊结构,此方法也存在一定局限性,要求检验技术人员具备真菌形态学辨别与鉴定的丰富经验。此外,真菌是实验室常见的污染物之一,病原学检测的特异性并不理想。
rodA、anxc4、β-tub和ITS基因都是曲霉菌分子鉴定中研究的热门靶基因,cyp51A和cyp51B基因与烟曲霉对唑类药物的耐药性相关,也是常用于烟曲霉分子鉴定中的靶基因。本研究分别对临床分离的2株烟曲霉的上述基因进行PCR扩增、TA克隆、鉴定、测序,序列分析结果显示,其与Genbank已公布烟曲霉上述基因的同源性均大于99.7%,确定为烟曲霉菌株。PCR分子鉴定方法较传统病原学方法更快速,且更灵敏,随着PCR条件和核酸测定技术不断成熟,其可能成为临床实验室检测并鉴定丝状真菌的一种技术。然而,PCR分子鉴定方法步骤较多,对临床实验室检验人员以及核酸的质量、纯度、浓度要求较高,且在临床标本的评估中存在较大局限性,阻碍了基于PCR技术在临床实验室应用的推广和发展。尽管针对PCR扩增产物直接测序更加迅速,但为避免直接测序结果中存在某些突变位点是否由于PCR扩增本身所引起。本研究通过TA克隆后再进行测序,保证了测序结果的可靠性。此外,基因突变的原因复杂,遗传因素、机体自身或是PCR扩增过程均可导致碱基的缺失、置换和插入等,且随着Genbank数据库中相似核苷酸序列的逐年更新,序列同源性比对的解读、分析与鉴定更为困难。因此,以病原形态学检测方法为基础,进一步应用PCR的分子鉴定技术确定烟曲霉较可靠。
LAMP是2000年NOTOMI等[7]设计并建立的一种恒温、快速、灵敏的分子生物学核酸扩增诊断技术,随着该技术的不断发展与完善,其广泛应用于临床传染性和非传染性疾病的分子诊断,预计其可替代PCR技术,并且对于将来实现全民健康覆盖(UHC)具有十分重要的价值[8]。本研究以烟曲霉anxc4为目的基因,且选择使用经验证特异性强、检测灵敏度高的LAMP扩增引物,通过将LAMP扩增技术与传统烟曲霉病原学检测方法和PCR技术进行比较,结果显示其可在63 ℃ 1 h 内进行扩增,并同时对扩增产物进行检测,表明其可快速、有效鉴别烟曲霉菌株。LAMP技术简单、高效、快捷,其扩增效率高于PCR,能满足低拷贝数标本的检测[2,8],且该方法对操作技术、仪器设备、标本处理的要求较低。其他实验室检测诸如血清和支气管肺泡灌洗液(BALF)中半乳糖甘露聚糖(GM)和1,3-β-D-葡聚糖检测(G)的检测,虽然对于IPA患者的诊断具有重要的临床意义[9-11],但仅有约50%的检测结果与病原学检测结果相匹配[12],且特异性较差。此外,欧洲癌症研究和治疗组织/侵袭性真菌感染协作组(EORTC/MSG)对IPA诊断标准仍依赖于组织病理学和传统病原学培养方法,然而在临床实践中,疑似IPA患者体质较弱,往往不耐受侵入性操作,不利于IPA患者的早期诊断。因此,LAMP技术适用于早期烟曲霉感染者的临床实验室鉴定。
综上所述,传统病原学鉴定烟曲霉的方法存在耗时长、灵敏度低等局限性,PCR和LAMP分子诊断技术较传统方法反应迅速且灵敏度高,LAMP技术较PCR操作简单。因此,LAMP技术更适用于临床实验室对IPA患者呼吸道分泌物中烟曲霉的早期鉴定,可辅助提升临床IPA的诊断效率,为临床治疗提供依据。此外,进一步阐明烟曲霉结构、功能、耐药性及耐药机制对抗真菌药物的设计与开发具有重要意义。