2型糖尿病亚临床性周围神经病变的危险因素分析
2021-11-02秦洁行宋峥宏杨晓岚高丽
秦洁行,宋峥宏,杨晓岚,高丽
糖尿病周围神经病变(DPN)是糖尿病最常见的慢性并发症和主要致残因素之一。DPN起病隐匿,以肢体疼痛麻木为突出特点,最终导致足部溃疡、坏疽,甚至截肢,严重影响患者的生活质量,给社会和家庭带来了沉重的负担[1]。因此,早期发现DPN,减缓病情进展,避免足部溃疡、坏疽甚至截肢的发生,显得尤为重要。研究[2]表明,DPN的病理改变早于其临床症状的出现,早期神经电生理检查可发现亚临床性DPN(sDPN)。sDPN是指患者在神经传导功能检查(NCS)或小纤维神经病变测量中存在神经异常,但不表现出任何周围神经病变的症状或体征[3]。近年来,神经电生理检测技术的不断发展和完善为早期识别sDPN提供了可靠的依据。然而,在临床实践过程中,仅有少部分的患者能在发病早期进行及时有效的神经电生理检查。因而,寻找sDPN的早期预警信号或危险因素,对sDPN的早期识别和及时诊断具有重要意义。
本研究旨在探索临床上遇到无肢体麻木、疼痛等周围神经病变症状和体征的2型糖尿病患者,除进行神经电生理检查发现sDPN外,有哪些危险因素值得我们重视和关注,为制定sDPN的早期诊疗策略改善患者预后提供临床依据。
1 对象与方法
1.1 对象 收集2018年1月至12月在上海仁济医院南院区住院并完成EMG检查的2型糖尿病患者135例。所有患者符合2020年美国糖尿病协会制定的2型糖尿病诊断标准[4],且糖尿病神经病变症状评分(DNS)为0分[5]。排除1型糖尿病、妊娠期糖尿病或其他原因引起的特殊糖尿病类型,并排除以下可能造成周围神经病变的情况:(1)有颈/腰骶神经根病变的症状体征或颈腰椎MRI提示明确的神经根受压;(2)已明确的自身免疫性疾病(如系统性红斑狼疮、皮肌炎等)、血液系统疾病(如M蛋白血症等)或恶性肿瘤;(3)合并甲状腺功能异常或影响代谢的内分泌疾病;(4)有毒物接触史、药物滥用史及偏食者;(5)拟诊其他原因所致周围神经病变。
1.2 方法
1.2.1 一般资料收集 通过调阅病历记录,采集以下数据:性别、年龄、糖尿病病程、二甲双胍使用史、吸烟史、酗酒史、BMI指数、身高、腰臀比、高血压病史。BMI指数由体重(kg)除以身高(m)的平方计算得出,单位为kg/m2。腰臀比是腰围与臀围的比值,根据2008年日内瓦世卫组织专家共识,男性和女性的正常值分别为0.9和0.8。高血压病史指入院安静状态下测得收缩压≥130 mmHg(1 mmHg=0.133 kPa)和/或舒张压≥80 mmHg或有降压药物使用史。本研究经上海仁济医院伦理委员会批准。
1.2.2 生化资料收集 收集患者入院次日空腹血液标本的生化检查数据,包括血红蛋白、空腹血糖、空腹C肽、糖化血红蛋白、低密度脂蛋白、三酰甘油、高密度脂蛋白、血清总胆红素、血肌酐、血尿酸,同时收集患者清晨尿液标本测定的尿白蛋白/肌酐比值(UACR)。UACR由尿白蛋白除以尿肌酐计算得出,30~299 mg/g的UACR被定义为微量白蛋白尿;≥300 mg/g的比率被定义为大量白蛋白尿。根据世界卫生组织指南,血红蛋白在男性和女性分别低于13 g/dl和12 g/dl,作为贫血的诊断依据;空腹C肽水平低于实验室标准0.78 ng/ml定义为低空腹C肽。
1.2.3 EMG检查 每个受试者均接受EMG(key point,丹麦阿尔卑斯山生物医药有限公司)检查,评估正中神经、尺神经、腓总神经和胫神经的运动传导,正中神经、尺神经、腓浅神经和腓肠神经的感觉传导以及针极EMG检查。记录的参数包括远端潜伏期(ms)、振幅(mV)和传导速度(m/s)。根据实验室正常参考值来判断振幅、速度和远端潜伏期为异常。每位患者均完善F波及H反射检查,因为F波主要反应近端神经的情况,而DPN还是远端为著。H反射虽然敏感性高,但是特异性不强,神经根病变也会引起H反射的异常,所以仅表现为H异常的患者没有归为异常组。因而,主要通过远端潜伏期、波幅及速度来判断是否存在周围神经损害。检查室内没有干扰源,环境保持安静。检查室温度保持在18~25 ℃,局部皮肤温度保持恒定(28~30 ℃)。
1.2.4 sDPN诊断 根据2010年多伦多糖尿病神经病变专家共识[6],如果患者有神经传导的异常,诊断为DPN。进一步评估患者有无DPN的症状或体征,当DNS评分为0时,诊断为sDPN[4]。
2 结 果
2.1 分组及临床指标的比较 见表1。47例患者神经传导检查异常,诊断为sDPN(sDPN组),88例患者神经传导检查正常(无DPN组)。与无DPN组患者相比,sDPN组患者年龄更高,长病程比例更高,空腹C肽水平更低,高UACR比例更高(均P<0.05)。两组在性别、吸烟饮酒史、二甲双胍使用史、身高、BMI指数、腰臀比、空腹血糖、糖化血红蛋白、血肌酐、尿酸、血脂及是否合并高血压、贫血等方面的差异无统计学意义(均P>0.05)。
2.2 sDPN的多因素Logistic回归分析 见表2。将P<0.15的自变量引入多因素Logistic回归模型,分析结果显示,高UACR、低空腹C肽是sDPN发病的独立危险因素(OR=2.233,95%CI:1.156~4.312;OR=3.255,95%CI:1.305~8.120)。
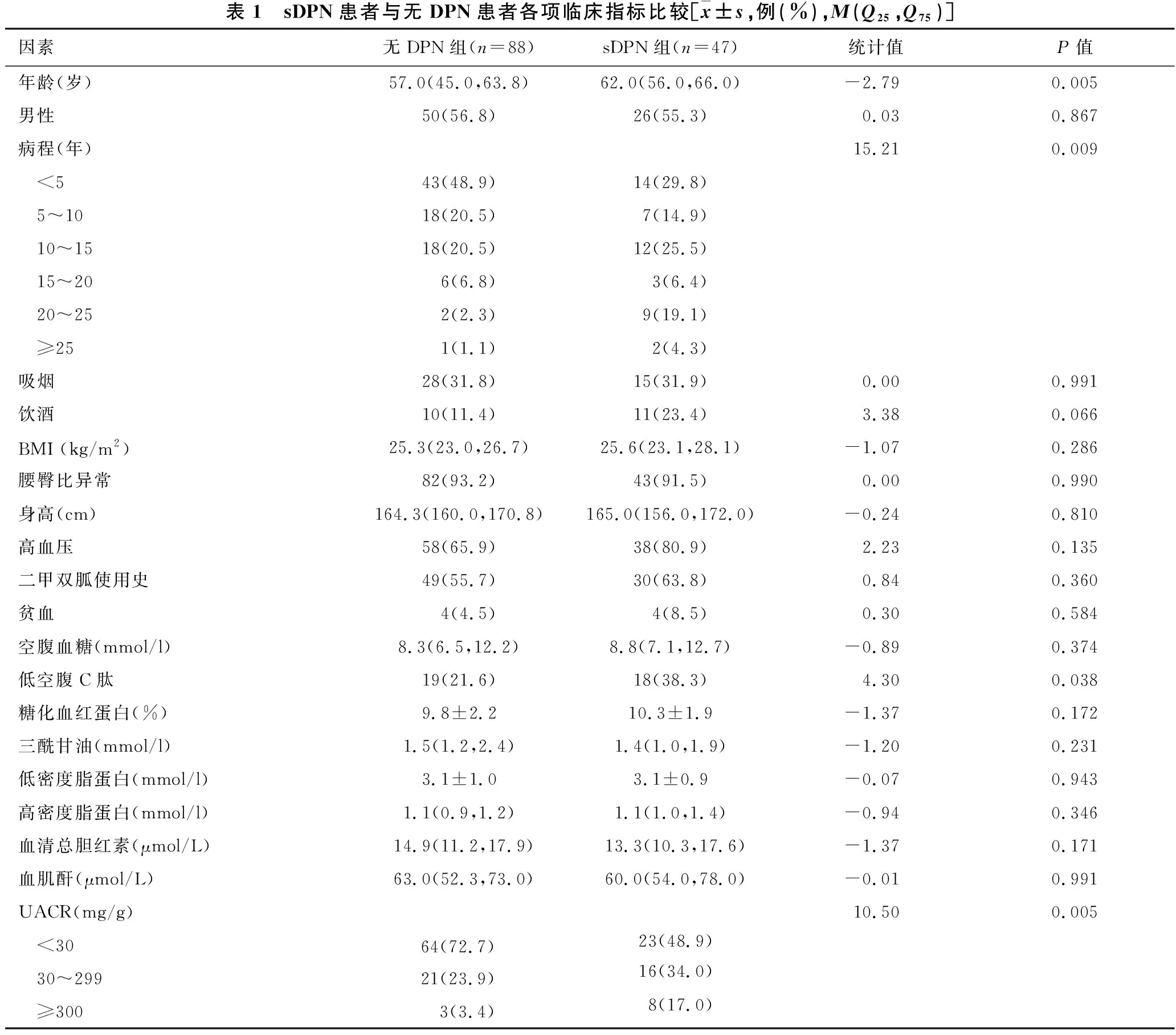
表1 sDPN患者与无DPN患者各项临床指标比较[x±s,例(%),M(Q25,Q75)]因素无DPN组(n=88)sDPN组(n=47)统计值P值年龄(岁)57.0(45.0,63.8)62.0(56.0,66.0)-2.790.005男性50(56.8)26(55.3)0.030.867病程(年)15.210.009 <543(48.9)14(29.8) 5~1018(20.5)7(14.9) 10~1518(20.5)12(25.5) 15~206(6.8)3(6.4) 20~252(2.3)9(19.1) ≥251(1.1)2(4.3)吸烟28(31.8)15(31.9)0.000.991饮酒10(11.4)11(23.4)3.380.066BMI (kg/m2)25.3(23.0,26.7)25.6(23.1,28.1)-1.070.286腰臀比异常82(93.2)43(91.5)0.000.990身高(cm)164.3(160.0,170.8)165.0(156.0,172.0)-0.240.810高血压58(65.9)38(80.9)2.230.135二甲双胍使用史49(55.7)30(63.8)0.840.360贫血4(4.5)4(8.5)0.300.584空腹血糖(mmol/l)8.3(6.5,12.2)8.8(7.1,12.7)-0.890.374低空腹C肽19(21.6)18(38.3)4.300.038糖化血红蛋白(%)9.8±2.210.3±1.9-1.370.172三酰甘油(mmol/l)1.5(1.2,2.4)1.4(1.0,1.9)-1.200.231低密度脂蛋白(mmol/l)3.1±1.03.1±0.9-0.070.943高密度脂蛋白(mmol/l)1.1(0.9,1.2)1.1(1.0,1.4)-0.940.346血清总胆红素(μmol/L)14.9(11.2,17.9)13.3(10.3,17.6)-1.370.171血肌酐(μmol/L)63.0(52.3,73.0)60.0(54.0,78.0)-0.010.991UACR(mg/g)10.500.005 <30 64(72.7) 23(48.9) 30~299 21(23.9)16(34.0) ≥300 3(3.4)8(17.0)
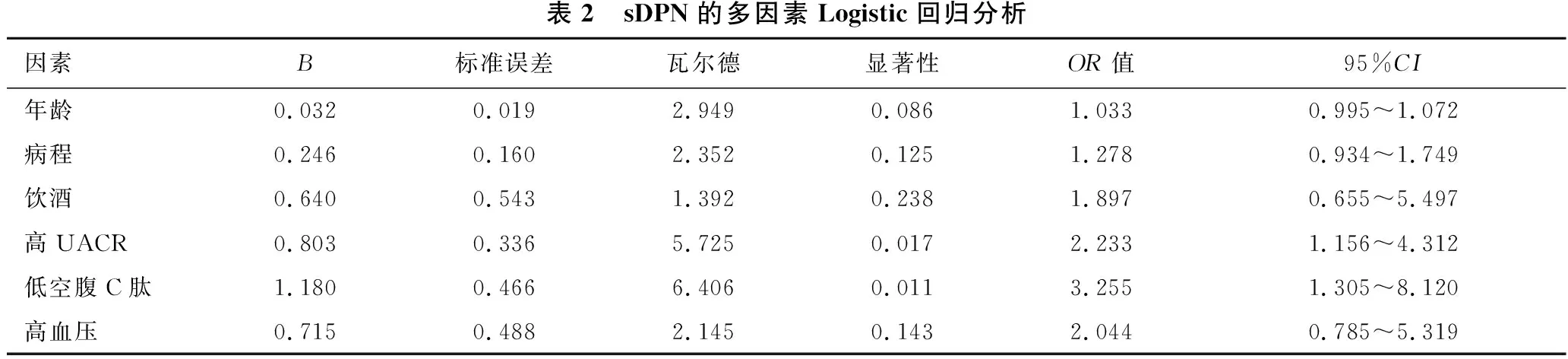
表2 sDPN的多因素Logistic回归分析因素B标准误差瓦尔德显著性OR值95%CI年龄0.0320.0192.9490.0861.0330.995~1.072病程0.2460.1602.3520.1251.2780.934~1.749饮酒0.6400.5431.3920.2381.8970.655~5.497高UACR0.8030.3365.7250.0172.2331.156~4.312低空腹C肽1.1800.4666.4060.0113.2551.305~8.120高血压0.7150.4882.1450.1432.0440.785~5.319
3 讨 论
DPN是糖尿病最常见的慢性并发症和主要致残因素之一。近年来的研究[2]表明,至少50%的糖尿病患者会出现DPN。DPN的主要病理变化是无髓鞘神经纤维轴突变性,有髓鞘神经纤维髓鞘皱缩或脱髓鞘,伴随着髓鞘再生引起的郎飞结节间长度改变[7]。近年来的研究[2,6]表明,DPN的病理改变早于其临床症状的出现,NCS可发现DPN的亚临床病变,提高早期sDPN的诊断率。然而,NCS只能反映有髓大纤维神经的功能状态,对鉴别小纤维神经或自主神经病变不敏感,且很多sDPN患者在疾病早期并不能得到及时有效的神经电生理检查。因此,探索sDPN的危险因素,提高sDPN的早期检出率,对降低DPN的病残程度,提高患者生活质量具有重要的意义。本研究发现,sDPN组患者的年龄、病程、空腹C肽及UACR均与无DPN组患者均存在统计学差异,且低空腹C肽和高白蛋白尿是sDPN发病的独立危险因素。
DNS评分是由Meijer等[5]提出,常用于量化和评估DPN症状严重程度的临床评分。DNS主要包括肢体的疼痛、针刺感、麻木及步态不稳四项症状,简单易行,适用于门诊DPN患者的筛查。Bertora等[8]和Akbar等[9]通过对DNS评分为0的糖尿病患者的随访发现,sDPN的患病率均高于50%。在本研究纳入的135例DNS评分为0的2型糖尿病患者中,仅有47例患者神经传导检查异常诊断为sDPN,患病率为35%,这些差异可能与样本量、种族、纳入标准等多种因素有关。
DPN的主要类型包括远端对称性多发性周围神经病、自主神经病、单神经病或多发单神经病、神经根神经丛病等[10]。在电生理检查中可表现为F波异常、神经传导速度减慢、动作电位波幅下降、远端潜伏期延长等,通常感觉神经异常早于运动神经,且呈长度依赖性,下肢受累更重于上肢[6,11]。在本研究中47例sDPN患者中,22例(46.8%)表现为远端对称性多发性周围神经病,19例(40.4%)表现为单神经病或多发单神经病(包括正中神经腕部损害、尺神经肘部损害、腓总神经腓骨小头处损害等),6例(12.8%)表现为多发性周围神经病合并单神经病。这些sDPN患者均无周围神经病变的临床症状和体征,但是神经电生理检查已检出周围神经的病损。这可能与2型糖尿病患者代谢功能障碍以及微血管病变等原因引起周围神经缓慢变性,同时神经组织也出现不同程度的代偿有关。
DPN的发病机制复杂,目前认为可能与代谢紊乱、微循环障碍、氧化应激损伤、神经营养因子缺乏等多种因素有关。Pai等[12]对2 837例2型糖尿病患者的一项观察性研究显示,高龄、白蛋白尿与DPN密切相关,而高龄、糖化血红蛋白高、高密度脂蛋白低及大量白蛋白尿是DPN伴神经痛的独立危险因素。Zhang等[13]对1 059例2型糖尿病患者研究发现,较低的肾小球滤过率(eGFR)和较高的UACR可能与DPN发病相关,且UACR比eGFR更敏感,UACR是DPN的中等预测因子。本研究发现,sDPN组患者的UACR显著高于无DPN组患者,高白蛋白尿是sDPN发病的独立危险因素。Thomas等[14]推测尿白蛋白水平的升高提示了高糖状态下细胞炎症反应和氧化应激状态,也是糖尿病患者发生微血管疾病的独立预测因素。此外,也有研究[15]报道,尿白蛋白水平升高可预示血管内皮功能障碍,而血管内皮损伤导致血流减少,血液黏度增加,血管阻塞组织缺血缺氧,最终导致神经纤维变性以及传导功能障碍。
2005年,Brownlee[16]提出了糖尿病并发症的核心是高血糖引起线粒体中超氧阴离子生成过多,诱导氧化应激,高血糖毒性是引起DPN的原因之一。近年来有证据[17]表明,与慢性持续高血糖相比,血糖的波动对内皮功能损伤、炎性因子释放和氧化应激的影响更剧烈。一项荟萃分析[18]的结果显示,单纯降低血糖水平仅能改善神经传导和振幅的异常,但并不能降低2型糖尿病患者DPN的发生率。减少空腹血糖的变异性却可以降低糖尿病微血管并发症,显著降低DPN的发病风险,而胰岛β细胞功能衰竭正是引起血糖波动的主要原因之一[19-20]。C肽是胰岛素原被裂解成胰岛素时产生的含31个氨基酸的多肽,不受外源性胰岛素的影响,能在一定程度上反映胰岛β细胞的功能。本研究结果显示,与无DPN组患者相比,sDPN组患者空腹C肽水平更低。C肽作为一种生物活性多肽,在糖尿病神经并发症中具有重要的作用。动物实验[21]发现,C肽可激活Na+-K+-ATP酶促进内皮型NO释放,改善微循环,影响神经因子的表达及转录因子的合成和凋亡,改善或逆转神经变性。Ekberg等[22]对139例早期1型糖尿病患者的一项随机、双盲、对照研究发现,6个月的C肽治疗可部分逆转感觉传导速度的下降,改善神经损伤评分和震动觉。张东铭等[23]研究发现,空腹C肽水平与2型糖尿病患者DPN的病情分期呈负相关。本研究结果进一步显示,sDPN组患者空腹C肽水平降低,空腹C肽低是2型糖尿病患者sDPN发病的独立危险因素。目前,对C肽与2型糖尿病DPN发病的相关性还没有定论,仍需大规模的临床研究进一步证实。
综上所述,本研究初步发现,与无DPN组患者相比,sDPN组患者的年龄、病程、空腹C肽水平及UACR均存在统计学差异,高白蛋白尿和低空腹C肽是sDPN发病的独立危险因素。在临床上遇到此类患者时,即使患者没有肢体麻木或疼痛等周围神经病变的症状或体征,仍应建议完善神经电生理检查尽早发现sDPN,减缓病情进展。当然,本研究作为仅为回顾性研究,且样本量偏小,NCS只能反应有髓鞘的大神经纤维的功能状态,对鉴别小神经纤维病变不敏感。因而,仍需扩大样本量,进行大规模的前瞻性队列研究,明确sDPN发病的危险因素,为明确sDPN的发病机制进一步制定特异性干预策略提供循证医学的证据。
