HPLC法测定9种饮料中阿斯巴甜含量研究①
2021-11-02夏秋霞张东京李宛蓉
夏秋霞, 王 晴, 张东京, 姚 坤, 李宛蓉, 赵 国
(宿州学院生物与食品工程学院,安徽 宿州234000)
0 引 言
阿斯巴甜常被用来代替蔗糖,添加到饮料、泡菜和罐头等食品中[1-3]。可是现今食品商标中对阿斯巴甜的标注混乱,有的甚至不标注,容易造成苯丙酮尿症意外消耗阿斯巴甜[4]。消费者超量或者过量食用阿斯巴甜会对自身健康造成一定危害[5]。研究表明阿斯巴甜与氧化应激、炎症和肝脏损伤有关,长期服用可导致小鼠肝脏纤维化、炎症小体激活和葡酮生成障碍[6]。研究报道HPLC法可以用来测定碳酸饮料[7]、酸奶[8]、笋制品[9]和槟榔[10]等食品中阿斯巴甜含量,实验采用HPLC法对市场中9种饮料样品中阿斯巴甜测定,优化色谱条件,为今后阿斯巴甜的检测和与此相关的研究提供了一定的理论参考。
1 实验材料与方法
1.1 实验材料与试剂
9种饮料均购于当地超市,按顺序依次编号1-9;阿斯巴甜标准品(纯度>99.8%)购于中国药品生物制品检定所、甲醇、乙醇等均购于国药集团化学试剂有限公司。
1.2 实验仪器
高效液相色谱仪Agilent(安捷伦科技(中国)有限公司);数控超声波清洗器KQ5200D型(昆山市起声仪器有限公司)等。
1.3 实验方法
1.3.1 阿斯巴甜标准曲线的测定[11]
取阿斯巴甜标准品配制5.0μg/m L、10.0μg/m L、25μg/m L、50μg/m L、100μg/m L的 标 准 使 用溶液系列,经过滤测定,得到标准线性回归方程是
1.3.2 饮料中阿斯巴甜的提取[12-14]
碳酸类饮料:称取5g(精确到0.001g)碳酸饮料样品,在40℃水浴,超声5min,经定容离心,过滤测定。果味类饮料:称取2g(精确到0.001g)果味饮料试样,定容和混匀后同碳酸饮料。乳味类饮料:称取5g(精确到0.001g)乳味饮料试样,加入10m L乙醇,混匀静置1min,离心过滤,沉淀洗涤离心后过滤测定。
1.3.3 色谱条件实验
取10.0μg/m L标准使用溶液,过滤进样测定10次,流动相甲醇百分含量分别为35%、36%、37%、38%、39%、40%、41%、42%、43%、44%;柱温为5℃、10℃、15℃、20℃、25℃、30℃、35℃;流速为0.4m L/min、0.6m L/min、0.8m L/min、1.0m L/min、1.2m L/min、1.4m L/min、1.6m L/min;波长 为204nm、206nm、208nm、210nm、212nm、214nm、216nm,进样测定。
1.3.4 含量的计算方法

式中:X样为品中阿斯巴甜的含量(mg/kg);ρ为阿斯巴甜的浓度(μg/m L);V为定容体积(m L);m为样品质量(g);
1.3.5 实验质量控制
(1)精密度实验:取10.0μg/m L标准液,经超声过滤后测定6次,记录每次测量结果。
(2)稳定性实验:取5份20.0μg/m L标准液,按顺序编号1-5,分别放置在室温阴凉处1h、2h、3h、4h、5h后超声过滤后测定。
(3)加标回收实验:在处理样品的同时每个编号再额外称取两份等量样品,加入阿斯巴甜标准使用液,1-9编号样品加标浓度分别7.00mg/L、7.00mg/L、7.00mg/L、10.0mg/L、10.0mg/L、10.0mg/L、13.0mg/L、13.0mg/L、13.0mg/L进 样 测定其实际浓度并计算回收率。
2 结果分析
2.1 阿斯巴甜的标准曲线
2.2 色谱条件分析结果
2.2.1 甲醇百分含量结果分析
由图1可知:当甲醇含量在35%~44%范围时,检测峰面积先增大后缓慢降低,在流动相甲醇百分含量为39%时达到最大5.57,根据标准曲线可知峰面积与阿斯巴甜浓度成正比,即甲醇百分含量为39%时,阿斯巴甜有最大吸收。所以实验流动相甲醇百分含量选用39%。

图1 甲醇百分含量对峰面积的影响
2.2.2 柱温结果分析
由图2可知:从5℃至30℃随着柱温的增大,峰面积也不断增大,在30℃达到最大5.5m AU*min;从30℃至35℃随柱温增大,峰面积反而减小。出现这种情况可能是因为柱温增大的同时,不仅峰面积会增大,色谱柱中的分子扩散效应也会增加,而剧烈的扩散效应并有碍于待测组分的分离。所以实验的最适柱温应为30℃。
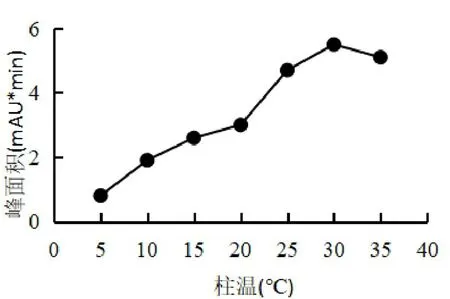
图2 柱温对峰面积的影响
2.2.3 流速结果分析
由图3可知:在流速为0.4m L/min至0.8m L/min时,峰面积随流速增大而增大;在流速为0.8m L/min至1.6m L/min时,峰面积随流速增大而减小,当流速为0.8m L/min时,峰面积最大5.3m AU*min。由此知道当其他条件不变时,峰面积并非与流速成正比。主要原因可能是流速增大,管道中的涡流效应也相应增加,而一定的涡流效应会影响样品组分的分离和检测器的信号采集,从而影响峰面积。

图3 流速对峰面积的影响
2.2.4 检测波长结果分析
由图4可知:在204nm至210nm时,峰面积逐渐增大由4.96m AU*min增到5.60m AU*min;在208nm至216nm时,峰面 积 减 小 至4.95m AU*min,图中波长在208nm-210mn处,图像较为平缓,说明此波段内,阿斯巴甜有最大吸光度,所以实验最适检测波长应在此波段内选取,经综合考虑,实验选取210nm为实验检测波长。

图4 检测波长对峰面积的影响
2.3 样品测定结果
由图5中可知:1-9号样品中阿斯巴甜含量均未超标,其中被测组分中3号测定含量最大,为0.202mg/kg,4号组分未检出。若按饮料类别来看:编号1、2、3是碳酸饮料类,其平均含量为0.148mg/kg;编号4、5、6是果味饮料类,其平均含量为0.024mg/kg;编号7、8、9是乳味饮料类,平均含量为0.079mg/kg,含量关系:碳酸饮料类>乳味饮料类>果味饮料类。由此推测在市场中饮料中的用量使用满足:碳酸饮料类>乳味饮料类>果味饮料类,主要因素与阿斯巴甜的性质有关,但猜想是否成立还需要进一步探究和验证。

图5 阿斯巴甜含量分布图
2.4 精密度实验结果分析
由表1可知:精密度实验得出6组峰面积数值,对其进行数据处理计算数据之间的RSD值为1.233,符合实验质量控制要求,同时表明仪器进样稳定,对样品色谱峰面积测定灵敏。

表1 精密度实验结果

?
2.5 稳定性实验结果分析
由表2可知,从2h到12h时,峰面积随放置时间稍有增加。造成这种现象的原因可能仪器测定后存在微量的残留,但这种现象对实验并没有影响,通过计算得出数据结果间的RSD值为0.395%,符合实验质量控制要求。

表2 稳定性实验结果
2.6 加样回收率结果分析
从表3可知,在所做的9组实验中,编号1-3为碳酸饮料类,实验提取方法简单,提取过程中阿斯巴甜不易损耗,所以选择加标浓度为7mg/m L;编号4-6为果味饮料类,实验提取方法比碳酸饮料类复杂,阿斯巴甜损耗也多,所以增加加标浓度到10mg/m L,;编号7-9为实验中最难提取的乳味饮料类所以选择加标浓度为13mg/m L。从实验结果看,9组实验结果平均回收率为100.3%,RSD值为0.33%,各组回收率也均大于90%,符合实验质量控制要求。

表3 加样回收率结果

?
3 结 论
通过对色谱分析条件实验得到检测饮料中阿斯巴甜含量的最佳色谱条件:流动相39%甲醇水溶液、柱温30℃、流速0.8m L/min、检测波长210nm,在此色谱条件下测得编号1-9真实含量分别为0.164mg/kg、0.079mg/kg、0.202mg/kg、0.00mg/kg、0.029mg/kg、0.043mg/kg、0.121mg/kg、0.063mg/kg、0.053mg/kg,碳酸饮料类平均含量为0.148mg/kg;果味饮料类平均含量为0.024mg/kg;乳味饮料类,其平均含量为0.079mg/kg,其中碳酸饮料类>乳味饮料类>果味饮料类。为了提高阿斯巴甜含量测定的准确率,进行精密度实验、稳定性实验、加标回收实验。精密度实验得出6组峰面积RSD值为1.233%,小于1.5%;稳定性实验得出RSD值为0.395%;9组实验平均回收率为100.3%,RSD值为0.33%,研究为食品中阿斯巴含量测定提供理论依据[18]。
