槲皮素对T2DM小鼠代谢相关脂肪性肝损伤的保护*
2021-11-02梅桂斌姜纯杰
梅桂斌,陈 力,姜纯杰,姚 平
华中科技大学同济医学院公共卫生学院营养与食品卫生学系,武汉 430030
中国大陆患糖尿病人数高达1.3亿,已成为严重的公共卫生问题[1]。持续高血糖导致的严重并发症和器官衰竭是造成2型糖尿病(type 2 diabetes mellitus,T2DM)患者不良健康结局的主要原因。肝脏是重要的胰岛素代谢器官,肥胖、代谢综合征(MetS)与胰岛素抵抗(IR)等典型的T2DM危险因素或病理生理学改变所致的代谢相关脂肪性肝病(metabolism-associated fatty liver disease,MAFLD)是常见的T2DM合并症。研究表明,70%的T2DM患者同时患有MAFLD[2],并且T2DM是肝纤维化等终末期肝病的关键预测因子[3]。同时,MAFLD也是T2DM进展的驱动者,可加剧不良代谢[4]、血脂异常[5]和糖尿病心肌病[6]等并发症。MAFLD在T2DM中的重要程度不言而明,然而目前对T2DM合并MAFLD的机制研究还很少,尚没有靶向T2DM合并MAFLD的治疗药物。因此,寻找干预靶点,对T2DM合并MAFLD进行有效防治具有重要意义。
日常饮食习惯的改变与膳食补充成为预防和治疗疾病的良好选择。富含于蓝莓、芒果、苹果、樱桃等多种植物性食品的槲皮素(3,3,4,5,7-五羟黄酮,quercetin),因具有良好生物活性而备受关注[7]。研究表明,槲皮素对糖尿病及多种模型的肝脏损伤有良好的保护作用。其可影响T2DM小鼠血糖水平[8],显著改善高糖处理肝细胞的线粒体功能[9],抑制肝脏炎症[10]。然而,目前有关槲皮素对T2DM合并MAFLD的作用和机制还不明确。
本研究通过高脂饲料(high fat diet,HFD)喂养联合腹腔注射链脲佐菌素(STZ)的方法构建T2DM模型,探究槲皮素干预对小鼠肝脏脂质沉积、组织形态、炎症以及纤维化的影响,以期为T2DM肝损伤模型中槲皮素的保护效应提供更多科学依据,进一步为T2DM合并MAFLD提供防治策略。
1 材料与方法
1.1 实验设计
本研究使用的SPF级7~8周龄雄性C57BL/6J小鼠均被饲养于恒温25 ℃、湿度为50%、黑暗/光循环为12 h间隔的环境中。适应性喂养1周后,40只小鼠随机分为2组,每组20只。两组小鼠分别喂饲HFD和正常饲料(10%脂肪)16周。在第17周,HFD组小鼠连续7 d腹腔注射小剂量STZ,建立T2DM模型,对照组小鼠则注射柠檬酸盐缓冲液。1周后,测得空腹血糖浓度大于≥16.9 mmol/L的小鼠视为T2DM造模成功。随后将正常饲养组小鼠分为正常对照组和槲皮素对照组,T2DM模型小鼠分为糖尿病组和糖尿病+槲皮素组,继续喂养。正常对照组(Con):正常饲料喂养;槲皮素对照组(Qu):每kg正常饲料中混入1.5 g槲皮素(相当于100 mg/kg体重);糖尿病组(DM):高脂喂养;糖尿病+槲皮素组(DM+Qu):每kg高脂饲料中混入1.5 g槲皮素进行干预。实验期间观察小鼠饮水、摄食并记录进食量,每周称量2次体重。共喂养34周后处死,留取各组小鼠血清和肝脏样本保存,用于后续实验。基础饲料组成及营养水平如表1所示。

表1 动物饲料配方(克)Table 1 Animal feeding stuff formula(g)
1.2 实验材料
collagenⅠ抗体、α-SMA抗体购于英国Abcam公司。p65抗体购于美国CST公司。CTGF抗体购于美国Santa公司。ALT(谷丙转氨酶)、AST(谷草转氨酶)检测试剂盒购于南京建成生物工程研究所。TRIzol RNA提取试剂购于美国Thermo Fisher Scientific公司。PCR引物购于武汉擎科生物科技有限公司。Prime Script RT reagent kit、SYBR Premix Ex TaqTM购于日本TaKaRa公司。微量核酸浓度测定仪购于美国Thermo Fisher Scientific公司。7900HT荧光实时定量PCR仪购于美国ABI公司。超声检测仪购于法国Supersonic Imagine公司。荧光倒置显微镜购于日本OLYMPUS公司。
1.3 检测指标
1.3.1 血清转氨酶水平检测 将37 ℃预温的基质液与血清待测样本混匀,水浴30 min后加入苯肼,混匀后再次37 ℃水浴20 min,水浴结束后加入氢氧化钠溶液,点板,酶标仪于505 nm处读取吸光度值,根据标准曲线计算酶活性。
1.3.2 肝脏组织病理学染色 小鼠肝脏组织于4%多聚甲醛中固定,经石蜡包埋,制成10 μm的切片备用。切片复水后,用苏木精染细胞核,伊红染细胞质,经脱水封片,显微镜下成像分析,观察细胞核染色、肝小叶结构、肝细胞排列等。上述切片在经Masson染料染色后,观察蓝色胶原纤维数量。小鼠肝脏冰冻组织,OCT包埋后,利用冰冻切片机制成8 μm的切片,脂溶性染料油红O对肝脏脂质进行染色,反映肝脏脂质沉积。
1.3.3 组织病理学评分 为量化肝损伤,采取Kleiner(2005)的临床研究网络评分系统对非酒精脂肪性肝病活动度(NAFLD activity score,NAS)作半定量分析[11],评分标准如表2所示。

表2 临床研究网络评分系统Table 2 Clinical Research Network Score System
1.3.4 实时荧光定量PCR TRIzol试剂法提取肝脏组织RNA,使用紫外分光光度计测定RNA的浓度。去除基因组DNA后将RNA扩增为cDNA。根据试剂盒说明书添加各PCR扩增试剂及引物,最终形成10 μL反应体系,DNA扩增反应在7900荧光定量PCR仪(7900HT)上进行。所得数据使用SDS 2.4.1处理,以GAPDH表达量作内参对照,RNA相对表达量用2-ΔΔCt方法计算。引物基因序列如表3。

表3 引物基因序列Table 3 Primer gene sequences
1.3.5 超声剪切波弹性成像 实验结束前,将每组随机选择的小鼠送往华中科技大学同济医学院附属同济医院超声科,使用超声探测设备对麻醉后的小鼠肝脏进行超声剪切波弹性检测后成像,依据测得的肝脏硬度值量化不同组小鼠肝纤维化水平。
1.3.6 免疫组化 石蜡切片在枸橼酸钠溶液中抗原修复,随后用5%牛血清蛋白室温封闭30 min,加入最适比例一抗,4 ℃孵育过夜。PBS清洗后,加入相应二抗,孵育1 h,DAB辣根过氧化物酶显色,封片,显微镜下观察。
1.4 统计学方法

2 结果
2.1 槲皮素干预对血清转氨酶水平的影响
结果如图1所示,与对照组相比,T2DM小鼠血清ALT水平增加了2.73倍(P<0.01),AST增加了约2.18倍(P<0.01),槲皮素干预显著降低了ALT(P<0.01)、AST(P<0.05)水平,且槲皮素对照组与正常对照组相比无明显变化,表明槲皮素对T2DM小鼠肝损伤具有保护作用。

A:血清ALT水平统计(n=3);B:血清AST水平统计(n=3);Con:正常对照组;DM:糖尿病组;Qu,槲皮素对照组;DM+Qu:糖尿病+槲皮素组;与正常对照组比较,**P<0.01;与糖尿病组比较,#P<0.05,##P<0.01 图1 槲皮素干预对血清转氨酶水平的影响Fig.1 Effect of quercetin on serum transaminase level
2.2 槲皮素干预对肝脏组织病理学的影响
油红O染色与苏木精-伊红染色被用于描述小鼠肝脏脂质沉积与组织形态。如图2A所示,相比于正常饲料喂养或槲皮素单独喂养的小鼠,T2DM小鼠油红O染色切片视野内可见大片红色,表明有较为严重的脂质沉积,而经槲皮素干预后,小鼠肝脏脂滴数量显著减少。同时,苏木精-伊红染色结果(图2B)显示,T2DM小鼠肝组织结构紊乱,肝小叶与肝细胞排列均不规则,细胞质疏松;细胞核大小不一且呈聚集状,视野内有大量空泡化细胞,多见脂肪样变性。而槲皮素干预组小鼠肝细胞呈现较为整齐的排列,空泡细胞与脂肪样变性情况明显改善,未见明显炎性浸润(黑色箭头)。NAS评分用于量化苏木精-伊红染色结果,如图2B所示,T2DM组NAS评分为正常饲料喂养组的4.43倍(P<0.01),经槲皮素干预后,NAS评分显著下降(P<0.05)。

A:各组肝脏组织代表性油红O染色图片(×200);B:各组肝脏组织代表性苏木精-伊红染色图片(×400);C:NAS评分统计(n=3);Con:正常对照组;DM:糖尿病组;Qu,槲皮素对照组;DM+Qu:糖尿病+槲皮素组;与正常对照组比较,**P<0.001;与糖尿病组比较,##P<0.01图2 槲皮素干预对肝脏组织病理学的影响Fig.2 Effect of quercetin on liver histopathology
2.3 槲皮素干预对肝脏炎症的影响
使用实时荧光定量PCR的方法检测肝脏组织炎症因子IL-1β、IL-6、TNF-α和TGF-β的mRNA水平,以评估小鼠肝脏炎性损伤情况,初步探寻槲皮素的肝脏保护机制。如图3A~3D所示,与对照组相比,T2DM小鼠炎性因子mRNA水平均显著提升(均P<0.05),槲皮素干预可显著抑制炎性因子表达的异常增加(均P<0.05)。NF-κB是炎症进展的重要核转录因子,p65是NF-κB发挥转录起始作用的关键组成成分,免疫组化结果显示(图3E),T2DM小鼠肝脏p65表达水平显著上升,槲皮素处理则能有效降低p65表达(P<0.01)。以上结果提示,槲皮素能够有效拮抗炎症,其抗炎作用可能与NF-κB表达抑制有关。

A~D:各组肝脏炎性因子mRNA水平统计(n=3);E:免疫组织化学法检测NF-κB p65的代表性图片(×400)及定量统计(n=3);Con:正常对照组;DM:糖尿病组;Qu,槲皮素对照组;DM+Qu:糖尿病+槲皮素组;与正常对照组比较,*P<0.05 **P<0.01;与糖尿病组比较,#P<0.05##P<0.01图3 槲皮素干预对肝脏炎症的影响Fig.3 Effect of quercetin on liver inflammation
2.4 槲皮素干预对肝脏组织纤维化的影响
通过Masson染色、超声剪切波弹性成像和免疫组化确定T2DM小鼠肝脏纤维化损伤水平。如图4A所示,与对照组相比,T2DM小鼠肝组织出现显著的纤维化病变,显示为增加的蓝色胶原纤维数量,而槲皮素处理组纤维化情况明显减轻。与此一致,超声剪切波弹性成像(图4B)结果显示,T2DM小鼠肝脏硬度相对于对照组显著上升(P<0.01),槲皮素有效逆转了肝脏硬度的异常增加(P<0.05)。免疫组化结果显示,T2DM小鼠肝脏的结缔组织生长因子(CTGF)、α平滑肌肌动蛋白(α-SMA)以及Ⅰ型胶原(collagen Ⅰ)的阳性表达显著增加,而槲皮素干预减少了纤维化因子CTGF、α-SMA和collagen Ⅰ阳性表达(图4C~4E)。以上结果表明槲皮素对T2DM小鼠肝脏纤维化损伤有较好的抑制作用。
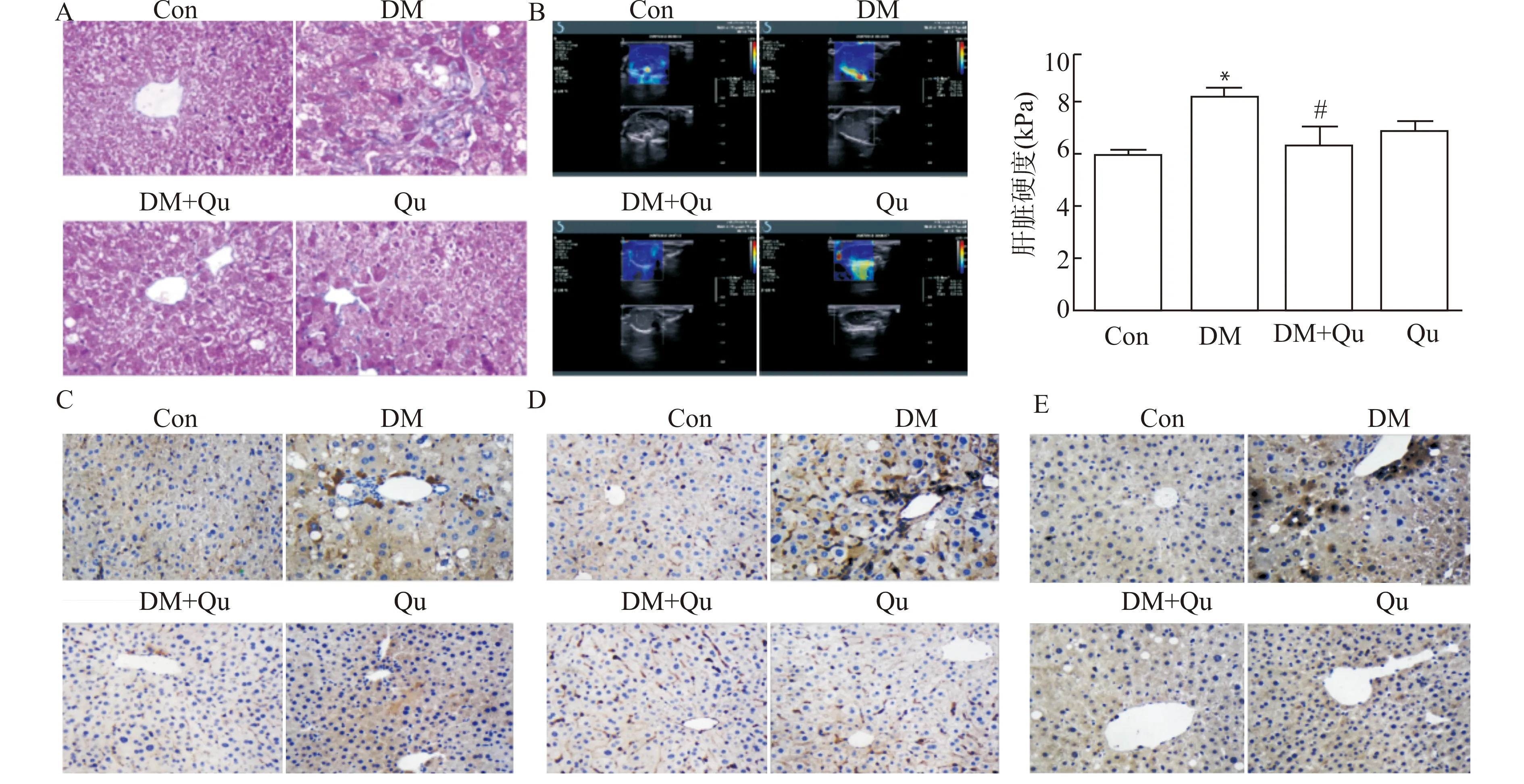
A:各组肝脏组织代表性Masson染色图片(×400);B:各组肝脏组织代表性超声剪切波弹性成像图片及硬度值统计(n=3);C~E:免疫组织化学法检测纤维化因子CTGF(C)、α-SMA(D)和collagen Ⅰ(E)的代表性图片(×400);Con:正常对照组;DM:糖尿病组;Qu,槲皮素对照组;DM+Qu:糖尿病+槲皮素组;与正常对照组比较,*P<0.05;与糖尿病组比较,#P<0.05 图4 槲皮素对糖尿病小鼠肝脏纤维化的影响Fig.4 Effect of quercetin on liver fibrosis in diabetic mice
3 讨论
本研究通过HFD诱导胰岛素抵抗,并连续注射STZ致使β细胞死亡,建立T2DM模型。此模型高度模拟了疾病事件从胰岛素抵抗到β细胞功能障碍的自然史,能够有效重现人类T2DM主要临床和分子表型[12]。在此模型下用槲皮素进行干预,结果显示,槲皮素有效改善T2DM小鼠肝脏受损和纤维化病变,其机制可能归因于其抗炎功效。我们的研究为T2DM合并MAFLD的膳食预防疗法提供了新的思路。
炎症是T2DM合并MAFLD病症进展的重要拐点。T2DM患者糖脂代谢紊乱导致的脂毒性物质过度累积以及氧化应激均诱发炎症,引发炎症关键转录调节因子NF-κB异常激活,进而促进细胞因子TNF-α和IL-6等表达增加[13]。在铜锌超氧化物歧化酶缺乏的氧化应激模型中,Mohammed等[14]发现肝脏巨噬细胞标志物F4/80以及炎性因子IL-1β表达增加,伴随肝纤维化进展。而在高度激活NLRP3炎性小体的小鼠模型中,其下游IL-1β表达增加将加剧肝纤维化[15],在蛋氨酸-胆碱缺乏饮食(MCD)喂养的db/db糖尿病小鼠中,通过给药或敲除炎症相关基因的方式抑制炎症,则有效减缓了肝纤维化进展[16]。因此,炎症可能是促进T2DM肝脏损伤向不可逆转的纤维化进展的关键机制,抑制炎症过度激活,将有助于减缓T2DM合并MAFLD向肝纤维化等终末期肝脏疾病进展。本研究中,我们观察到T2DM小鼠肝脏炎症因子IL-1β、IL-6及TNF-α表达的异常激活,伴随肝脏胶原沉积,纤维化因子CTGF、α-SMA以及collagenⅠ表达增加,肝脏硬度增加。我们的结果为揭示T2DM模型下肝损伤的干预靶点提供了科学依据。
长期以来,槲皮素由于其良好的抗炎作用备受关注。在酒精肝模型中,通过靶向HO-1,槲皮素抑制ROS/NF-κB/NLRP3炎性小体信号通路过度激活,减轻肝损伤[17]。我们的研究结果与之一致,在T2DM模型中,我们观察到了槲皮素对肝脏炎症的良好拮抗效应,其可能与NF-κB的转录抑制有关,未来的研究将深入探讨其作用机制,以期为防治高糖诱导的肝细胞损伤提供新的方向。
