接种4种外生菌根真菌对槲树幼苗生长、光合及营养元素含量的影响
2021-11-02孙佳琦曹文琪冷平生胡增辉
孙佳琦,曹文琪,冷平生,胡增辉,c
(北京农学院 a.北京林木分子设计育种高精尖创新中心;b.园林学院;c.城乡生态环境北京实验室,北京 102206)
外生菌根为土壤的担子菌(少数为子囊菌和低等菌)等外生菌根真菌侵染植物营养根,与根系形成的一种互利互惠的共生体[1-3]。据统计,超过20 000 种的担子菌和子囊菌能够与近7 000 种植物共生形成外生菌根[4]。外生菌根在促进宿主植物生长,提升养分吸收与利用效率,提高抗逆能力,改善土壤环境微生物群落结构方面表现出不同的效应[5-7]。因此,明确外生菌根对植物的影响,对于理解植物环境适应能力及抗逆机制具有重要意义。
研究表明,壳斗科栎属Quercus树种是典型能形成外生菌根的树种,对外生菌根具有较强的依赖性[8-9]。铆钉菇Gomphidius viscidus、臭红菇Russla foetens、褐环乳牛肝菌Suillus leteus、厚环乳牛肝菌S.grevillei、美味牛肝菌Boletus edulis及彩色豆马勃Pisolithus tinctorius均能与辽东栎Q.liaotungensis形成良好的外生菌根[10],且接种苗的株高、生物量和光合速率均显著优于未接种苗[11]。接种美味牛肝菌、红绒盖牛肝菌Xerocomus chrysenteron和绵毛丝膜菌Cortinarius sublanatus后,栓皮栎Q.variabilis幼苗的株高、地径和生物量明显增加[12],叶绿素含量和光合速率显著提高,蒸腾速率明显下降,水分利用效率有了较大提升[13-14],对养分的吸收能力也显著增强[15]。接种印度块菌Tuber indicum的麻栎Q.acutissima菌根化幼苗具有较强的水分吸收和保水能力,表现出较强的抗旱性,并且其土壤的含水量及硝酸还原酶活性相较于对照也有明显增加[16]。接种了黑松露T.melanosporum的冬青栎Q.ilex细根表面积明显增加,并具有高的导水率,净同化率和气孔导度也明显提升[17]。由红蜡蘑Laccaria laccata、褐绒盖牛肝菌B.badius和彩色豆马勃侵染形成外生菌根的夏栎Q.robur,在树高、胸径、叶数、干质量等方面有显著增加[18]。彩色豆马勃形成的外生菌根同样也显著促进了蒙古栎Q.mongolica苗木的生长,并通过提升抗氧化酶活性增强苗木耐旱能力[19]。槲树Q.dentata广泛分布于我国北方山区,是北方暖温带和温带森林的重要组成树种[20],不仅抗逆性强,并且树形优美,秋季叶片变红,是优良的园林绿化观赏树种,但目前对于外生菌根在其生长和环境适应中的作用还不清楚。
本研究以槲树1年生实生苗为材料,选择4种成功与栎属植物形成菌根的外生菌根真菌,铆钉菇、美味牛肝菌、褐环乳牛肝菌和厚环乳牛肝菌进行接种,通过测定苗高、地径、生物量、叶绿素含量、光合速率、水分利用效率及营养元素含量等指标,分析接种不同菌根真菌对槲树幼苗生长、光合和营养吸收的影响,为揭示外生菌根在其生长发育中的作用,进而促进槲树的推广应用提供依据。
1 材料与方法
1.1 试验材料
试验用苗为槲树1年实生苗。槲树种子采集于北京市平谷区玻璃台林场。将种子置于0.5%的KMnO4溶液中浸泡消毒30 min 后,埋于灭菌的河沙中进行沙藏层积催芽,白天温度控制在30℃,夜间20℃,待根发出1 cm 左右,进行播种。种植基质由草炭、蛭石、珍珠岩按4∶2∶1 的体积比混合制成,在高压灭菌锅中120℃灭菌20 min,装入15 cm×20 cm 的盆中,用于播种。待播种7 d 后接种外生菌根真菌。
1.2 外生菌根菌种及培养
4 种用于接种的外生菌根真菌(表1)购于中国农业科学研究院菌种保护中心。用PDA 培养基对真菌进行平板培养后,将菌斑分别挑入装有500 mL 的PDA 液体培养基的三角瓶中,置于恒温摇床上28℃下震荡培养7 d,制成接种菌液。菌液经高温灭菌后作为接种对照液。

表1 供试菌种Table 1 The fungi strain used
1.3 外生菌根真菌接种
在距苗5 cm 的基质处以“品”字形打3 个5 cm深的孔,将10 mL 菌液灌入孔中,覆土。接种后置于温室中自然培养,进行指标测定。
1.4 指标测定
所有的测定指标均在接种5 个月,槲树幼苗生长稳定后测定,在每个处理中选取5 株代表平均生长水平的植株作为重复。
生长指标测定:使用米尺测量株高,使用游标卡尺测量地径。
生物量测定:采集整个植株,分为根、茎、叶3 部分,置于烘箱中105℃杀青10 min,再于80℃烘干至恒质量后,称量干质量,计算总生物量和根冠比。
叶绿素含量测定:参考曹磊等[21]的方法,采用比色法测定提取液总叶绿素浓度,根据以下公式计算叶片叶绿素含量。
Ca=13.95×A665-6.88×A649;
Cb=12.7×A649-2.69×A665;
Ct=(1 000×A470-2.05×Ca-114.8×Cb)/245;
叶绿素含量(mg/g)=(Ct×提取液体积)/样品鲜质量。
式中:Ca,叶绿素a 浓度;Cb,叶绿素b 浓度;Ct,叶绿素总浓度;A665,提取液在665 nm 下的吸光值;A649,提取液在649 nm 下的吸光值;A470,提取液在470 nm 下的吸光值。
光合参数测定:使用Li-6400XT 便携式光合仪测定净光合速率、蒸腾速率,并计算水分利用效率(水分利用效率=光合速率/蒸腾速率)。每株选择成熟的3 片功能叶(从顶端开始的第4~6枚叶片)进行测定,以3 片叶片的平均值作为每株的测定值。
营养元素含量测定:采用凯氏定氮法测定N 含量。精确称取根、茎、叶粉末各0.1 g,倒入消煮管中,用硫酸和混合催化剂催化消煮。消煮完成后通过半微量凯式定氮仪进行滴定,计算N 含量。P、K、Ca、Mg 和S 含量测定参考李广鲁等[22]的方法,精确称取根、茎、叶粉末各0.1 g 倒入50 mL带盖离心管中,加入10 mL 1 mol/L 的HNO3,沸水浴加热30 min,冷却后过滤至50 mL 容量瓶中定容,于8 000 g 下离心10 min,吸取15 mL 上层液体,利用电感耦合等离子体发射光谱仪测定各元素含量。
2 结果与分析
2.1 接种外生菌根真菌对槲树幼苗株高和地径的影响
接种外生菌根真菌促进了槲树幼苗的高生长(图1A)。除接种S.g 与对照相比无显著差异外,接种其余3 种外生菌根真菌幼苗的株高均显著高于对照(P<0.05)。特别是接种B.e 的幼苗,其株高较对照提高了74.87%(图1A)。接种G.v 和S.l 的幼苗地径与对照没有明显差异,而接种B.e和S.g 的幼苗则显著增加(P<0.05),分别提高了15.51%和22.44%(图1B)。

图1 接种不同外生菌根真菌对槲树幼苗株高(A)、地径(B)的影响Fig.1 Effect of different ectomycorrhizal fungi on the plant height (A) and ground diameter (B) of Q.dentata seedlings
2.2 接种外生菌根真菌对槲树幼苗生物量和根冠比的影响
接种菌根真菌后,槲树幼苗的生物量表现出不同的变化趋势(图2A)。接种G.v、B.e 和S.l均显著提高了槲树幼苗的生物量,比对照分别增加了35.14%、21.92%和25.18%(图2A,P<0.05)。而接种S.g 没有提高生物量,反而出现了一定的降低。接种后的幼苗根冠比也表现出不同的结果(图2B)。接种S.g 的幼苗根冠比最大,较对照高16.97%,接种G.v、B.e 和S.l 幼苗的根冠比出现了降低,特别是接种G.v 的幼苗较对照显著降低了31.05%(图2B,P<0.05)。

图2 接种不同外生菌根真菌对槲树幼苗生物量(A)和根冠比(B)的影响Fig.2 Effect of different ectomycorrhizal fungi on the biomass (A) and root/shoot ratio (B) of Q.dentata seedlings
2.3 接种外生菌根真菌对槲树幼苗叶绿素含量和叶绿素a/b 的影响
接种外生菌根真菌显著提高了槲树幼苗叶片总叶绿素含量(图3A,P<0.05)。接种G.v、B.e、S.l和S.g 的槲树幼苗叶片总叶绿素含量较对照分别提高10.27%、14.73%、11.16% 和18.30%。而幼苗叶片叶绿素a/b 的值则表现出降低的趋势,特别是B.e 侵染的幼苗较对照明显低16.20%(图3B,P<0.05)。

图3 接种不同外生菌根真菌对槲树幼苗叶片的叶绿素含量(A)、叶绿素a/b(B)的影响Fig.3 Effect of different ectomycorrhizal fungi on the chlorophyll content (A) and chlorophyll a/b ratio (B) in the leaves of Q.dentata seedlings
2.4 接种外生菌根真菌对槲树幼苗光合、蒸腾和水分利用效率的影响
接种外生菌根真菌的槲树幼苗净光合速率较对照均出现升高,其中接种B.e 的幼苗升高最为明显,较对照高45.32%,而接种S.g 的幼苗虽然也升高,但与对照相比差异不显著(图4A,P<0.05)。接种G.v、B.e 和S.l 幼苗的蒸腾速率出现明显降低(图4B,P<0.05)。与对照相比,接种B.e导致槲树幼苗蒸腾速率降低了24.66%,而接种S.g则没有引起明显变化。对于水分利用效率,接种G.v、B.e 和S.l 槲树幼苗较对照显著提升,分别提高了43.50%、92.96%和43.84%(图4C,P<0.05)。而接种B.e 则没有引起水分利用率发生明显变化(图4C)。
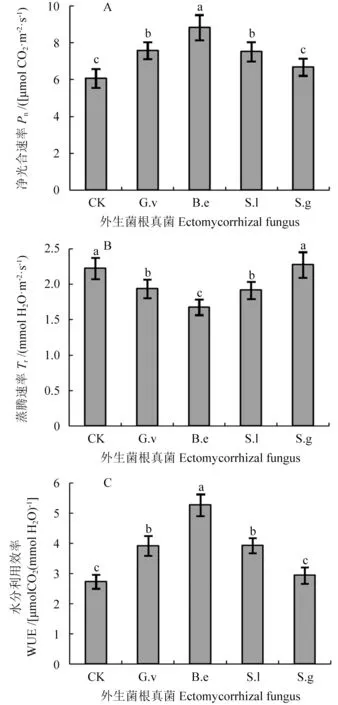
图4 接种不同外生菌根真菌对槲幼苗叶片光合速率(A)、蒸腾速率(B)和水分利用率(C)的影响Fig.4 Effect of different ectomycorrhizal fungi on Pn (A),Tr (B),and WUE (C) in the leaves of Q.dentata seedlings
2.5 接种外生菌根真菌对槲树幼苗营养元素含量的影响
接种外生菌根真菌还影响了槲树幼苗营养元素的含量(图5)。接种菌根真菌幼苗根茎叶中N 元素含量均高于对照,特别是叶中含量升高最为显著(图5A,P<0.05)。升高最多的是接种B.e 的幼苗,其叶片N 含量较对照高41.39%。接种也导致了槲树幼苗根茎叶中P 含量的升高(图5B)。与对照相比,接种B.e 的槲树幼苗根部P 含量显著升高(图5B,P<0.05),增加了34.58%。接种B.e 引起叶中P 含量升高幅度最大,较对照升高了73.20%(图5B,P<0.05)。而接种后的茎中P 含量未出现明显变化。对于K 含量,在接种B.e 的幼苗根中显著升高,较对照高31.09%(图5C,P<0.05)。接 种B.e 和S.l 幼苗茎中K 含量分别升高了27.18%和29.15%(图5C)。接种S.g 幼苗根和茎中K 含量均表现出明显增加,而接种S.l 则引起叶片中K 含量的显著增加(图5C,P<0.05)。接种后,幼苗茎和叶中的Ca 含量均有明显提升,而根中Ca 含量仅在接种S.g 的幼苗中出现显著增加(图5D,P<0.05)。且茎中Ca 含量在接种S.g 后的增加也最为显著,较对照提高了23.43%(图5D,P<0.05)。在叶中,接种G.v 的幼苗Ca 含量提高最显著,较对照高25.57%(图5D,P<0.05)。对于Mg 含量,除接种S.l 幼苗茎中较对照降低外,在根和叶片中,及其他3 种菌根真菌接种的幼苗中均有提高(图5E)。接种B.e 幼苗叶片中Mg 含量较对照提高程度最大,达到对照的1.58 倍。接种对槲树幼苗S元素含量也有一定的影响(图5F),虽然没有显著影响叶片中S 含量,但提高了槲树幼苗根和茎中S 含量。

图5 接种不同外生菌根真菌对槲树幼苗N 含量(A)、P 含量(B)、K 含量(C)、Ca 含量(D)、Mg 含量(E)、S(F)含量的影响Fig.5 Effect of different ectomycorrhizal fungi on the contents of N (A),P (B),K (C),Ca (D),Mg (E),and S (F) of Q.dentata seedlings
3 结论与讨论
研究表明,外生菌根真菌能显著提高寄主植物的适应性,对植物的生长发育起到明显的正调控作用[23]。槲树是北京山区重要的乡土树种,抗逆性强,是具有开发潜力的多功能生态景观树种,虽然已发现其普遍形成外生菌根,但目前对外生菌根在槲树生长发育中的作用还不清楚。本研究通过测定接种不同的外生菌根真菌的生理指标,分析和比较了其对槲树生长、光合及营养吸收的影响。
接种合适的外生菌根能促进苗木的生长[15]。在本研究中,接种4 种外生菌根真菌总体上均在一定程度上提高了槲树幼苗的株高、地径及生物量。菌根可通过分布广泛的伸长菌丝来增强植物对水分和养分的获取范围和吸收面积,并且可以优化改良植物土壤环境,促进植物的生长[24]。邹慧等[25]研究发现,接种6 种不同外生菌根真菌均提高了西南桦Betula alnoides的生物量,但每种菌根真菌促进增长量并不相同。接种紫晶蜡蘑L.amethystea对黑松Pinus thunbergii生长量和耐盐性提高程度要高于空团菌Cenococcum geophilum[26]。对接种不同外生菌根真菌的辽东栎[10]和栓皮栎[15]同样表现出不同的促进效果。菌根真菌具有广谱性寄、宿生和专性寄生,不同外生菌根真菌与宿主植物特异结合,对寄主生长发育影响程度也不相同,从而导致了差异[9,27]。此外,接种后的幼苗根冠比也发生了变化。S.g 侵染后地径的明显增粗和根冠比的显著升高,表明其影响了生物量分配,将更多的光合产物分配到地下部分,从而表现出耐旱的形态特征[28],但没有引起株高和生物量的明显升高,对生长的促进作用不明显。而接种G.v虽然显著提高生物量,但根冠比大幅度降低,说明其将更多的光合产物分配到地上部分,这可能会影响其耐旱性及稳固性。接种B.e 和S.l 后的槲树幼苗根冠比虽然也出现了一定的降低,但基本保持对照水平,光合产物分配比例变化不大,但从生物量来看,促生效果明显。
外生菌根真菌也能显著促进寄主植物的光合作用[14]。在本研究中,接种外生菌根真菌的槲树幼苗叶绿素含量均高于对照。植物吸收光能主要是由叶绿素完成的,槲树幼苗叶绿素含量的提高对光合作用也起到促进作用。叶绿素a/b 值反映植物的耐阴性,比值越小,植物的耐阴性越强[29]。由此可见,接种外生菌根真菌后,槲树幼苗叶绿素a/b 值的降低表明其耐阴性的增强。接种G.v、B.e 和S.l 后,槲树幼苗的净光合速率和水分利用效率分别有不同程度的升高,而蒸腾速率有所降低,表明接种菌根真菌有助于提高槲树的光合利用能力。在杨树Populus×euramericanacv.Nanlin 895[30]、白皮松P.bungeana[31]和板栗Castanea mollissima[32]等,同样发现外生菌根真菌提高对光能的利用率,显著促进了光合作用,但促进作用因菌种不同而存在差异[33]。
菌根真菌能够促进植物对N、P、K 等营养元素,以及一些微量元素的吸收[34-36],从而促进了宿主植物的生长[37]。在本研究中,接种外生菌根后,槲树幼苗的各营养元素含量高于对照。接种美味牛肝菌和马勃菌Scleroderma citrinum能有效提高板栗对P、K、Mg 等营养元素的吸收能力[38]。于萌[39]在油松P.tabuliformis中也发现,接种外生菌根真菌促进了油松对营养元素的吸收。菌根形成的密集菌丝网扩大了根部吸收营养的能力,这样的菌丝网对磷元素的吸收尤其显著[40]。此外,寄主植物将自身的光合产物提供给菌根真菌,菌根真菌协助和促进了宿主植物对土壤中活性低、含量低的营养元素的吸收[35,41]。菌根真菌还可以分泌磷酸酶和硝酸还原酶将土壤中不可吸收的元素转化为可吸收利用的元素从而增加养分的获取[27]。接种菌根真菌后,槲树幼苗N、P、K、Ca含量增加,促进了槲树的生长,Mg 的增加能促进叶绿素的合成,进而提升光合能力,而S 元素的积累则能增加相关蛋白及次生代谢物的合成,有利于植物抗逆性和环境适应能力的提升。
总之,接种4 种菌根真菌总体上提升了对营养元素的吸收,提高了叶绿素含量,增强了光合速率,提高了水分利用效率,最终能促进了槲树幼苗的生长。经过综合比较,在接种的4 种菌根真菌中,B.e 对槲树生理和生长的提升效果最明显。本研究仅从生理角度对槲树接种菌根真菌的后生长效果进行了分析,在抗逆方面的效果是下一步要做的工作,并且还需从生化及分子层面对其中的机制进行研究。
