静脉注射旱莲苷A的药动学研究
2021-11-01石碧茹高建赵晶刘二伟高秀梅韩立峰天津中医药大学组分中药国家重点实验室天津市中药化学与分析重点实验室天津301617
石碧茹,高建,赵晶,刘二伟,高秀梅,韩立峰(天津中医药大学组分中药国家重点实验室,天津市中药化学与分析重点实验室,天津 301617)
墨旱莲始载于唐代 《新修本草》,为菊科一年生草本植物醴肠Eclipta prostrateL.的干燥地上部分,是中医常用补阴中药。性寒,味甘、酸,入肝、肾经,入阴血、善敛固,具有滋补肝肾、乌须固齿、凉血止血等功效[1]。墨旱莲主要的化学成分有三萜类、内酯类、香豆草醚类、黄酮类、噻酚类、甾体类、挥发油以及有机酸等[2-5]。关于墨旱莲的含量测定报道大多集中在香豆草醚和黄酮类上,如蟛蜞菊内酯、异去甲基蟛蜞菊内酯、木犀草素-7-O-葡萄糖苷、醴肠醛、木犀草素、芹菜素齐墩果酸[6-10]。本课题组对墨旱莲化学成分的研究发现其皂苷类成分含量较高,采用超高效液相色谱配合亚2 μm小颗粒粒径填料色谱柱,对墨旱莲药材提取物进行了快速分离,再配合高效液相色谱-串联三重四极杆质谱平台(HPLC-QQQMS),建立了指纹图谱定性方法[11],结果显示墨旱莲A为墨旱莲药材中含量较高的化学成分。
文献报道,旱莲苷A具有抑菌、抗肺纤维化、抑制骨关节炎等多方面药理活性[12-14],最近有文献报道旱莲苷A还能抑制非小细胞肺癌[15-16]。研究中药提取纯化的单体活性成分的药动学行为对新药开发具有重要意义。本课题组前期对旱莲苷A口服药动学及组织分布进行了系统研究[17],由于皂苷类成分大多具有口服吸收不好,生物利用度低的特点,本研究进一步利用HPLC-QQQ-MS技术,测定大鼠尾静脉注射给药旱莲苷A后药动学参数,为旱莲苷A的生物利用及后续新药开发提供参考。
1 材料
1.1 实验动物
SD 雄性大鼠6 只,体质量在(200±20)g [SPF级,天津市山川红实验动物科技有限公司]。所有大鼠在统一环境下适应性饲养1周,每日12 h明暗交替,温度22℃,期间自由饮食和饮水。
1.2 仪器
Agilent 1260高效液相色谱仪、Agilent 6430三重四极杆质谱仪(Agilent公司);Mill-QⅡ型超纯水器(Millipore公司);3K15高速离心机(Sigma公司);N-EAVP 111氮吹仪(美国Organomation公司);AX205十万分之一天平(Mettler Toledo公司);XW-80A涡旋混合器(沪西分析仪器厂);KQ-250E型超声波清洗器(昆山市超声仪器有限公司);-80℃超低温冰箱(美国Thermo Heto公司)。
1.3 试药
乙腈、甲醇(色谱纯,德国默克公司);色谱纯试剂乙酸(美国TEDIA试剂公司);超纯水由Mill-QⅡ 型超纯水净化系统制得;生理盐水(辰欣药业股份有限公司)。旱莲苷A对照品(实验室自制得到,经过HPLC-ELSD检测,其纯度>98%[17]);人参皂苷Rg1(内标,纯度>98%,成都曼思特生物科技有限公司)。
2 方法与结果
2.1 色谱条件和质谱条件
色谱柱为Agilent Eclipse Plus C18(2.1 mm×150 mm,5 μm);流动相为乙腈(A)-0.05%乙酸水(B),梯度洗脱(0~1 min,10%~60%A;1~5 min,60%~90%A;5~9 min,90%A;9~10 min,90%~10%A,10~16 min,10%A);流速0.4 mL·min-1,柱温25℃;进样量5 μL。
离子源为电喷雾离子源(ESI源),采用多反应监测(MRM)模式,负离子监测;毛细管电压为4.0 kV,以N2作为干燥气,干燥气温度为350℃,流速设定10 mL·min-1。旱莲苷A和人参皂苷Rg1优化后的离子对,碰撞能量,碎裂电压见表1。
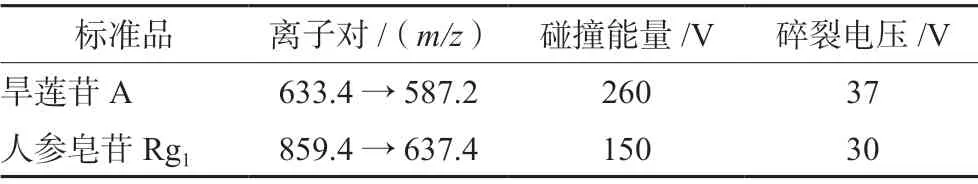
表1 优化后质谱参数及用于定量分析的离子通道Tab 1 Optimized mass parameters and MRM transitions
2.2 对照品储备液和内标溶液配制
精密称取旱莲苷A 10.00 mg和人参皂苷Rg11.00 mg,分别置于10 mL量瓶中,用体积分数为50%的甲醇溶解并稀释至刻度,摇匀,分别配制为1 mg·mL-1和100 μg·mL-1的对照品储备液,然后将旱莲苷A对照品储备液稀释得到一系列不同质量浓度的工作液(20.0、50.0、100.0、500.0、1000.0、2000.0 ng·mL-1)。人参皂苷Rg1用50%的甲醇稀释得到质量浓度为250 ng·mL-1内标溶液。对照品溶液储存在4℃冰箱备用。
2.3 血浆样品处理
取冷冻的大鼠血浆样品,于室温融化后涡旋、混匀。精密吸取血浆样品100 μL,置于1.5 mL离心管中,依次精密加入10 μL内标溶液(250 ng·mL-1人参皂苷Rg1)、10 μL空白甲醇溶液,涡旋1 min混匀,再加入380 μL甲醇沉淀蛋白,涡旋振荡10 min 后静置,14 000 r·min-1离心10 min,取上清液进样测定。
2.4 方法学考察[18-19]
2.4.1 专属性试验 取空白血浆100 μL,不加内标,其他按照“2.3”项下方法处理,进样分析;将对照品溶液(500 ng·mL-1)及内标溶液(250 ng·mL-1)加入空白血浆中,同法处理;取大鼠尾静脉给药后的血浆样品,同法处理;结果显示目标化合物及内标峰形良好,血样中无内源性物质干扰(见图1)。
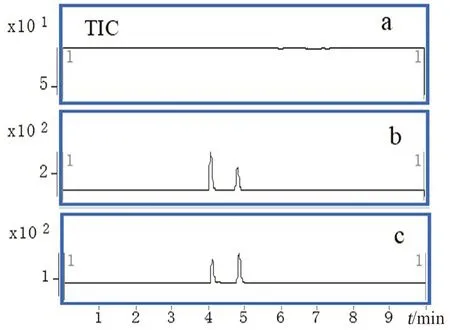
图1 空白血浆(A)、空白血浆加对照品(B)、大鼠给药后的血浆样品(C)总离子流(TIC)图Fig 1 TIC chromatogram of blank plasma(A),blank plasma spiked with ecliptasaponin A and the IS(B),and plasma sample after administration(C)
2.4.2 线性关系的考察 取空白血浆100 μL,加入内标溶液10 μL和系列浓度对照品溶液各10 μL,除不加10 μL空白甲醇溶液外,其他按照“2.3”项下方法操作,最终标准曲线各点质量溶液浓度为2.0、5.0、10.0、50.0、100.0、200.0 ng·mL-1,取上清液5 μL进样测定。以血浆样品中待测物与内标的峰面积比值(Y)为纵坐标,以待测物质量浓度(X)为横坐标,用加权最小二乘法进行回归计算,权重系数为1/χ,得回归方程为Y=0.2113X+0.0060,r为0.9985。
2.4.3 精密度与准确度考察 取大鼠空白血浆100 μL,加入旱莲苷A对照品配制成质量浓度为5.0、50.0、200.0 ng·mL-1的血浆样品各6 份,按“2.3”项下方法操作,连续测定3 d,计算待测化合物峰面积和内标峰面积比值,代入随行标准曲线中计算浓度。测定3批血浆样品,分别计算日内、日间精密度和准确度,结果旱莲苷A日内及日间精密度RSD值均小于5.6%,准确度在86.63%~106.59%,表明该方法的精密度与准确度良好。
2.4.4 提取回收率与基质效应 取空白血浆100 μL,分别加入质量浓度为200、2000、8000 ng·mL-1的墨旱莲苷A对照品溶液各10 μL,按“2.3”项下方法操作,进样测定;配制旱莲苷A的质量浓度为5.0、50.0、200.0 ng·mL-1的血浆样品各3 份,进样测定;另取空白血浆,按“2.3”项下方法操作,得含空白基质的残渣,分别加入100 μL 80%甲醇配制低、中、高的旱莲苷A对照品溶液复溶,进样测定,记录两次旱莲苷A的峰面积,计算提取回收率;同样条件下,进样相应低、中、高浓度对照品溶液;将对照品溶液与纯对照品得出的峰面积相比,计算得到基质效应。旱莲苷A各浓度提取回收率在71.30%~81.30%(RSD<7.3%),基质效应在70.29%~88.61%(RSD<12.0%),均符合生物样品检测的要求。
2.4.5 血浆质控样品稳定性考察 取空白血浆100 μL,配制成旱莲苷A质量浓度为5.0、50.0、200.0 ng·mL-1的对照品血浆样品,将血浆样品室温放置24 h,反复冻融3 次和-80℃冻融7 d后处理并测定,将样品实测值与初始值比较,结果准确度在91.37%~119.82%,RSD在4.5%~13.3%,表明样品在储存和处理过程中相对稳定。
2.5 药动学实验
SD雄性大鼠6 只,体质量在(200±20)g,给药前禁食12 h,自由饮水,尾静脉注射旱莲苷A生理盐水混悬液(1 mg·kg-1),分别于给药前及给药后0、0.08、0.17、0.33、0.67、1、1.5、2、4、6、12、24 h经大鼠眼底静脉丛取血约0.3 mL,置于1.5 mL肝素化离心管中,6000 r·min-1离心10 min,分离血浆,置于-80℃冰箱中储存,直至进样分析。根据不同时间点血药浓度具体结果,采用DAS 1.0软件计算大鼠尾静脉注射给药后旱莲苷A后的药动学参数见表2;平均血药浓度-时间曲线见图2。

表2 大鼠尾静脉注射旱莲苷A后主要药动学参数(n=6)Tab 2 Main pharmacokinetic parameters of ecliptasaponin A in rat after intravenous injection (n=6)
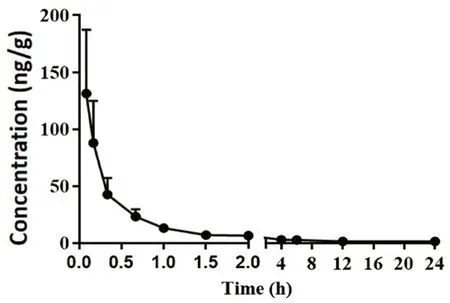
图2 大鼠尾静脉注射旱莲苷A后的平均血药浓度-时间曲线图(n=6)Fig 2 Mean plasma concentration-time curve of ecliptasaponin A in rats after intravenous administration(n=6)
由结果可知,大鼠尾静脉给药旱莲苷A后符合二室开放药动学模型,旱莲苷A的血药浓度在第一个取血时间点达峰,并在体内迅速分布,血药浓度在1 h之内迅速下降,说明化合物在体内的消除速度很快,半衰期较短。
3 讨论
生物样品基质组成复杂,而一般目标化合物含量比较低,样品在测定前需要选用恰当的前处理方法,使目标化合物纯化和富集,一方面可以除去介质中蛋白质、脂肪和尿素等较大分子物质的干扰,另一方面也可以将与蛋白质或其他内源性物质结合的药物解离下来进行测定。本实验对蛋白沉淀法和液液萃取法进行了考察,结果蛋白沉淀法比液液萃取法更方便、简单、快速,故采用蛋白沉淀法对旱莲苷A在大鼠血浆进行前处理。蛋白沉淀法分别采用1∶3、1∶4的甲醇、乙腈,结果显示,1∶4的甲醇沉淀蛋白回收率较好。
采用LC-MS进行血样定量分析时,为了减少样品处理中的操作误差、药物浓度低、内源性杂质干扰、质谱检测时因离子化效率不同产生的差异等问题,在实验中常加入内标来校正。实验中选择了与旱莲苷A结构相似、色谱行为相近、检测组分中没有的且与所含成分不发生相互作用的人参皂苷Rg1作为内标。梯度洗脱方式,分离度较好,质谱响应稳定,无内源性干扰[19]。
结合课题组前期报道过大鼠口服旱莲苷A后的相关药动学参数[17]及本实验尾静脉注射后得到的药动学参数,根据公式,绝对生物利用度F=(AUC PO/剂量PO)/(AUC IV/剂量IV),可计算出旱莲苷A的生物利用度约为1.68%。表明旱莲苷A的生物利用度较低,后续新药开发时应予以重点关注。
