枯草芽孢杆菌BS-1菌株对猕猴桃采后软腐病的抑制和保鲜效果评价
2021-11-01赵焕兰李欢欢刘永胜
刘 奎,赵焕兰,宗 宁,李欢欢,刘永胜,3,苗 敏
(1.合肥工业大学食品与生物工程学院,安徽 合肥 230009;2.北方民族大学,宁夏 银川 750021;3.安徽农业大学大学园艺学院,安徽 合肥 230061)
猕猴桃(Actinidiachinensis),属猕猴桃科(Actinidiaceae)猕猴桃属植物,是20世纪野生果树人工驯化栽培最成功的四大果树之一[1]。近些年来,我国猕猴桃产业迅速崛起,2017年,我国猕猴桃种植面积达250 000 hm2,超过世界其他所有猕猴桃生产国的种植面积总和[1]。但猕猴桃果实采后腐烂率高达35%左右[2],果实采后腐烂是果实自身的衰老或生理失调、病原微生物侵染和采后贮运过程中的机械损伤三者相互影响的结果,其中病原菌侵染引起的组织腐烂是果实采后腐烂最主要的原因[3]。猕猴桃果实软腐病是猕猴桃采后主要病害,由病原真菌感染引起。该病在陕西、四川和江西等猕猴桃主产区均普遍发生,其普遍发病率都可达到20%~50%[4],造成采前落果和贮藏期果实腐烂率升高,严重影响猕猴桃果实品质及市场销售,造成重大经济损失[5]。
软腐病病原学的调查研究发现多种病原真菌可以引起猕猴桃软腐病,Li等[6]在软腐病病果上分离鉴定到Diaporthespp.、Botryosphaeriadothidea、Alternaria alternata和Pestalotiopsismicrospora,所占比例分别是52.6%、23.7%、13.2%和10.5%。Zhou等[7]报道Botryosphaeriadothidea、Lasiodiplodiatheobromae、Neofusicoccumparvum为猕猴桃软腐病致病菌。Botrytiscinerea[8]、Penicilliumexpansum[9]也被报道为软腐病病原菌,但大多数研究认为拟茎点霉菌(Diaporthespp.)和葡萄座腔菌(Botryosphaeriadothidea)是我国猕猴桃软腐病的主要致病菌。
猕猴桃软腐病的防治以及对猕猴桃采后保鲜研究成为近些年研究热点。目前猕猴桃软腐病的防治研究以化学防治和生防菌株筛选为主[10]。长期施用化学农药容易使真菌产生抗药性,破坏生态环境安全及影响农产品质量安全;生防菌株对贮藏期果实防治效果较好且安全可靠,其中应用最多的生防菌是酵母菌和细菌。研究表明,生防细菌枯草芽孢杆菌(Bacillus subtilis)对荔枝采后病原菌霜疫霉[11]、柑橘炭疽病菌[12]、桃软腐病病原菌根霉菌、枇杷炭疽病病原菌炭疽菌[13]具有抑菌活性,且可以提高果实的采后贮藏品质。此外,胡欣洁等[14]研究发现B.subtilisCy-29菌悬液处理果实后能较好地保持红阳猕猴桃果实良好的品质,适当延缓果实的成熟衰老。但是有关B.subtilisstrain BS-1菌液及其无菌体发酵液(FJY)对猕猴桃软腐病主要病原菌抑制探究以及猕猴桃货架期保鲜研究较少。本文研究了B.subtilis菌株BS-1菌液及其无菌体FJY是否抑制病原菌Botryosphaeriadothidea和Diaporthenobilis的菌丝体外生长及果实致病能力,并进一步对无菌体FJY的抑菌稳定性进行了探究,最后将BS-1菌液及FJY应用于猕猴桃货架期保鲜,探究它们对货架期猕猴桃果实品质的影响,以期将枯草芽孢杆菌FJY开发为一种猕猴桃软腐病的生防制剂,为采后保鲜剂的研发提供理论基础。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
BacillussubtilisBS-1菌株由重庆文理学院刘嘉老师提供,Botryosphaeriadothidea(B.dothidea)和Diaporthenobilis(D.nobilis)菌株由合肥工业大学食品与生物学院基因工程实验室从寄主(猕猴桃)分离并保存。试验所用猕猴桃为市售徐香猕猴桃。
LB培养基配方:准确称取胰蛋白胨10 g、酵母提取物5 g、氯化钠10 g,用蒸馏水溶解并定容至1 L,然后于121℃下灭菌20 min。
PDA培养基配方:去皮土豆200 g、葡萄糖20 g、20 g琼脂,将去皮土豆切成1 cm3的小块,加1 L蒸馏水,煮沸15 min,用8层纱布过滤后加入琼脂,待其溶解后加入葡萄糖,搅拌均匀,冷却后用蒸馏补足水分至1 L,115℃灭菌30 min。
1.1.2 仪器与设备
ZHJH-C1118B超净工作台,CNT65数显糖度计,DIGC6游标卡尺,TA.XTPlus物性测试仪,SK-R1807-E标准型三维摇床,MJX-100B-Z霉菌培养箱,MLS-3750高压蒸汽灭菌锅,Heraeus Multifuge XIR大容量多功能冷冻离心机,PHS-25台式pH计。
1.2 方法
1.2.1 BS-1菌株体外抑制病原菌菌丝生长试验
参照代玉立[15]的平板对峙法稍做调整。将BS-1菌株从-80℃超低温冰箱取出,划线于LB固体平板,长出单克隆后,挑取单克隆于3 mL LB液体培养基中,28℃摇床,180 r/min培养过夜,第2天转接至新LB液体培养基中培养至菌细胞数达0.6×108CFU/mL,作为菌液,备用。利用打孔器打取直径5 mm、培养5 d后新鲜B.dothidea和D.nobilis病原菌菌饼接种于新PDA平板中央,以病原菌为中心,左上、右上、左下、右下,4角距离2 cm处固定4个点,下面两个点接种5μL备好的B.subtilis菌液,上面2个点接种5μL LB培养基作为对照。接种后的平板培养于25℃霉菌培养箱中,从第3天开始观察抑菌情况和记录抑菌圈大小(菌丝边缘到细菌菌落边缘的距离),并拍照。每组处理6个平板,试验重复3次。
1.2.2 BS-1发酵液的制备及其体外抑制病原菌菌丝生长试验
参照黎晓茜等[10]方法并加以修改。将细胞数达0.6×108CFU/mL的BS-1菌液按1%接种量接种于装有100 mL LB液体培养基的250 mL锥形瓶中,28℃摇床,180 r/min培养72 h,培养后的菌液于4℃,10 000 r/min离心15 min得上清液,将上清液用0.45μm滤膜真空抽滤后即得无菌体发酵液(FJY)。倒内含2%FJY的PDA平板,冷却凝固后,接种B.dothidea和D.nobilis病原菌于平板中间,置于25℃下培养,从第3天开始观察抑菌情况和记录菌落直径,并拍照。每组处理6个平板,试验重复3次。
1.2.3 BS-1及FJY果实体内损害病原菌致病力试验
参照王晓莉[13]的方法并加以调整。按照前述方法准备BS-1菌液和无菌体FJY。将购于市场的大小均一、无病害及损伤、较硬的徐香猕猴桃清洗后,用1%次氯酸钠表面消毒10 min后清水冲洗3次,晾干备用。使用终体积分数为5%的Bacillussubtilis菌液、无菌体FJY及LB培养基分别浸泡猕猴桃5 min,晾干,待接种病原菌。在处理好的猕猴桃赤道部位用锥子打约3 mm深的孔,在孔处接种直径5 mm的5 d菌龄病原菌菌饼,然后用封口膜缠好后,25℃培养箱放置7 d后观察患病情况,记录菌斑直径,计算患病面积并拍照。每组处理8个猕猴桃,试验重复3次。以Bacillussubtilis菌液处理的猕猴桃打孔后不接病原菌作为对照。
1.2.4 FJY的温度、紫外照射和pH耐受性测定
参考李晨楚[16]的方法,稍有调整。温度耐受试验:将FJY分别于37、60、100、121℃下处理1 h,冷却至室温后备用。紫外照射耐受试验:将FJY分别于功率为18 W的紫外灯管下,灯与水平面成45°放置,分别照射0、0.5、1、2 h后备用。pH耐受试验:将FJY(初始pH为8)用HCl或NaOH调节至pH分别为3、4、5、8、9、10,室温放置2 h后调回至pH为8后备用。按照2%的比例向PDA培养基中加入各处理的FJY,倒平板备用,以加入2%LB培养基为对照。接种B.dothidea和D.nobilis病原菌于平板中间,放入25℃培养箱,从第3天开始观察抑菌情况和记录抑菌率,并拍照。每组处理6个平板,试验重复3次。
1.2.5 BS-1及FJY货架期贮藏保鲜试验处理
按照前述方法准备好细胞数达0.6×108CFU/mL的BS-1菌液以及FJY。保鲜所用的猕猴桃为刚从果园采收运到市场的新鲜猕猴桃,剔除烂果,挑选大小均匀的果实,将其分为3组,每组20 kg,其中2组分别喷洒5%细胞数达0.6×108CFU/mL的B.subtilisBS-1菌液和FJY,另一组喷洒无菌水作为对照,每个果实确保喷洒均匀,晾干后,装入塑料袋,室温放置,定期观察腐烂情况并测定品质指标。
1.2.6 货架期指标测定
使用物性测试仪测定货架期期间果实的硬度、脆性、紧实度,单位分别为g、g·s、g·s。每次测量3个猕猴桃,每个果实赤道部位取3个测量点。可溶性固形物含量使用数显糖度仪测定,可滴定酸含量采用酸碱滴定法[10]测定,失重率采用称量法[10]测定,腐烂率(%)=腐烂果实个数/总果实个数×100。
1.2.7 数据处理
所有数据采用Microsoft Excel 2016软件计算标准偏差,并应用Origin 9.0软件作图,使用SPSS 21.0软件进行差异显著分析。
2 结果与分析
2.1 BS-1对B.dothidea和D.nobilis生长的影响
2.1.1 BS-1菌液对B.dothidea和D.nobilis体外菌丝生长的影响
由图1A的平板照片可以看出,接种后第3天,B.dothidea和D.nobilis两种病原菌平板靠近BS-1的一端菌出现明显的抑菌圈,大小分别为8.37 mm和17.14 mm,第7天抑菌圈大小趋于稳定,大小分别为3.61 mm和12.60 mm(图1B,1C)。而对照一直没有观察到抑菌圈,表明BS-1对两种病原菌的平板扩展即病原菌体外菌丝生长均有明显抑制作用。

图1 BS-1菌液对B.dothidea和D.nobilis体外菌丝生长的影响Fig.1 Effects of BS-1 on the growth of B.dothidea and D.nobilis in vitro
2.1.2 FJY对B.dothidea和D.nobilis体外菌丝生长的影响
由图2A可知,从接种后第3天开始,FJY处理后的两种病原菌的菌落直径均小于CK组,菌落扩展得到显著抑制。第4天时,FJY对B.dothidea的平板抑菌率最高,达79.45%(图2B);而对D.nobilis的平板抑菌率在第5天时最高,为57.73%(图2B,2C)。这些结果表明FJY对这猕猴桃两种主要病原菌的体外菌丝生长有显著抑制作用。

图2 FJY对B.dothidea和D.nobilis体外菌丝生长的影响Fig.2 Effects of FJY on the growth of B.dothidea and D.nobilis in vitro
2.1.3 BS-1和FJY对B.dothidea和D.nobilis果实致病能力的影响
由图3A可知,与LB培养基处理相比,BS-1菌株及FJY处理的病斑面积减小,两病原菌致病能力减弱。接种B.dothidea7 d时,LB处理组病斑面积达456.16 mm2,而BS-1菌株及FJY处理组分别仅为340.18、326.62 mm2(图3B)。接种D.nobilis7 d时LB处理组病斑面积达527.80 mm2,而BS-1菌株及FJY处理组分别仅为188.94、184.66 mm2(图3C),并且从图3A的CK组可以看出,单独接种BS-1菌株未引起果实致病。上述结果表明:BS-1及FJY可以显著抑制这两种病原菌的果实致病能力,减少软腐病的发生。
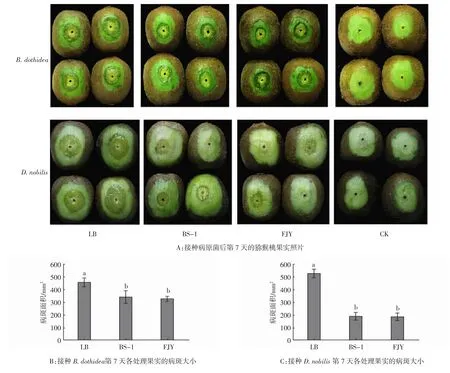
图3 BS-1及FJY对猕猴桃果实B.dothidea和D.nobilis致病能力的影响Fig.3 Effects of BS-1 and FJY on the pathogenicity of B.dothidea and D.nobilis in kiwifruit
2.2 FJY抑菌稳定性探究
2.2.1 温度对FJY抑菌稳定性的影响
由图4A可见,FJY经不同温度处理并培养7 d后,对两种病原菌的抑制趋势一致。在37~121℃范围内,虽然随着处理温度升高,FJY抑菌效果有所下降,但与对照相比,各处理组病原菌的菌落直径显著变小。即使经121℃高温处理,FJY仍有显著的抑菌效果。由图4B和图4C的数据统计分析可知,随着处理温度的升高,FJY抑菌率下降,但在接种第7天时,经121℃处理后,FJY对B.dothidea和D.nobilis仍有24.86%和29.70%的抑菌率。表明FJY的抑菌效果有一定的温度耐受性,在37~100℃之间有较好的抑菌效果,经121℃高温处理后仍具有一定的抑菌活性。

图4 温度对FJY抑菌稳定性的影响Fig.4 Effects of temperatures on the bacteriostatic stability of FJY
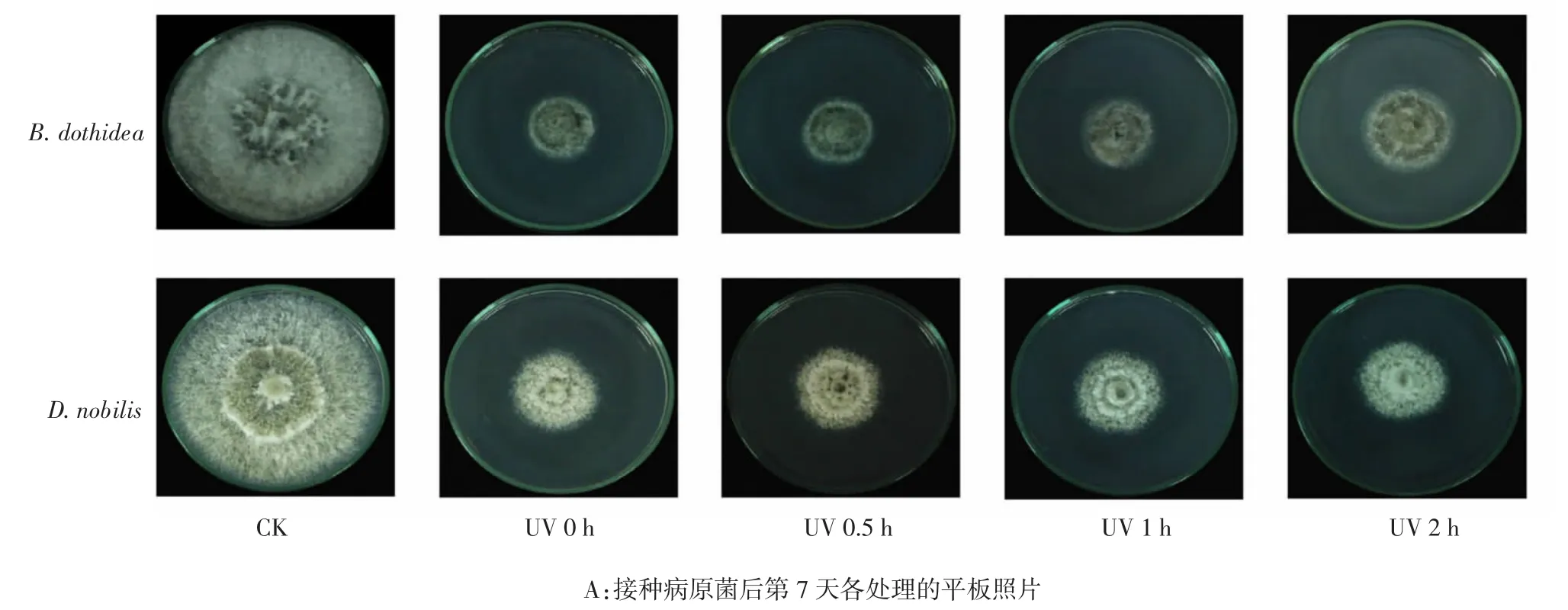
2.2.2 紫外照射对FJY抑菌稳定性的影响
由图5A可以看出,FJY经不同时间紫外照射并培养7 d,其对两种病原菌的抑制趋势基本一致。与对照组相比,在紫外照射时间0.5~2 h内,各处理组菌落直径减小,并且随着紫外照射时间的延长,FJY仍然保持较好的抑菌效果。由图5B和5C可以看出,处理3 d后,虽相比于未经紫外处理的FJY,各处理组对B.dothidea和D.nobilis抑菌率有所下降,但是幅度不大,且随着紫外照射时间的延长,抑菌率仍分别维持在71.33%~76.15%和44.54%~47.69%之间。表明在0.5~2 h紫外照射下,FJY具有一定的稳定性,对两种病原菌有较好的抑制效果。

图5 紫外照射对FJY抑菌稳定性的影响Fig.5 Effects of utraviolet rays on the bacteriostatic stability of FJY
2.2.3 pH对FJY抑菌稳定性的影响
由图6A可见,FJY经不同pH处理并培养7 d,对两种病原菌的抑制趋势一致。在酸性pH 3~5、碱性pH 8~10范围内,虽各pH处理之间有差异,但与对照组相比,各处理组病原菌的菌落直径下降,抑菌效果明显。由图6B和图6C可以看出,培养第3天时,各处理组抑菌率均高于未处理的FJY(pH=8),对B.dothidea和D.nobilis抑菌率范围分别为73.59%~79.27%、52.22%~56.48%。培养第7天时,使用pH 4和pH 10处理的FJY抑菌率最高。这些结果表明:FJY具有较好的酸碱耐受性,在pH 3~5(酸性)、pH 8~10(碱性)范围内均有显著的抑菌效果。
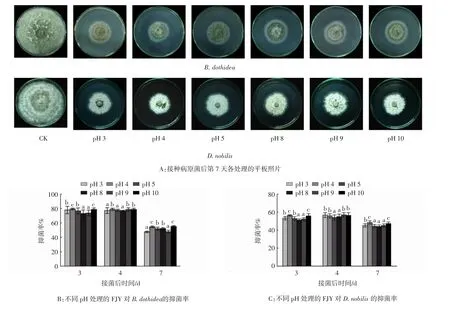
图6 pH对FJY抑菌稳定性的影响Fig.6 Effects of pH on the bacteriostatic stability of FJY
2.3 BS-1及FJY对猕猴桃货架期品质的影响
2.3.1 BS-1及FJY对猕猴桃硬度、脆性和紧实度的影响
在前文探究BS-1菌株及其FJY的抑菌效果和FJY的抑菌效果之后,进一步探究它们在猕猴桃采后保鲜上的应用。果实的硬度、脆性、紧实度是猕猴桃货架期的重要品质指标。由图7可知,与对照相比,BS-1菌液处理虽然可以提高果实的硬度、脆性和紧实度,但是效果远不及无菌体FJY。FJY处理组果实的硬度、脆性和紧实度在货架3 d时分别为805.65 g、1 462.74 g·s、305.75 g·s,货架7 d时分别为707.26 g、1 170.34 g·s、269.82 g·s,显著高于同期对照组果实(P<0.05)。这些结果表明,相比于BS-1菌液,FJY更为显著地提高了猕猴桃货架期的硬度、脆性和紧实度,具有很好的保鲜效果。
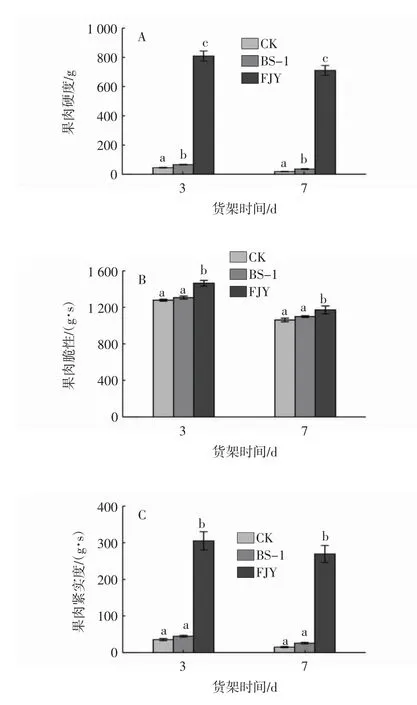
图7 BS-1及FJY对猕猴桃硬度、脆性和紧实度的影响Fig.7 Effects of BS-1 and FJY on the hardness,brittleness and tightness of kiwifruit
2.3.2 BS-1及FJY对猕猴桃可溶性固形物和可滴定酸含量的影响
猕猴桃是一种典型的呼吸跃变型果实,货架期间果实硬度迅速下降,可溶性固形物含量增加,可滴定酸含量逐渐降低[17]。由图8可知,无论是货架3 d还是货架7 d,FJY及BS-1菌液处理组可溶性固形物含量均显著低于CK(P<0.05),可滴定酸含量均显著高于CK(P<0.05),且FJY处理组可溶性固形物含量显著低于BS-1处理组(P<0.05),可滴定酸含量均显著高于BS-1处理组(P<0.05)。这些结果表明:FJY及BS-1菌液处理可以显著延缓果实可溶性固形物含量的升高,减少可滴定酸的损失,从而提高猕猴桃的货架品质,且FJY的效果较BS-1菌液更为显著。

图8 BS-1及FJY对猕猴桃可溶性固形物和可滴定酸含量的影响Fig.8 Effects of BS-1 and FJY on the soluble solids and titratable acids contents of kiwifruit
2.3.3 BS-1及FJY对猕猴桃失重率和腐烂率的影响
图9A为货架7 d时对照与处理组猕猴桃照片,可以看出虽然外表上看起来各处理几乎无差异,但CK组猕猴桃内部已完全腐烂,BS-1菌液处理组猕猴桃部分腐烂,但都已丧失食用价值,而FJY处理后的猕猴桃没有腐烂,仍具有较好的食用价值。由图9B可以看出,货架7 d时,FJY处理后的猕猴桃失重率显著低于CK和BS-1菌液处理组(P<0.05),仅为5.37%,显著降低了猕猴桃货架期的质量损失。由图9C可知,FJY可以显著降低猕猴桃腐烂率(P<0.05),可以延长货架期。

图9 BS-1及FJY对猕猴桃腐烂率的影响Fig.9 Effects of BS-1 and FJY on the weight loss rates and rot rates of kiwifruit
3 讨论与结论
病原真菌导致果蔬严重的品质恶化和产量损失,因此迫切需要探索有效、安全、环境友好的措施来控制果蔬采前和采后各阶段的真菌病害。近些年,诸多研究利用生防细菌防治果蔬采后病害取得了一定的效果[18-20]。但是关于B.subtilis对猕猴桃软腐病的研究相对较少,将FJY用于采后保鲜的研究更少。本研究发现:B.subtilis菌种BS-1菌液及FJY不仅能抑制猕猴桃软腐病主要病原菌B.dothidea和D.nobilis平板菌落的扩展,还能降低这两种病原菌的果实致病力。这为BS-1菌株生物防治猕猴桃软腐病提供了理论基础。
FJY具有一定的温度、紫外和pH耐受性。FJY抑菌效果的稳定性为其在猕猴桃采后保鲜剂及软腐病生防制剂的开发提供了可能。
本文进一步探究了BS-1菌液及其无菌体FJY对猕猴桃采后货架期贮藏的影响,发现相比BS-1菌液来说,无菌体FJY具有更好的保鲜效果,可以显著增强果实硬度,减缓可溶性固形物含量的升高和可滴定酸含量的降低,且显著降低果实质量损失,延长货架期。这为将FJY开发为猕猴桃采后保鲜剂奠定了理论基础。
