2’-岩藻糖基乳糖生物合成专利技术研究进展
2021-11-01李云飞栾庆民孙桂莲李珍珍李克文
李云飞,栾庆民,刘 峰,孙桂莲,张 莉,李珍珍,李克文,
(1.保龄宝生物股份有限公司,山东 禹城 251200;2.山东省功能糖提取与应用技术重点实验室,山东 禹城 251200;3.上海交通大学农业与生物学院,上海 200240)
2’-岩藻糖基乳糖(2’-fucosyllactose,2’-FL,Fucα-1,2-Gal-β-1,4-Glc)由D-葡萄糖(D-glucose,Glc)、D-半乳糖(D-galactose,Gal)和L-岩藻糖(L-fucose,Fuc)构成,是人乳寡糖中含量最丰富的低聚糖,在人乳中含量为2~5 g/L,约占已检出人乳总寡糖的30%[1]。人乳寡糖是婴儿发育不可或缺的成分,有助于婴儿肠道中双歧杆菌属(Bifidobacteria)、乳杆菌属(Lactobacillus)和拟杆菌属(Bacteroides)等益生菌的生长,有助于预防病原菌感染,调节免疫系统,促进婴儿大脑早期发育等功能[1-2]。
2’-FL作为食品添加剂新品种,已在国外婴儿配方乳粉、乳制品和特殊用途食品中使用[3]。有多家大型生产商推出产品,例如丹麦Glycom A/S公司、德国Jennewein Biotechnologie GmbH公司、美国GlycoSyn LLC公司、比利时Inbiose(杜邦营养)公司、韩国GeneChem公司等[4-5], 这些公司主要是利用微生物发酵法生产2’-FL。在发酵生产能力方面,发酵效价已达到180 g/L[6],发酵罐容积已达200 m3以上[7]。在产品质量与安全规范方面,先后有多家国外机构颁布法规或更新条文,如美国食品药品监督管理局(Food and Drug Adiministration,FDA)的GRAS(generally recognized as safe)安全认定、欧盟委员会的系列法规(EU 2016/375、EU 2016/376、EU 2017/2201、EU 2017/2470、EU 2019/388)、澳大利亚/新西兰食品标准局通告(2019/1190号、2019/1155号)等,从食品药品质量安全角度通过了产自大肠杆菌K-12和大肠杆菌BL-21(DE3)的2’-FL作为食品新资源的认证,明确了2’-FL纯度和最大使用量,并要求在食品成分表中标明“2-O-FL”[8-10]。我国近几年在2’-FL生物合成重组菌株构建方面发展较快,有多家高校、科研机构和企业投入其中,发表了大量研究论文,申请了多项发明专利。在规范制定方面,国家食品安全风险评估中心于2016年 8月15日公布关于2’-FL作为食品添加剂新品种的征求意见书,其中明确了2’-FL的功能、用量、生产工艺(大肠杆菌(Escherichia coli)BL-21(DE3)菌株作为加工助剂)、产品规格和质量标准(感官要求、理化指标和微生物指标)等[11]。上述学术理论研究、专利技术和质量安全规范制定等方面的成果为相关产业发展奠定了基础。本文重点关注我国近几年关于2’-FL的相关专利技术,期望加快推动我国的2’-FL生物合成早日实现产业化和规模化。
1 我国2’-FL相关专利技术概况
由图1可知,根据万方中外专利数据库统计[12],以“岩藻糖基乳糖”为题目共检索到申请我国专利38 条,其中多数集中在近2 年。从申请人或申请单位看,早期主要是国外公司或国外技术人员,如丹麦Glycom A/S公司、德国Jennewein Biotechnologie GmbH公司、德国巴斯夫(BASF)欧洲公司等。
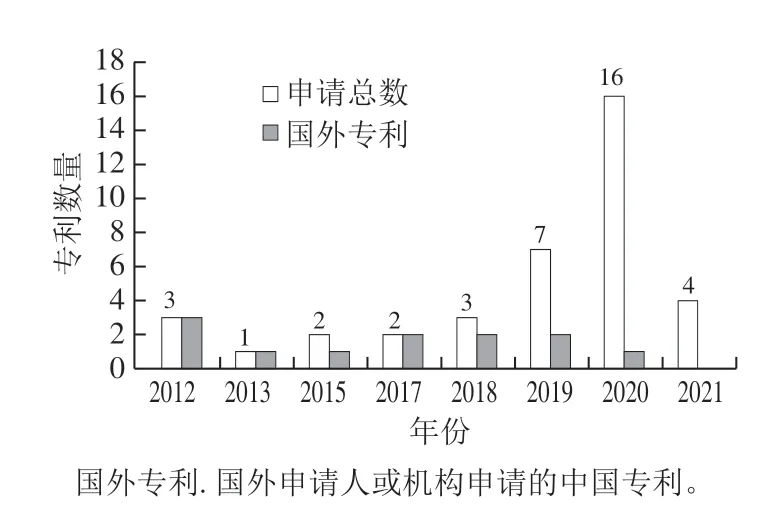
图1 申请我国岩藻糖基乳糖专利情况(统计至2021年4月)[12-15]Fig. 1 Number of fucosyllactose-related patents applied for in China during 2012-2021 (updated to April 2021)[12-15]
南开大学王磊等[13]申请专利CN106190937A(2016-12-07),是我国较早、为数不多利用基因编辑系统构建产2’-FL菌株的单位之一。近2 年申请专利的单位或个人多数是我国的科研单位或科技人员,如江南大学刘龙等[14]。 从专利技术内容看,我国申请的专利更多集中在生产2’-FL的重组菌株构建方面,占比约80%以上,其次是岩藻糖基乳糖生物功能研究及配方产品开发方面;而国外申请的专利内容涉及到岩藻糖基乳糖的化学合成法[15-17]或分离纯化技术,如结晶法[18-19]、喷雾干燥法[20-21]等工程问题,也涉及到益生元产品开发等问题[22]。在 图1统计的关于岩藻糖基乳糖的专利中,93%以上是关于 2’-FL,而关于3-FL的专利不足10%。
2 生物发酵法生产2’-FL
微生物(以大肠杆菌为例)全细胞合成生产 2’-FL,主要有2 条途径,一条是从头合成途径(De novopathway),一条是补救途径(Salvage pathway)(图2)。 从头合成途径是指细胞利用胞外葡萄糖或甘油或蔗糖等材料作为碳源和能源,从胞内糖酵解途径中间产物果糖-6-磷酸开始分支进入5’-鸟苷二磷酸(5’-guanosinediphosphate,GDP)-L-岩藻糖途径,其间在甘露糖-6-磷酸异构酶(mannose 6-phosphate isomerase,manA)、磷酸甘露糖变位酶(phosphomannomutase,manB)、甘露糖-1-磷酸鸟嘌呤基转移酶(mannose-1-phosphate guanylyl transferase,manC)、GDP-D-甘露糖-6-脱氢酶(GDPD-mannose 6-dehydrogenase,gmd)和GDP-L-岩藻糖合成酶(GDP-L-fucose synthase,wcaG)的顺序催化作用下,合成GDP-L-岩藻糖;之后以GDP-L-岩藻糖为供体,以底物乳糖为受体,在异源岩藻糖基转移酶(α-1,2-fucosyltransferase,futC)催化下合成2’-FL,并输出到胞外[23-25]。补救途径是哺乳动物细胞或共生微生物细胞内合成GDP-L-岩藻糖的途径,只能以胞内或胞外L-岩藻糖为底物,在L-岩藻糖激酶/L-岩藻糖焦磷酸化酶(L-fucokinase/L-fucose 1-phosphate guanylyltransferase,fkp) 双酶作用下转化成GDP-L-岩藻糖,并由futC进一步催化合成2’-FL[23-25]。2 条途径所用合成底物和代谢途径均有较大差异,从头合成途径是由葡萄糖或甘油或蔗糖等廉价材料合成2’-FL,工业化规模生产可行性高,但是由于合成路径长、代谢支路多,代谢效率较低。补救途径合成路径短,但是以自然界稀少的L-岩藻糖为合成底物,工业化生产成本较高。针对上述问题,专利技术围绕图2所示的合成代谢途径,采取敲除特定基因和/或过表达特定基因等方法,实现优化代谢途径的目的。重组菌合成代谢专利技术主要集中在以下方面。

图2 2’-FL重组菌合成代谢途径[23-25]Fig. 2 Metabolic pathway for 2’-FL biosynthesis by recombinant strain[23-25]
2.1 提高宿主细胞内GDP-L-岩藻糖和乳糖的积累量
GDP-L-岩藻糖和乳糖是生产2’-FL的供体和受体。GDP-L-岩藻糖是某些微生物(如大肠杆菌)合成细胞荚膜异多糖酸的中间产物。野生型菌株合成GDP-L-岩藻糖的量非常少,作为合成2’-FL的供体无法满足工业化生产需求,被认为是生产2’-FL合成途径中一个瓶颈。外加L-岩藻糖(如补救途径)虽有效果,但是成本问题限制了工业化生产。因此,专利技术都集中在从头合成途径中相关合成酶的过表达方面,强化阳性转录调节因子,敲除或弱化分解GDP-L-岩藻糖的相关酶基因。乳糖作为合成2’-FL的受体材料,主要通过外加的方式供给,相关专利技术主要集中在提高重组菌株细胞膜的乳糖转运蛋白酶(lactose permease,lacY)活性方面,以及阻断或降低乳糖胞内分解和转化问题。提高胞内GDP-L-岩藻糖和乳糖含量的策略可谓“开源节流”。张涛等[26]以大肠杆菌BL21(DE3)为宿主,通过不同拷贝数的质粒组合过表达2’-FL从头合成途径中的相关酶(manB、manC、gmd、wcaG、lacY、futC),并利用CRISPR/Cas9基因编辑系统敲除lacZ和5’-尿苷-二磷酸-葡萄糖脂质载体转移酶wcaJ的基因,阻止乳糖和GDP-L-岩藻糖的转化分解;采用补料分批发酵,在3 L发酵罐内2’-FL的产量达52 g/L。帅玉英等[27]同样以大肠杆菌BL21(DE3)为生产宿主,除了过表达2’-FL合成途径中相关酶(manB、manC、gmd、wcaG、futC)的基因外,还过表达蔗糖转运蛋白基因(scrB和scrY),敲除lacZ基因,并利用大肠杆菌同源整合系统,将构建的乳糖转运蛋白基因lacY高效表达阅读框整合到重组菌株中,突出强化了蔗糖和乳糖转运蛋白酶基因的表达;在3L发酵罐中流加蔗糖发酵,发酵液2’-FL含量达100 g/L。倪志坚等[28]以大肠杆菌为宿主,除过表达GDP-L-岩藻糖合成途径中所必需的酶manA、manB、manC、gmd、wcaG和外源futC外,利用CRISPR/Cas9基因编辑系统和传统λ-Red同源重组系统,敲除或突变大肠杆菌的甘露糖水解酶、lacZ或半乳糖苷乙酰基转移酶(β-galactoside-transacetylase,lacA)、wcaJ、mtlD和lon的编码序列,过表达大肠杆菌的阳性转录调节因子rcsA和rcsB基因;在相同条件下,该专利技术逐一比较敲除上述每个蛋白酶(lacZ、lacA、wcaJ、lon、mtlD)基因对合成GDP-L-岩藻糖和2’-FL的影响,结果显示,敲除上述每个蛋白酶基因对合成GDP-L-岩藻糖和2’-FL都有较明显的效果;经过5 L罐发酵(以甘油为底物),GDP-L-岩藻糖最高产量约400 mg/L,2’-FL为50 g/L。
2.2 futC表达
futC是催化GDP-L-岩藻糖与乳糖形成α-1,2-糖苷键的关键酶,其活性影响2’-FL的产量。在原核生物中,最早在病原菌幽门螺旋杆菌(Helicobacter pylori)中克隆出futC,是大肠杆菌等工程菌中合成2’-FL的主要外源蛋白酶(使用该蛋白酶的专利占本文统计专利数的85%以上)。随着对futC构效关系的认识,部分专利技术采用人工合成或经过修饰的futC序列。孙俊松等[29]在大肠杆菌重组菌中表达人工合成的futC序列,并证明该合成序列为功能完全的α-1,2-futC。帅玉英等[27]基于幽门螺旋杆菌futC序列和大肠杆菌密码子的偏好性重新合成futC序列。徐镇浩等[30]基于谷氨酸棒状杆菌生化特性,对源于幽门螺旋杆菌的futC序列进行优化,获得较好的效果。刘龙等[31]将幽门螺旋杆菌的futC N端与4 种蛋白融合标签柔性连接,提高了futC的可溶性和生物活性。吴志刚等[32]以大肠杆菌JM109(DE3)作为原始菌株,通过表达含有柔性多肽串联连接的2 个futC基因,增强了GDP-岩藻糖与乳糖的合成。除了基于幽门螺旋杆菌的futC外,专利技术中也出现异源表达其他微生物的futC。申哲寿等[33]比较2 种微生物的futC,在相同条件下,表达源自舞蹈拟土地杆菌(Pseudopedobater saltans)futC基因的重组菌,其2’-FL产量是表达幽门螺旋杆菌的futC重组菌产量的2 倍。孟祥锋等[34]比较6 种不同微生物来源的futC对2’-FL产量的影响,在相同条件下,幽门螺旋杆菌、醋酸杆菌属(Acetobacter)、蜡样芽孢杆菌(Bacillus cereus)、均匀拟杆菌(Bacteroides unifomis)、蛋状拟杆菌(Bacteroideseggerthii)、Neocallimastix californiae6 种微生物中,源于蜡样芽孢杆菌的重组菌2’-FL产量最高。
2.3 重组菌的生物安全性
作为重组菌的宿主微生物,大肠杆菌无疑是优选的,其具有遗传背景清楚、基因操作方便、生长繁殖快、易于放大等特性,作为生产2’-FL宿主菌有明显的优势。美国FDA、欧盟食品安全条例和我国相关征求意见稿中均明确大肠杆菌为生产菌,国外厂商也有成功的案例,例如,丹麦Glycom A/S公司(生产2’-FL、乳糖-N-新四糖、双岩藻糖基乳糖、乳糖-N-四糖)、美国GlycoSyn LLC公司(生产2’-FL)、比利时Inbiose公司(生产2’-FL)均使用大肠杆菌K-12作为生产菌种,而德国Jennewein Biotechnologie GmbH公司(生产 2’-FL)使用大肠杆菌BL21作为生产菌种[6]。大肠杆菌作为工业化生产菌株的优势毋庸置疑,在本文统计的专利文献中也占有较高比例(73%)。但是,大肠杆菌细胞外膜的脂多糖层有产内毒素活性,用于生产食品药品的原材料,其潜在风险也不可忽视。在专利技术中有2 种解决方法:1)提高大肠杆菌发酵液的分离纯化技术,将发酵菌体及其代谢副产物(如蛋白质、氨基酸、脂多糖、核酸和其他生物分子)分离出去,提高产品纯度[18-21];2)选育更安全、高效的重组菌。谷氨酸棒状杆菌(Corynebacterium glutamicum)、枯草芽孢杆菌(Bacillus subtilis)、乳酸乳球菌、酿酒酵母(Saccharomyces cerevisiae)等微生物是食品工业中生产氨基酸、核酸、酶制剂、营养化学品等原材料或酒饮料的生产菌,其生物安全性优于大肠杆菌。刘龙等[35-36]为了解决枯草芽孢杆菌对乳糖利用率低的问题,构建由P43启动子和lacY基因序列构成的替换框,通过同源重组技术替换枯草芽孢杆菌168的α-淀粉酶基因amyE位点,提高了枯草芽孢杆菌重组菌对乳糖的利用率。徐镇浩[30]、 申哲寿[33]等利用谷氨酸棒状杆菌作为生产宿主菌,在过表达内源manB和manC基因基础上,异源表达源自大肠杆菌K-12MG1655的gmd、wcaG、lacY基因和源自舞蹈拟土地杆菌的futC基因。通过补料分批培养持续供给葡萄糖或乳糖,菌株生长活跃,提高了2’-FL产量。孟祥锋[34]、 刘巍峰[37]等利用酿酒酵母W303-1a为宿主菌,通过同源重组或定点诱变等技术将来源于蜡样芽孢杆菌的futC基因、来源于乳酸克鲁维斯酵母菌的乳糖转运蛋白酶lac12基因、来源于大肠杆菌K12的gmd和wcaG基因整合入酿酒酵母中。重组菌株不但具有乳糖利用功能,而且具有一个或多个拷贝的重组基因或DNA序列,从而高效表达了异源蛋白酶。
2.4 重组菌的遗传稳定性
为了过表达2’-FL合成途径中相关酶,在重组菌株构建过程中往往采用多拷贝数的表达质粒。这些质粒在细胞生长繁殖过程中丢失与否是重组菌遗传稳定性的关键因素之一,也是影响工业化生产产品质量和效益的重要因素。在专利技术中,刘龙等[31]利用CRISPR/Cas9基因编辑系统在大肠杆菌MG1655鞭毛驱动蛋白基因fliR位点上整合外源futC基因,在L-墨角藻糖激酶基因fuck位点上整合外源fkp基因,获得了高效合成2’-FL的无质粒工程菌株。张涛等[26]经过摇瓶发酵实验,从36 株重组菌 (BL21(DE3),ΔlacZ、ΔwcaJ)BZW 1~36中挑选出含有不同质粒的5 株菌株(BZW 1~5),且经过6 代培养,2’-FL产量均保持稳定,表明实验菌株遗传稳定性良好。

续表1
2’-FL生物合成重组菌株构建部分相关专利如表1所示。
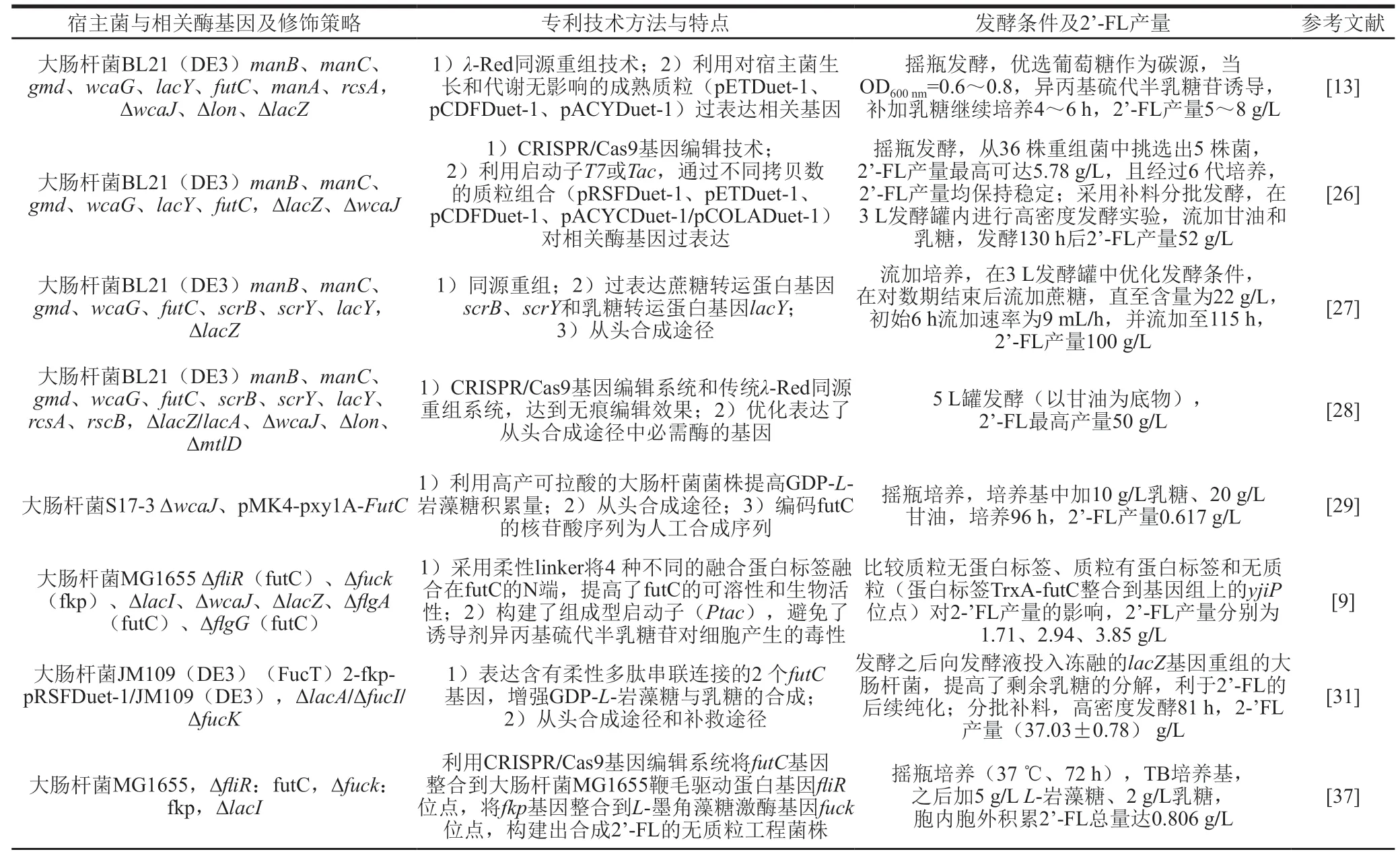
表1 2’-FL生物合成重组菌株构建部分相关专利Table1 Patents on the construction of recombinant strain for 2’-FL biosynthesis
3 结 语
从上述专利内容和数量看,我国专利技术更多集中在高效、安全重组菌株的构建方面。采用CRISPR/Cas9基因编辑系统和/或传统的λ-Red同源重组系统,优化2’-FL合成代谢途径。利用不同拷贝数的表达质粒或强启动子过表达相关酶的基因,提高了部分关键酶的表达量。在生物安全性方面,多项专利选择了安全性更高的谷氨酸棒状杆菌、枯草芽孢杆菌、酿酒酵母等微生物作为宿主菌,内源基因与外源基因得到互补。
构建安全、高效的重组菌株是2’-FL工业化生产的第1步,虽然微生物合成2’-FL的路径已经明确,但是不同菌株在不同环境下代谢效率差异很大,优化代谢途径和代谢条件还有很大空间。其次,中试放大过程及发酵液分离纯化技术与成本是产品走向市场成败的关键环节,在上述申报专利技术中,重组菌发酵实验仍局限在实验室摇瓶或小型实验发酵罐内(5 L以下),在中试条件下甚至生产条件下菌株的代谢特性和遗传特性有待研究。虽然目前工业上已有较多的分离纯化技术供选择(如膜分离、离子交换、活性炭吸附、色谱分离、结晶和干燥等),但是发酵液的组成和流动特性均影响产品的分离纯度和成本,产品纯度、分离纯化技术选择和分离纯化效率有待优化。
