TBC 1结构域家族成员15蛋白、最小表观扩散系数对脑胶质瘤恶性程度及预后的预测价值
2021-11-01郝晓伟赵亚超米建强范波
郝晓伟,赵亚超,米建强,范波
河南科技大学第一附属医院神经外科,河南 洛阳 471003
脑胶质瘤是大脑中最常见的原发肿瘤,其恶性程度对治疗方案和预后的影响很大。根据胶质瘤分化程度的不同,可进一步分为Ⅰ~Ⅳ级,其中Ⅰ、Ⅱ级为低级别胶质瘤,Ⅲ、Ⅳ级为高级别胶质瘤。术前准确判断恶性程度和病理分级,有助于制订治疗方案和判断预后。钆增强MRI检查是临床上确定胶质瘤性质的一种常用方法
,但不能显示微观生理状态。磁共振弥散加权成像(diffu-sion weighted imaging,DWI)可以观察活体组织中水分子的运动情况,后处理软件获得的DWI数据的表观扩散系数(apparent diffusion coefficient,ADC)可间接揭示生物组织的微观结构。研究表明,TBC1结构域家族成员15(TBC domain family member 15,TBC1D15)在胶质瘤组织中的表达水平明显高于正常脑组织。同时,其在肝癌细胞、乳腺癌、前列腺癌和甲状腺癌中也均呈高表达,分析其在胶质瘤的生长过程中发挥的重要作用,为通过调节TBC1D15的表达来抑制胶质瘤的生长提供了可能。本研究主要探讨TBC1D15蛋白、ADC与胶质瘤病理分级及患者预后的关系,现报道如下。1 对象与方法
1.1 研究对象
选取2017年1月至2020年1月河南科技大学第一附属医院收治的132例脑胶质瘤患者。纳入标准:①经病理学检查确诊为脑胶质瘤;②均接受MRI检查,且接受手术切除治疗;③年龄>18岁。排除标准:①术前未接受放化疗等抗肿瘤治疗;②合并免疫系统疾病、血液系统疾病等其他严重疾病;③合并其他系统恶性肿瘤。根据WHO分类标准,132例脑胶质瘤患者中,低级别胶质瘤56例,高级别胶质瘤76例。低级别胶质瘤患者中男35例,女 21例;年龄(58.82±9.75)岁;体重指数为(22.18±2.03)kg/m;合并高血压11例,合并糖尿病8例。高级别胶质瘤患者中男42例,女34例;年龄(55.95±9.10)岁;体重指数为(22.09±2.11)kg/m;合并高血压17例,合并糖尿病12例。两组患者性别、年龄和体重指数等基线特征比较,差异均无统计学意义(P
>0.05),具有可比性。本研究经医院伦理委员会批准通过,所有患者均知情同意并签署知情同意书。1.2 免疫组化法检测TBC 1 D15蛋白的表达情况
取手术切除的脑胶质瘤组织,10%甲醛固定24~48 h后石蜡包埋。将石蜡标本切成厚度约为4 mm的连续组织切片4张,60℃烘烤3 h,常规脱蜡,加3%过氧化氢10 min,室温下孵育,磷酸盐缓冲液(phosphate buffered solution,PBS)洗涤3次,每次3 min,柠檬酸溶液修复,PBS洗涤3次,每次3 min。加入一抗孵育过夜,PBS洗涤3次,每次3 min,添加聚合物增强剂,室温下孵育20 min,PBS洗涤3次,每次3 min,添加酶标记的抗小鼠聚合物(二抗,室温下孵育30 min),PBS洗涤3次,每次3 min,滴加免疫组化链霉亲和素-生物素化过氧化酶复合物染色(streptoavidin-biotin-enzymecomplex,SABC)试剂并置于室温环境中30 min,二氨基联苯胺(diaminobenzidine,DAB)显色用水冲洗,苏木素复染,常规脱水封片。
结果判定:细胞呈黄色或褐色为阳性表达,细胞结构清晰,阳性颗粒定位好,着色与背景反差明显判定为TBC1D15阳性。使用图像分析系统进行图像分析,每个切片随机选择3个高倍视野(×200),测量3个视野的积分光密度(integral optic density,IOD)值,取平均值。
1.3 MRI检查方法
采用美国GE公司的1.5T磁共振仪,配备8通道相控阵头颅线圈。常规MRI检查,序列包括矢状T1加权成像(T1-weighted imaging,T1WI)-快速液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR)、横截面白色自旋回波(spin echo,SE)T1WI-FLAIR、快速自旋回波(fast spin echo,FSE)T2加权成像(T2-weighted imaging,T2WI)、液体衰减反转恢复序列FLAIR、静脉注射钆喷替酸葡甲胺(Gadolinium diethylenetriamine pentaacetic acid,Gd-DTPA)矢状和横向T1WI增强扫描。扫描范围为颅顶至枕骨孔,层厚6 mm,间隔2 mm。DWI扫描采用单激发SEEPI序列,在X、Y和Z方向施加色散梯度,b=0,1000 s/mm,重复时间(repetition time,TR)为4800 ms,回拨时间(echo time,TE)为68.6 ms,视野(field of vision,FOV)为240 mm×240 mm,矩阵128×128,扫描时间为77 s。扫描层定位与横断面T1WI、T2WI、FLAIR序列一致。
图像后处理将原始数据上传至ADW 4.3工作站,利用Functool软件进行后处理,由两名经验丰富的神经放射科医师阅图,测量ADC值。浏览肿瘤病灶各级ADC图,根据常规MRI图像避开肿瘤的囊性、坏死、出血和钙化区域,在肿瘤的每一层放置2~3个30~40 mm的感兴趣区域(region of interest,ROI),选择最小ADC值。
1.4 统计学方法
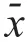
2 结果
2.1 TBC 1 D15蛋白IOD值、最小ADC值比较
高级别脑胶质瘤组织中TBC1D15蛋白IOD值明显高于低级别脑胶质瘤组织,最小ADC值明显低于低级别脑胶质瘤组织,差异均有统计学意义(P
<0.01)。(表1)
表1 高级别和低级别脑胶质瘤组织中TBC 1 D15蛋白IOD值、最小ADC值比较(±s)
2.2 不同临床特征脑胶质瘤患者脑胶质瘤组织中TBC 1 D15蛋白IOD值、最小ADC值的比较
不同年龄、性别、肿瘤类型及肿瘤直径脑胶质瘤患者脑胶质瘤组织中TBC1D15蛋白IOD值、最小ADC值比较,差异均无统计学意义(P
>0.05)。(表2)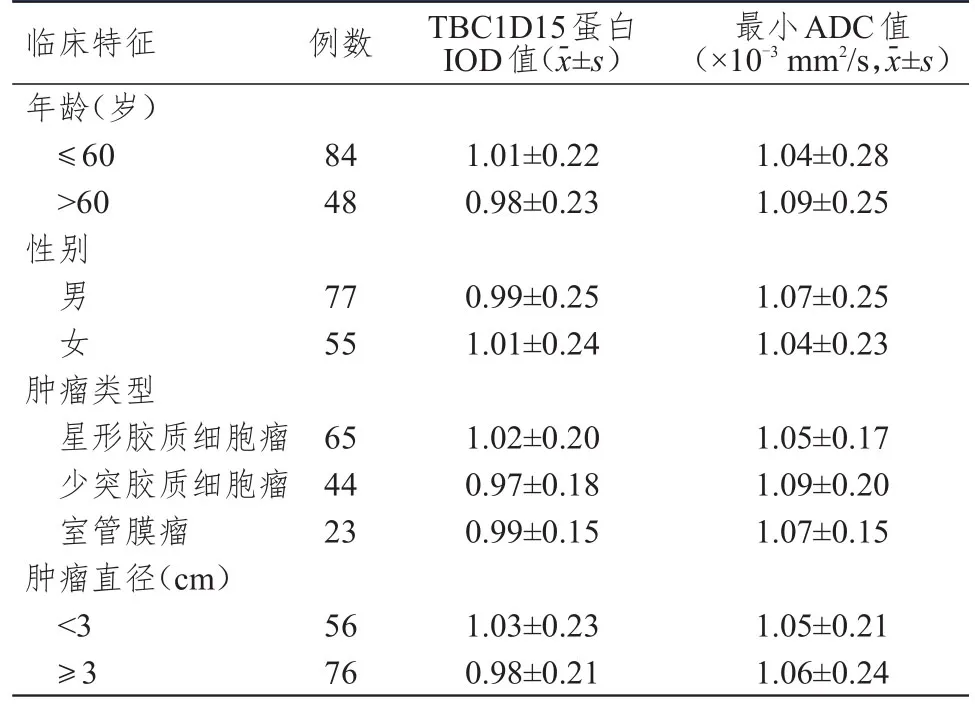
表2 不同临床特征脑胶质瘤患者TBC 1 D15蛋白IOD值、最小ADC值( n=132)
2.3 不同预后情况脑胶质瘤患者脑胶质瘤组织中TBC 1 D15蛋白IOD值、最小ADC值比较
截至2021年6月,132例脑胶质瘤患者中,死亡52例,生存80例。死亡脑胶质瘤患者脑胶质瘤组织中TBC1D15蛋白IOD值明显高于生存患者,最小ADC值明显低于生存患者,差异均有统计学意义(P
<0.01)。(表3)
表3 不同预后情况脑胶质瘤患者脑胶质瘤组织中TBC 1 D15蛋白、最小ADC值比较(±s)
2.4 TBC 1 D15蛋白IOD值、最小ADC值对高级别脑胶质瘤的预测价值
TBC1D15蛋白IOD值、最小ADC值诊断高级别脑胶质瘤的AUC分别为0.883和0.848,此时的最佳截断值分别为0.99和1.11×10mm/s。(表4)
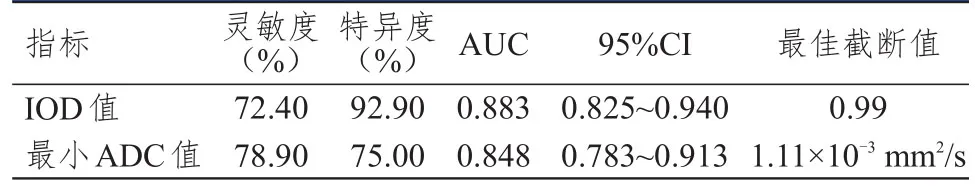
表4 TBC 1 D15蛋白IOD值、最小ADC值对高级别脑胶质瘤的预测价值
2.5 TBC 1 D15蛋白IOD值、最小ADC值对脑胶质瘤患者死亡的预测价值
TBC1D15蛋白IOD值、最小ADC值预测脑胶质瘤患者死亡的AUC分别为0.913和0.888,此时的最佳截断值分别为1.12和0.95×10mm/s。(表5)
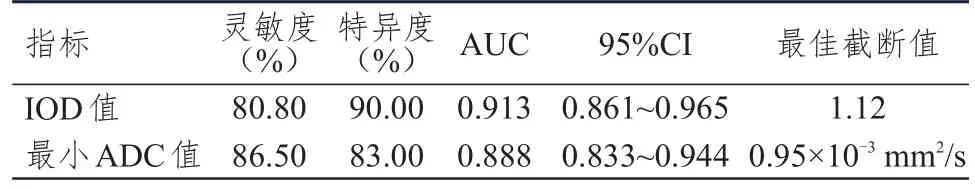
表5 TBC 1 D15蛋白IOD值、最小ADC值对脑胶质瘤患者死亡的预测价值
3 讨论
不同级别脑胶质瘤的手术方式选择和预后有明显差异,低级别胶质瘤是良性肿瘤,预后较好,而高级别胶质瘤需要进行手术切除辅助放化疗治疗,患者的预后较差,复发率高。术前准确评估胶质瘤的级别有助于治疗方案的选择和预后评估。由于胶质瘤存在典型异质性,同一肿瘤样本可能有不同的分级,活检部位选择错误可能低估肿瘤级别,影响治疗方案的选择。只有肿瘤分级最高的部分才能反映肿瘤的真实病理分级。高级别胶质瘤在MRI检查方面也有不均质性。肿瘤实质部分的最小ADC值最能代表每个肿瘤中细胞密度最高或细胞增殖最明显的部分,从而反映肿瘤的真实分级。
本研究结果显示,高级别脑胶质瘤组织的最小ADC值明显低于低级别脑胶质瘤组织,与文献报道相一致,肿瘤最小ADC值可能与肿瘤分级呈负相关。高级别脑胶质瘤肿瘤细胞排列紧密且数量增多,核异型性大,细胞外空间缩小,扩散明显受限,ADC值降低,结果表明,ADC值可以预测脑胶质瘤的分级。本研究结果显示,死亡患者脑胶质瘤组织中最小ADC值明显低于生存患者,表明最小ADC值与肿瘤恶性程度有关。这可能是因为病灶小灶性坏死增多,细胞水分子减少,扩散受限,ADC值偏低。
TBC家族蛋白可参与多种肿瘤的发生、发展过程,该家族的大部分蛋白具有原癌基因的功能,可能通过调节Rab蛋白参与细胞恶性转化或转移。TBC1D15属于TBC蛋白家族成员,作为Rab-GAP并负调控Rab蛋白。TBC1D15还可以作为葡萄糖转运蛋白4(glucose transporter 4,GLUT4)易位的主要调节剂,并进一步影响GLUT4介导的葡萄糖摄取。肿瘤细胞获得能量的方式发生变化、能量代谢紊乱均可能与肿瘤细胞线粒体功能有关。因此,调节线粒体动力学可能会调节肿瘤细胞的生长。本研究通过免疫组化法检测TBC1D15蛋白在脑胶质瘤中的表达,结果发现,高级别脑胶质瘤组织中TBC1D15蛋白IOD值明显高于低级别脑胶质瘤组织,死亡脑胶质瘤患者脑胶质瘤组织中TBC1D15蛋白IOD值明显高于生存患者,表明TBC1D15蛋白的表达随着肿瘤分级和恶性程度的增加而增加。在细胞分化差、恶性程度高的肿瘤组织中TBC1D15蛋白表达强度较高,而在细胞分化较好、病理分级较低的肿瘤组织中表达强度较低。表明TBC1D15蛋白、肿瘤的病理分级和预后有关。本研究结果显示,脑胶质瘤组织TBC1D15蛋白IOD值、最小ADC值变化不受患者年龄、性别、肿瘤类型及肿瘤直径的影响,在预测脑胶质瘤恶性程度和预后方面具有一定的价值。
因为ROI的选择位置会影响结果,有的ROI的选择测量肿瘤增强部分,有的测量未增强的部分;对坏死组织ROI测量也会导致测量ADC值存在差异,不同级别胶质瘤数据重叠,本研究选择肿瘤实质部分的最小ADC值作为分析指标,并取多次测量的平均值,以保证结果的准确性。
目前,有研究探讨TBC1D15在抑制脑胶质瘤细胞的增殖和促进胶质瘤细胞的凋亡方面的机制研究,而在预测胶质瘤恶性程度及患者预后方面的价值尚不明确,本研究进一步探讨发现,TBC1D15蛋白表达在预测脑胶质瘤恶性程度和患者预后方面明显优于最小ADC值,具有较好的研究价值,有助于对脑胶质瘤患者的早期诊断、治疗,改善患者的预后。但本研究的不足在于不同级别患者较少,需要通过大样本研究和临床试验进行验证,后期可以增加基因水平和动物水平相关实验进一步探索作用机制。
综上所述,高级别脑胶质瘤组织TBC1D15蛋白表达上调,但其最小ADC值较低,在预测脑胶质瘤恶性程度及预后方面有一定价值。
