解脂耶氏酵母作为微生物细胞工厂的应用研究进展
2021-10-31刘士琦李圣龙赵雅坤肖冬光于爱群
赵 禹,刘士琦,李 建,李圣龙,赵雅坤,肖冬光,于爱群,2,
(1.天津科技大学生物工程学院,天津 300457;2.省部共建食品营养与安全国家重点实验室,天津 300457)
合成生物学是近年发展起来的一门新兴分支学科,其将工程、数学、生物学和化学等多个学科的研究理论和方法结合并应用于生物系统,基于此提高生物系统的可控性[1-2]。经过近20 年的快速发展,合成生物学已在能源、环境、食品、医疗和农业等多个领域中得到了广泛应用,吸引了越来越多研究者的关注,发展前景极为广阔[3-4]。解脂耶氏酵母于1942年被首次分离,先后被命名为Candida lipolytica、Endomycopsis lipolytica、Saccharomycopsis lipolytica,最终定名为Yarrowia lipolytica[5]。该酵母通常分布于富含脂质和蛋白质的底物中,如奶制品或香肠等;并且已经被美国食品药品监督管理局(Food and Drug Administration,FDA)认证为公认安全的微生物[6]。解脂耶氏酵母是目前研究最多、应用最广泛的非常规酵母之一,与常规酵母酿酒酵母相比,该酵母具有多种独特的生化和代谢特征。第一,解脂耶氏酵母是典型的二型性酵母;第二,它是一种严格的好氧菌,基本不产乙醇[5];第三,其胞内具有高效的乙酰辅酶A代谢通路和较高的三羧酸循环通量,脂质的积累量可达77%,因此非常适合有机酸、脂质及其衍生物的工业生产[7-9];第四,其可以分解油脂类化合物,在废油污染的环境修复方面有重要作用。此外,解脂耶氏酵母可以在较低pH值(3~6)和较高的渗透压条件下生长,并且其还可以利用多种碳源、蛋白质和疏水性底物,如糖类、烃类、醇类、脂类等[5],因此其对生长环境要求不严格,可在各种环境条件下生长,具有良好的工业应用基础。
近年来,解脂耶氏酵母全基因组序列已经被公布,并且随着合成生物学和基因编辑技术在解脂耶氏酵母中的不断应用与快速发展以及其表达载体及转化方法的不断完善,研究者们利用解脂耶氏酵母作为底盘细胞进行合成生物学的研究也取得了迅猛发展,这就进一步扩大了该酵母的工业应用范围。比如,研究者们利用合成生物学技术已实现了多种脂肪酸合成途径在解脂耶氏酵母底盘中的重构与优化,如油酸[10]、蓖麻油酸[11]、共轭亚油酸[12]、二十碳五烯酸(eicosapentaenoic acid,EPA)[13]等。其中,美国杜邦公司已经成功改造解脂耶氏酵母底盘,实现了对具有抗血栓、疏通血管和改善高血压等作用EPA的异源工业化生产。此外,研究人员也利用解脂耶氏酵母作为工程菌株合成了其他高附加值产品,如生物材料、生物燃料、生物化学品、香料、药物、工业酶和药用蛋白等[14-26]。这些成功案例说明解脂耶氏酵母在上述行业中具备工业化应用的潜力。
综上,对解脂耶氏酵母这一新型非模式微生物底盘的应用和开发正在成为合成生物学领域的研究热点。本文主要介绍了解脂耶氏酵母在合成生物学和基因编辑技术方面的最新研究进展,包括合成生物学元件、基因表达载体、基因组编辑方法等内容;同时,也对近年来以解脂耶氏酵母作为底盘细胞生产具有代表性高附加值产品的研究进行了全面总结;最后,对解脂耶氏酵母相关发展前景做出展望,以期为从事相关研究的人员提供有用信息。
1 解脂耶氏酵母基因表达系统及合成生物学元件研究进展
通过对生物体内源或外源基因的表达进行精确的人工调控来平衡目标途径中不同酶的表达水平,并使代谢通量最大化,最终降低目的产物的合成成本是合成生物学的重要研究内容之一。代谢途径中酶的表达可以通过不同方式控制,如调控基因拷贝数、转录活性、mRNA稳定性、翻译效率和蛋白质稳定性等。本文主要介绍解脂耶氏酵母中可用于有效控制外源基因转录的最基本也是最重要的合成生物学元件(启动子、终止子)以及相关表达系统。
1.1 宿主菌株
同种微生物不同菌株的基因组间仍存在较多差异基因,进而会影响菌株的形态、生理生化特征和产物生产模式,因此宿主菌株的选择往往会对最终工程菌株的性能起决定性作用。对于解脂耶氏酵母而言,在基础研究和实际生产中使用较多的野生型菌株主要包括W29(CLIB89)、H222(DSM 27185)和CBS6124-2等。目前,解脂耶氏酵母的常用参考菌株为E150(CLIB122)(最早完成全基因组测序和注释),该菌株经过W29和CBS6124-2的多次回交获得。W29的营养缺陷型菌株——Po1d是早期基因工程和代谢工程改造中理想的宿主菌株,其主要有以下优势:1)外源蛋白表达和分泌水平高;2)整合了来自酿酒酵母的蔗糖转化酶编码基因SUC2,使其能以蔗糖为碳源,从而为所构建的解脂耶氏酵母工程菌株能够应用糖蜜等廉价碳源进行工业发酵奠定基础;3)内源的碱性胞外蛋白酶编码基因AEP被敲除,这有利于保护表达的外源蛋白不被降解。研究人员在Po1d菌株的基础上开发出了一系列更适合表达外源蛋白的宿主菌株(Po1f、Po1g和Po1h),这些菌株已成为目前利用合成生物学技术进行异源生物合成等研究中广泛使用的解脂耶氏酵母底盘细胞。其中,Po1g菌株更便于高效整合基于质粒pBR322的外源质粒,分子水平操作更加简便。研究人员又在Po1d菌株的基础上构建了Y1212菌株,从而促进了基于zeta序列(高度保守的逆转录转座子的长末端重复序列)[5]载体的整合。该菌株中脂肪酶相关编码基因(LIP2、LIP7和LIP8)已被敲除,因此有利于在其中构建脂质代谢途径[27]。此外,近年来研究者们从海洋环境中也分离出一些解脂耶氏酵母野生型菌株,如脂质含量较高的ACA-DC 50109菌株,其经过进一步工程改造可用于单细胞油脂的生产[28];蛋白含量高的SWJ-1b菌株是生产单细胞蛋白或柠檬酸的理想宿主菌株[29-31]。表1主要列出了目前应用较为广泛的解脂耶氏酵母宿主菌株。
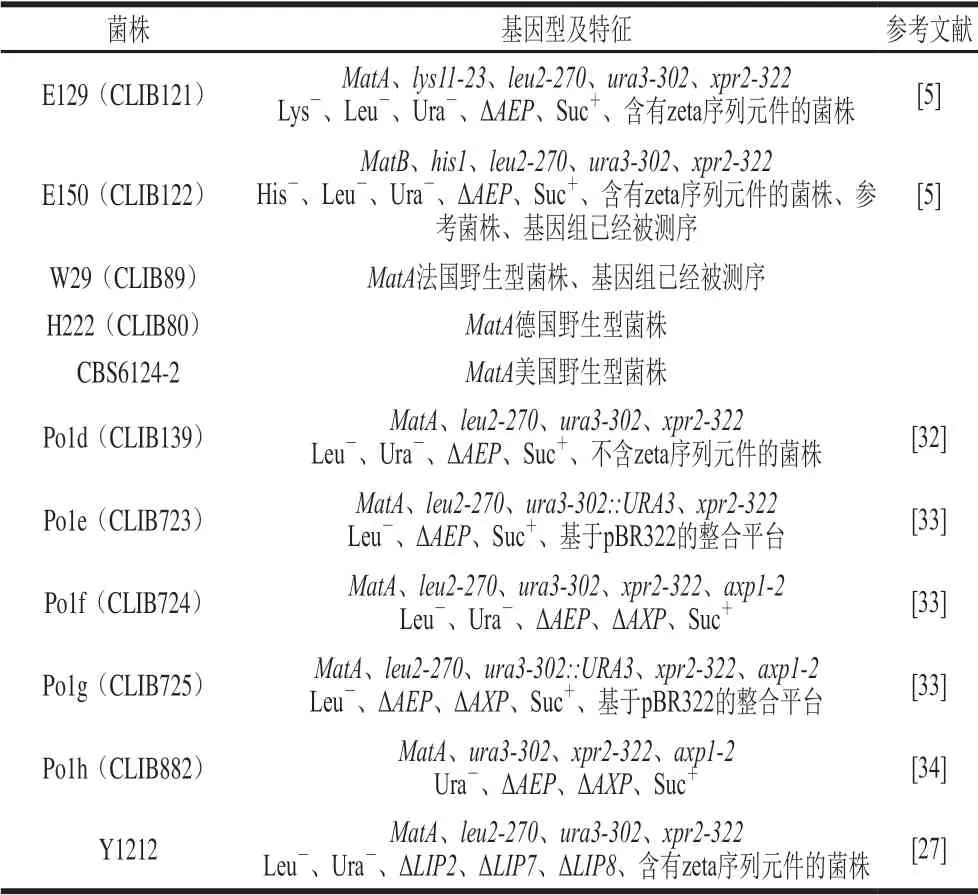
表1 常用的解脂耶氏酵母宿主菌株Table1 Most commonly used Y. lipolytica host strains
1.2 表达载体
表达载体通常是以天然质粒为基础,再经体外人工构建而形成的重组质粒,需至少含有复制起始位点、选择标记基因和多克隆位点等功能元件。表达载体与宿主菌株两部分一起构成了一个完整的原核或真核表达系统。到目前为止,在解脂耶氏酵母中还尚未发现任何天然内源性质粒的存在,但是科学家们已经利用自主复制序列和着丝粒序列设计出了可以在解脂耶氏酵母胞内染色体外进行自主复制的游离型质粒[35-36]。然而,该游离型质粒存在拷贝数较低(1~3 个/细胞)且易丢失的问题,因此并未得到广泛应用[5,33,37]。紧接着,科学家们又人工构建了解脂耶氏酵母的整合型表达载体。在不加任何选择压力的条件下对工程菌株进行连续传代100 次以上,质粒稳定性仍保持在100%,这说明与游离型质粒相比,整合型质粒的遗传稳定性更高。因此,目前用于外源基因表达的解脂耶氏酵母载体主要以整合型质粒为主[38],已经商用的整合型质粒主要有中国台湾Yeastern公司生产的胞内表达载体pYLEX1和分泌表达载体pYLSC1两种[39],其应用已经相当成熟和广泛。pYLEX1和pYLSC1均能够通过同源重组的方式整合到解脂耶氏酵母宿主菌株基因组的特定位点上,该步骤的完成需要在序列的5’和3’端分别含有500~1 000 bp的同源臂[5]。然而,解脂耶氏酵母胞内会优先使用非同源末端连接(nonhomologous end joining,NHEJ)进行DNA修复,这就限制了同源重组的效率[40]。研究者们通过将解脂耶氏酵母表达宿主菌NHEJ途径中的关键蛋白Ku70编码基因进行了敲除,成功获得了同源重组精确率更高的菌株,也保证了表达载体的定点插入[41-42]。
1.3 合成生物学元件
1.3.1 启动子
启动子通常位于结构基因的上游,是与RNA聚合酶特异性结合的一段DNA序列,可以决定转录的起始位置并控制转录起始时间和表达强度。启动子是最核心的合成生物学元件之一,也是构建基因表达载体的基本组件。选择合适启动强度的启动子也是合成生物学研究控制基因表达的常用方法[43-44]。然而,对于解脂耶氏酵母而言,近期已有许多研究表明使用强启动子并不一定能提高蛋白质的表达水平[45]。因此,需要进一步对解脂耶氏酵母胞内启动子的功能特性进行探索,以期为通过分子改造来开发性能更强、转录活性范围更广的人工合成启动子和最终实现利用合成启动子对解脂耶氏酵母中复杂代谢通路进行有效调控提供指导。
碱性胞外蛋白酶基因的启动子pXPR2[46]和翻译延伸因子1-α基因的启动子pTEF1[47]是从解脂耶氏酵母中最早分离鉴定并广泛应用于基因表达盒(包括启动子、基因编码区和终止子)构建的启动子。其中,pXPR2为蛋白胨诱导型强启动子,pTEF1为组成型强启动子,这两种启动子均已实现了多种异源蛋白的高效表达。紧接着,许多其他不同类型的内源性启动子也逐渐被克隆与鉴定,并在解脂耶氏酵母基因工程、代谢工程和合成生物学研究中得到了成功应用,如pTDH1、pGPM1、pFBA1、pPOX2、pPOT1、pLIP2、pICL1、pYAT和pEYK1等[13,48-50]。
目前的研究表明,解脂耶氏酵母启动子功能元件的变化对启动子活性具有较大的影响。例如,研究人员通过对解脂耶氏酵母pXPR2启动子进行分段功能分析,最终确定了上游增强序列(upstream activating sequence,UAS)1B是对启动子活性影响最显著的功能元件。随后,Madzak等[51]在pLEU2核心启动子上游串联了不同拷贝数的UAS1B元件,构建了人工启动子文库(含有php1d、php2d、php3d和php4d4 个启动子)以进一步验证UAS1B元件的功能。结果表明,随着UAS1B拷贝数的增加,启动子强度不断增加。目前,人工合成的组成型强启动子php4d已经成为在解脂耶氏酵母宿主菌中使用最广泛的启动子之一。Blazeck等[52]又在pLEU2和pTEF1的核心启动子上游分别串联了32 个和16 个UAS1B元件,改造后的启动子活性最高提高了8 倍以上;通过将不同的UAS元件(UASTEF和UAS1B)进行组合,构建的启动子表达活性比野生型启动子提高了7 倍多[53]。此外,研究人员通过启动子截短分析的方法鉴定出了新的核心启动子序列,并尝试对不同启动子元件(UAS、近端序列、TATA框和核心启动子序列)进行人工重排,结果证明了核心启动子序列是决定解脂耶氏酵母启动子强度的关键因素[54]。
最新研究发现,基于内含子介导的基因增强效应对启动子的改造有助于提高基因的表达水平[55]。例如,Hong等[48]在pFBA1启动子的基础上构建了添加部分内含子序列的pFBA1IN启动子,重组后的启动子其活性提高了5 倍。Tai等[56]也构建了pTEFin启动子,其表达水平比无内含子的pTEF提高了17 倍。综上,这种人工合成启动子的策略显示出了较好的前景,也为对启动子元件进行进一步人工改造提供了有效思路。然而,人工合成启动子一般都是利用酵母天然启动子作为骨架进行改造,如UAS和核心启动子,与细菌相比,改造后的启动子序列相对较长。因此,通过定向或随机突变来筛选表达范围更广的核心启动子和序列更短、功能更强的UAS元件是将来人工启动子工程的重要研究方向。
此外,由于诱导型启动子能够基于特定诱导物或阻遏物来调控目的基因的表达,因此这类启动子在解脂耶氏酵母合成生物学的研究和应用中成为一个研究热点。目前在解脂耶氏酵母宿主菌中可用的诱导型强启动子主要包括胞外脂肪酶基因启动子pLIP2、过氧化物酶体酰基辅酶A氧化酶基因启动子pPOX2、过氧化物酶体3-酮脂酰基CoA硫解酶基因启动子pPOT1、碱性胞外蛋白酶基因启动子pXPR2和异柠檬酸裂合酶基因启动子pICL1等[57-58]。表2列出了目前解脂耶氏酵母表达系统中常用的启动子,它们也在解脂耶氏酵母的合成生物学研究中展现了巨大的应用潜力。

表2 解脂耶氏酵母表达系统中常用的启动子Table2 Most prominently used promoters for heterologous expression in Y. lipolytica
1.3.2 终止子
和启动子一样,终止子也是非常重要的合成生物学元件之一。从作用机理上来看,终止子可以发出转录终止信号,并可以影响mRNA的稳定性和半衰期。缺少终止子会使mRNA一直延伸,以至于无法翻译,影响蛋白质的表达。因此,终止子对于基因转录的调控也至关重要[63-65]。然而,与启动子相比,对于解脂耶氏酵母终止子的研究仍然较少。目前解脂耶氏酵母中通常使用ScCYC1t、XPRt和LIP2t等几种常见终止子。近年来,合成终止子工程也得到快速发展,人工合成的终止子通常比天然终止子序列更短、效果更好。同时,合成的终止子可以降低同源重组的风险,尤其在构建较庞大的代谢通路时优势明显[63]。Curran等[63]在酿酒酵母中表征了30多种终止子,结果表明,当与表达强度相对较低的启动子偶联时,不同的终止子对基因转录水平的影响非常明显;随后该学者通过对CYC1t进行突变研究,证明了特定的终止子序列也会对基因的表达水平产生显著影响。这项工作表明对终止子的改造也能够有效调控酵母基因的异源表达。此外,有研究者还将酿酒酵母的人工合成终止子在解脂耶氏酵母宿主菌中进行了功能验证,结果发现与常用的CYC1t相比,含有合成终止子菌株的绿色荧光蛋白荧光强度增加了60%,这说明该合成终止子在不同酵母间均具有较好效果,表现出较好的种间可转移性[66]。然而,现阶段关于解脂耶氏酵母终止子基因工程的研究还相对较少,已经取得的研究结果都还未证明人工合成终止子在解脂耶氏酵母代谢工程中的普遍适用性。尽管如此,研究者们对解脂耶氏酵母终止子工程的关注仍越来越多,筛选和构建性能更好、功能可控的人工合成终止子将会是未来的重点研究方向,也势必会推动解脂耶氏酵母表达系统和合成生物学研究的快速发展。
2 解脂耶氏酵母基因编辑方法研究进展
近年来,随着基因编辑技术的快速发展,越来越多的基因编辑方法也在解脂耶氏酵母中得到了开发应用,如CRISPR-Cas、Cre-loxP、Gateway、类转录激活因子效应物核酸酶、锌指核酸酶(zinc-finger nucleases)、大范围核酸酶(meganucleases)技术等。本文主要对在解脂耶氏酵母宿主菌中应用前景更好的CRISPR-Cas、CreloxP和Gateway技术展开讨论。
2.1 CRISPR-Cas系统
CRISPR-Cas系统是最近出现的基因组定点编辑技术,其利用RNA作为指导,使用Cas系列核酸酶对目的基因进行剪切。CRISPR于1987年被首次发现,是Ishino等[67]在大肠杆菌(Escherichia coli)K12碱性磷酸酶基因附近发现的串联间隔重复序列。随后,研究人员发现其在细菌和古细菌基因组中也广泛存在。2002年,Jansen等[68]将其正式命名为规律间隔成簇短回文重复序列(custered regularly interspaced short palindromic repeat,
CRISPR)。Cas9是一种由tracrRNA和crRNA介导的DNA内切酶[69]。目前,研究人员通常将crRNA和tracrRNA融合成一条sgRNA,在sgRNA的指导下,由Cas9内切酶对DNA进行切割(图1)。此外,在设计sgRNA时靠近PAM序列的13 个碱基要严格配对,否则将会造成脱靶。相比其他基因编辑方法,CRISPR-Cas系统构建简便,只需设计正确的sgRNA序列即可实现基因组的快速编辑,一经问世就受到广泛关注[70]。

图1 CRISPR-Cas系统的工作原理Fig. 1 General working principle of the CRISPR-Cas system
自从2013年CRISPR-Cas系统被首次成功应用于对酿酒酵母的基因组编辑以来[71],该技术已经在其他多种酵母中得到了成功应用,如解脂耶氏酵母[72-73]、巴斯德毕赤酵母[74]、乳酸克鲁维酵母[75]和粟酒裂殖酵母[76]等。Schwartz等[72]将经过密码子优化的Cas9蛋白和RNA聚合酶III启动子表达的gRNA共转化到解脂耶氏酵母中,使单基因的敲除率和同源重组率分别达到了90%和70%,进一步敲除ku70基因以后,同源重组效率可达100%。Gao Shuliang等[77]将Cas9和gRNA表达盒插入到同一个载体,然后分别转化到野生型、Δku70缺陷型和Δku70/Δku80双缺陷型的解脂耶氏酵母菌株中,发现野生型菌株基因编辑效率达到85.6%,Δku70/Δku80双缺陷型菌株基因编辑效率最高可达94.1%。在此基础上,还通过NHEJ实现了同时编辑2 个或3 个基因,效率分别为36.7%和19.3%。Holkenbrink等[78]构建了EasyCloneYALI系统,利用CRISPR-Cas9技术可以将基因表达载体快速整合到特定的基因组位点,然后使用短双链寡核苷酸作为DNA修复模板可以同时敲除1~2 个基因,单个基因的敲除率为90%,双基因的敲除率为6%~66%。Gao Difeng等[79]还开发出一种双重CRISPR-Cas9策略,构建了两个整合型载体,各自含有一个Cas9表达框和sgRNA,两个载体上的sgRNA分别靶向目的基因的起始密码子上游区域和终止密码子下游区域,利用Cas9蛋白进行切割,可以将目的基因完整切除,效率约为20%。随后,该学者又构建了含有一个Cas9表达框和两个sgRNA的载体,并与含有敲入基因的载体进行共转化,整合效率约为15%~37%。Larroude等[80]使用Golden Gate方法构建了一套含有不同标记的CRISPR-Cas9系统,用于解脂耶氏酵母的基因组编辑。该系统中,Cas9蛋白使用不同的启动子控制,显著提高了基因编辑效率。Schwartz等[81]开发出一种可以量化sgRNA切割效率的方法,通过对sgRNA的功能进行高通量定量分析,鉴定出可以覆盖94%基因的高效sgRNA。与传统的基因编辑方法相比,CRISPR-Cas系统可以对野生型和工业菌株基因组进行快速编辑,并且可以进行多个基因的同时编辑。随着研究人员对CRISPR-Cas9系统的不断优化,以解脂耶氏酵母为底盘细胞进行代谢网络的重构将变得更加便捷和高效。
2.2 Cre-loxP系统
Cre-loxP系统源于P1噬菌体,由环化重组酶(cyclization recombination enzyme,Cre)和loxP位点两部分组成,可在基因组特定位点进行基因的敲入、敲除、移位和倒位等操作,目前已成功应用于对多种微生物的基因编辑。在解脂耶氏酵母中,Cre-loxP系统通常用于目的基因的敲除,如将携带拟敲除基因同源臂的loxP-Maker-loxP片段导入酵母细胞进行同源重组,Cre表达并识别loxP位点,继而将loxP位点间的标记基因切除。Fickers等[82]利用该方案,使目的基因敲除率达到45%,Cre表达以后标记基因的切除率可高达98%。但是,由于标记基因切除后基因组上会留下一个loxP位点,新导入的loxP位点与之前的loxP位点可能会发生错误剪切,因此该方案并不适用于对多个基因的连续敲除。为了解决这一问题,研究人员开发了一种新的Cre-loxP特异性重组系统(图2),通过构建loxP突变文库,筛选到反向序列有5 个碱基不同的Lox66和Lox71位点,在Lox66和Lox71位点进行剪切重组后会产生突变的Lox72位点并留在基因组上,Cre对该突变位点的识别能力大大降低,因此对后续基因敲除几乎没有影响[83-84]。但是,该连续敲除方案尚未在解脂耶氏酵母中得到应用,因此在解脂耶氏酵母中筛选突变的特异性LoxP位点并深入探究该方案在解脂耶氏酵母中的应用潜力,有望实现利用Cre-loxP系统对解脂耶氏酵母基因组进行连续、高效的遗传修饰。此外,解脂耶氏酵母染色体基因组上遗留的LoxP位点对其他基因的表达是否会造成影响,需要进一步探究。

图2 Cre-loxP系统介导的特异性重组Fig. 2 Specific recombination mediated by Cre-loxP system
2.3 Gateway技术
Gateway是由美国Invitrogen公司开发的一种基因克隆操作技术,近年来被广泛应用于各种表达系统的构建。该技术首先将目的基因克隆到供体载体上,然后依靠载体上特定的att重组位点和重组酶,快速、高效地将目的基因克隆到目的载体上(图3)。该技术可以缩短亚克隆操作时间,并且可以将目的基因快捷地克隆至多个不同的表达系统,如细菌、酵母、昆虫或哺乳动物等。Gateway技术已成功应用于解脂耶氏酵母表达系统的构建,如Leplat等[85]利用Gateway载体将URA3标记、pTEF1启动子、LIP2t终止子和zeta序列组成的表达盒整合到解脂耶氏酵母基因组中,通过在96 孔板中应用高通量转化的方法获得了过表达碱性胞外蛋白酶的突变体文库。另外,作者还使用该技术构建了150多个过表达单个转录因子的菌株,以识别参与脂质代谢的调节因子[86]。Dulermo等[45]利用Gateway技术构建了表达载体并转入解脂耶氏酵母中,然后通过更换不同的启动子验证荧光蛋白RedStar2、葡萄糖淀粉酶和木聚糖酶C的表达程度。尽管从严格意义上来说,Gateway技术不属于高通量整合方法,但是由于其克隆效率可高达95%并且具有将单个目的基因同时克隆至多个不同载体的优势,因此可实现目标重组载体的快速构建和外源基因的快速表达。目前,该技术也已在解脂耶氏酵母中得到了广泛使用,应用前景极为广阔。

图3 Gateway技术的工作原理Fig. 3 General working principle of the Gateway technology
3 代谢工程改造解脂耶氏酵母生产高附加值产品应用实例
解脂耶氏酵母作为一种产油酵母,其胞内脂质积累量极高,因此是脂质生产的优良菌种。此外,其蛋白酶和脂肪酶的分泌能力较强,因此也是蛋白质生产中最有潜力的微生物[39]。本节主要对近年来以解脂耶氏酵母为细胞工厂生产蛋白质、脂质和其他高附加值非天然产物的应用实例进行了总结。
3.1 蛋白质
异源蛋白的生产是非常有研究意义的领域,具有较高的学术和商业应用价值。最初一般利用大肠杆菌来进行异源蛋白的生产,但是由于大肠杆菌表达的蛋白质容易错误折叠形成包涵体、复杂蛋白质需求量不断增加以及酵母转化系统迅速发展,基于酵母的蛋白表达系统展现出了更多优势。然而酿酒酵母作为最常用的蛋白质生产菌株也存在一定缺陷,比如糖基化程度高、蛋白质产率和分泌水平较低等。解脂耶氏酵母在这些方面都存在优势,且几种内源蛋白质(如碱性胞外蛋白酶、酸性胞外蛋白酶、脂肪酶和磷酸酶等)的分泌水平较高。XPR2基因在蛋白胨的诱导下表达,可分泌大量的碱性胞外蛋白酶(1~2 g/L)[5]。因此,碱性胞外蛋白酶成为了蛋白质分泌研究的模型,该基因的启动子也成为了重要的分子生物学工具,在解脂耶氏酵母异源蛋白生产中具有重要作用。
真核生物细胞中蛋白质种类成千上万,且可以在细胞的各个区域内发挥作用,因此必然存在不同的机制确保蛋白质转运,主要包括共翻译转运和翻译后转运两种。研究表明翻译后转运途径在酿酒酵母细胞中占主导地位,而在解脂耶氏酵母细胞中共翻译转运途径比翻译后转运途径更具优势[87],这也是解脂耶氏酵母可以高效生产复杂外源蛋白的另一个重要原因。
早在1991年,Buckholz等[88]便列举出了利用解脂耶氏酵母生产的5 种异源蛋白。近年来,以解脂耶氏酵母作为宿主菌生产的异源蛋白种类不断扩大,活性和产量也不断增加,到目前为止,利用解脂耶氏酵母作为细胞工厂已经生产出150多种重组蛋白。
3.2 脂质
近年来,研究人员通过不同的工程策略大大提高了解脂耶氏酵母中脂质的生产量。其中,敲除脂质降解途径的相关基因是脂质积累的常用策略。例如,MFE2基因的敲除使脂质的积累量明显增加[89];过氧化物酶体生成蛋白基因PEX3、PEX10和PEX11的敲除完全抑制了β-氧化,也使得脂质的积累量明显增加[13,90]。此外,代谢调控因子SNF1的敲除也会对脂质的积累有非常明显的影响。例如,敲除了SNF1的解脂耶氏酵母工程菌株脂肪酸的积累量比野生型高2.6 倍,此外,对生产EPA的菌株中敲除SNF1后,EPA的产率提高了52%,占细胞干质量的7.6%[91]。
此外还可通过利用低成本原料底物来进行脂质的生产,如以甘油为底物脂质产率可达43%(以细胞干质量计,后同)[92],以甘蔗渣水解液为原料产率可达58.5%[93]。Niehus等[94]通过过表达外源基因构建了解脂耶氏酵母工程菌株,以木糖为碳源,最终脂质产率达到67%。研究人员通过工程改造甘油-3-磷酸穿梭途径增加甘油-3-磷酸的含量,然后通过弱化β-氧化途径增加三酰甘油和游离脂肪酸含量,使最终脂质产率高达65%~75%[95]。
3.3 其他高附加值非天然产物
解脂耶氏酵母除了是生产蛋白质和脂质的重要宿主菌外,还可用于各种高附加值非天然产物的生产,如生物材料、生物燃料、生物化学品、香料和药物等。本文举例介绍了利用合成生物学技术以解脂耶氏酵母为底盘所生产的一些比较有代表性的高附加值产物。
3.3.1 多不饱和脂肪酸
多不饱和脂肪酸是指碳链长度在18~22 个碳原子之间并且含有两个或两个以上双键的直链脂肪酸,经常被用作食品和饲料添加剂,近年来,已经利用解脂耶氏酵母对多种人体必需的多不饱和脂肪酸进行了生产,如γ-亚麻酸(gamma linolenic acid,GLA)、EPA等。Sun Meili等[96]在强启动子php4d的控制下,将经过密码子优化的高山被孢霉Δ6-脱氢酶引入解脂耶氏酵母基因组,最终在生物反应器中获得71.6 mg/L的GLA。EPA可以改善心血管问题,研究人员将Δ12-脱氢酶基因、Δ9-脱氢酶基因和C16延长酶基因插入解脂耶氏酵母LEU2基因座,然后表达了Δ5、Δ8和Δ17脱氢酶,并敲除了PEX10、LIP1和SCP2基因,使得EPA产量达到细胞干质量的15%,占总脂质含量的56.6%[13]。
3.3.2 类胡萝卜素
类胡萝卜素一般用于制造食品、药品、化妆品和饲料添加剂等。目前已知的类胡萝卜素达到600多种,它们都是以类异戊二烯途径中八氢番茄红素作为中间体产生的,如β-胡萝卜素、番茄红素和虾青素等。β-胡萝卜素是一种自然界中普遍存在的天然色素,Larroude等[97]开发了可以生产β-胡萝卜素的解脂耶氏酵母工程菌株,其使用Golden Gate技术筛选β-胡萝卜素途径中基因和启动子的最佳组合,再经过补料分批发酵,最终β-胡萝卜素产量达到6.5 g/L(90 mg/gmd),同时产生了42.6 g/L的脂质。番茄红素是存在于植物中的一种深红色针状结晶的类胡萝卜素,对心脏和血管等功能的改善有明显益处[98]。Schwartz等[99]利用合成生物学的方法构建了番茄红素生产菌株,然后在生物反应器中通过补料分批发酵使番茄红素产量达到21.1 mg/gmd。虾青素是一种于水生生物体内发现的红色类胡萝卜素,具有极强的抗氧化性,在医药、食品和化妆品等行业被广泛应用。Kildegaard等[100]构建了工程化解脂耶氏酵母以生产虾青素,所得虾青素产量为(10.4±0.5)mg/L,在优化了crtZ和crtW的拷贝数后于微量滴定板上培养,最终虾青素产量达到了54.6 mg/L。
3.3.3 类异戊二烯
α-法尼烯又称为金合欢烯,是最简单的倍半萜烯之一,在医药等行业应用前景较为广阔。Liu Yinhang等[101]将经过密码子优化的α-法尼烯合酶基因整合到解脂耶氏酵母基因组上,然后又通过过表达甲羟戊酸(mevalonate,MVA)途径相关基因,优化发酵条件,使α-法尼烯产量达到了25.55 g/L,这是迄今为止解脂耶氏酵母生产萜烯类化合物产量最高的报道。
柠檬烯也是一种重要的单萜类化合物,是许多香料和药物的前体化合物。Pang Yaru等[25]在解脂耶氏酵母中以MVA途径为基础构建了一条L/D-柠檬烯代谢途径,经过发酵条件的优化,L/D-柠檬烯产量分别达到11.705 mg/L(得率0.443 mg/g)和11.088 mg/L(得率0.385 mg/g)。然后该学者又以厨房废油(waste cooking oils,WCO)作为唯一碳源进行发酵,柠檬烯产量最终达到了以葡萄糖为碳源产量的70%,这为以解脂耶氏酵母作为细胞工厂、WCO为底物生产高附加值产品提供了可行的方案,在废物转化方面带来重大突破。Cheng Boqian等[102]除了引入柠檬烯合成途径外还探究了不同碳源对柠檬烯产量的影响,结果发现以甘油为碳源、柠檬酸为辅助碳源的组合最佳。在此基础上通过补料分批发酵,使柠檬烯产量最终达到了165.3 mg/L,这也是迄今为止利用解脂耶氏酵母生产柠檬烯产量最高的报道。
表3对解脂耶氏酵母生产的部分具有代表性的外源蛋白、脂质和其他高附加值非天然产物进行了列举。
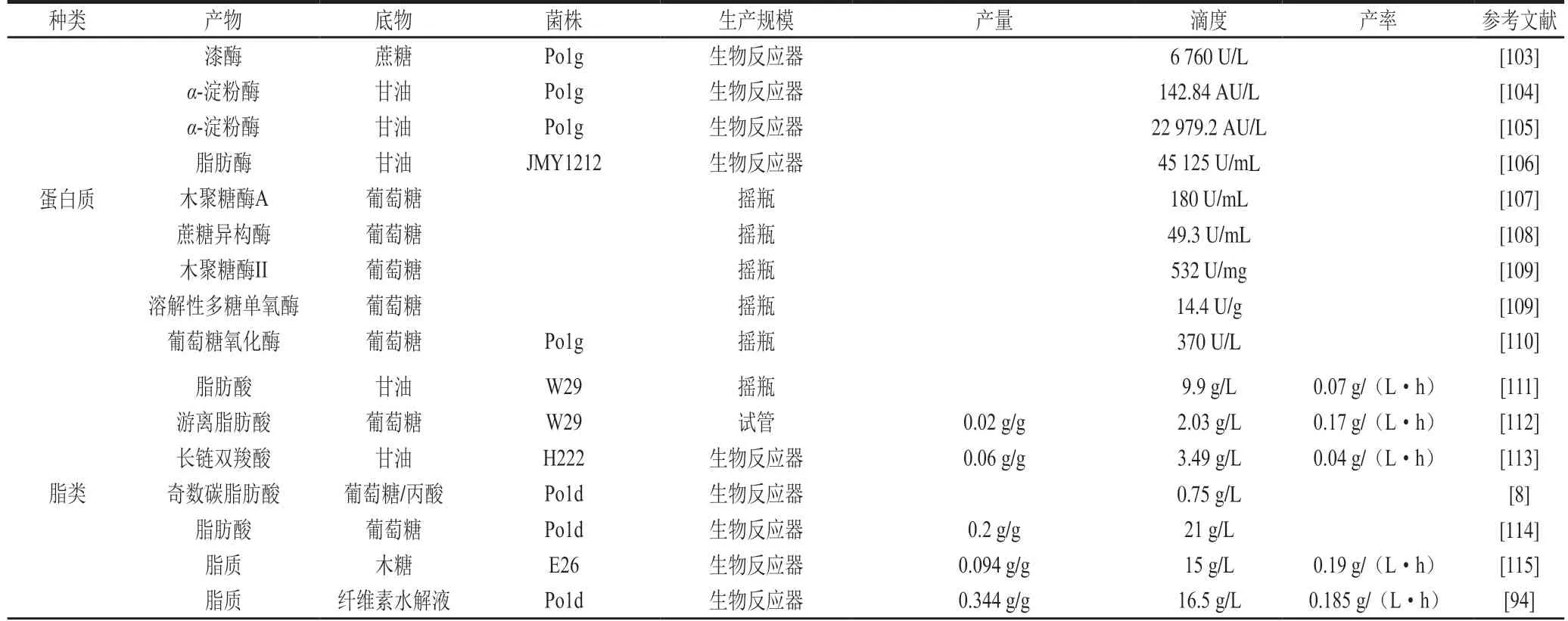
表3 解脂耶氏酵母中生产高附加值产品实例Table3 Representative examples of high-value products produced by engineered Y. lipolytica

续表3
4 结 语
自解脂耶氏酵母被发现之日起便引起了研究人员的格外关注,随后研究人员就开始对其进行了广泛而深入的研究,包括形态特征、生理生化特性、遗传特点及代谢调控等。本文主要总结了解脂耶氏酵母中常用的合成生物学元件和基因编辑方法。其中,启动子是生物合成途径中启动和协调基因转录的关键因素,终止子在终止转录和调节mRNA半衰期方面有着不可替代的作用,启动子和终止子都是合成生物学研究中最重要的基本元件。之前的工作主要集中在对解脂耶氏酵母启动子元件的开发和应用,即通过随机突变或理性设计来创建启动子文库进行研究[51-54]。近年来,终止子的开发和应用也成为了研究热点[63-66],下一步工作的重点应该是构建序列更短、功能更强、转录活性范围更广的启动子,同时应探究解脂耶氏酵母中启动子和终止子工程的联合开发与应用,并在此基础上构建适用于解脂耶氏酵母宿主菌的超级表达载体,以实现目的基因更加高效的表达。随着合成生物学和基因编辑技术的快速发展,CRISPR-Cas、Cre-loxP和Gateway等基因编辑技术以简便、高效、特异性强等优势实现了对解脂耶氏酵母基因组的快速编辑,加快了工程菌株的开发进程,因此被研究人员广泛采用。但是对多基因的同时编辑仍存在效率不高和脱靶等问题[78-79],下一步研究重点应集中在提高多基因编辑效率上,实现多基因同时、快速且高效的编辑将会对解脂耶氏酵母合成生物学的快速发展做出重大贡献。尽管近年来解脂耶氏酵母在蛋白质、脂质和非天然产物的生产上展现出更多优势,但是成本问题依然是困扰科学研究的难题。针对这个问题,已有研究人员使用价格低廉的糖蜜、厨房废油和乳清等工业副产物为底物来进行解脂耶氏酵母的发酵生产,以降低工业化成本[25,139-140],通过构建环境友好型微生物细胞工厂来进行废物转化也将是解脂耶氏酵母合成生物学发展的重要研究方向。
