禽蛋源生物活性肽的研究进展
2021-10-31蔡朝霞刘亚平金永国
曾 齐,蔡朝霞,刘亚平,金永国
(华中农业大学食品科技学院,国家蛋品加工技术研发分中心,湖北 武汉 430070)
禽蛋是功能蛋白质和生物活性蛋白质的丰富来源。蛋清中含有卵白蛋白、卵转铁蛋白、卵黏蛋白、卵类黏蛋白、溶菌酶、卵巨球蛋白、核黄素结合蛋白等多种活性蛋白质[1],而蛋黄中则含有卵黄球蛋白、卵黄高磷蛋白、低密度脂蛋白、高密度脂蛋白等功能性蛋白质。此外,从蛋壳和蛋壳膜中也可以获得一些具有生物活性的蛋白质。这些蛋白质是制备生物活性肽的潜在前体物质[2-3]。作为一种重要的膳食蛋白质,它提供了各种超出正常营养价值的生理益处,这归功于在人体胃肠道蛋白质消化过程中所产的多肽[4-5]。禽蛋多肽已被认为是一类很有前景的保健食品和功能性食品组分,除了提供能量和必需氨基酸,还对人体具有多种生物活性和促进健康作用[6]。
生物活性肽通常含有2~50 个氨基酸残基,它们作为蛋白质中某些结构域的组分而具有生物活性。但是,很多活性肽段存在于蛋白质结构内部,被认为是隐蔽状态的,很难发挥相应活性,一旦在酶消化或食品加工过程中释放出来,就可以作为活性化合物发挥作用。它们可以由较长的多肽或蛋白质通过不同的处理手段(如酶解、化学水解、微生物发酵、化学合成等)来制备。动物胃肠道和来自植物和微生物的非胃肠道蛋白酶常被用来水解蛋白质,以释放在亲本蛋白质一级结构中隐蔽的肽序列。而非胃肠道蛋白酶因具有不同的水解特异性,往往可获得生物效价更高的生物活性肽[7]。通常采用超滤或色谱分级对水解产物中最有效的组分进行富集[8]。大量的研究只集中在特定的生物活性肽上,而不是整个水解物上。然而,从生理功能调节的相关性来看,完整水解产物可能比鉴定的单一肽具有更大的效用,因为生物学效应往往是复杂的,会需要更多的活性组分参与。越来越多的科学证据表明,禽蛋源生物活性肽具有抗氧化、降血压、抗菌、抗病毒、抗癌、抗糖尿病、抗炎、金属离子结合与转运、免疫调节、改善骨骼健康等多种功能。除了生物活性,目前有关多肽的研究重点在于胃肠道的生理稳定性以及肠道吸收与转运,以探究生物活性肽的生物利用率[9]。由于具有促进健康的潜力以及相对较低的安全风险,禽蛋源生物活性肽将会持续引起人们的极大兴趣和关注。本文综述了禽蛋源生物活性肽的制备、鉴定、功能活性及胃肠道消化吸收与转运方面的研究进展,以期为后续的深入研究与应用开发提供一定的参考。
1 禽蛋源生物活性肽的制备
目前,已有酶解法、化学水解法、微生物发酵法和化学合成法用于制备目标多肽,其中酶解法应用最为广泛,而在基础研究方面,化学合成法是未来的发展趋势[10-14]。禽蛋蛋白质经过水解得到的多肽种类繁多,为了达到预期的目的,必须对水解液进一步的分离纯化。现在常用的多肽分离纯化的方法有凝胶过滤色谱法、离子交换色谱法、反相色谱法、超滤法、电泳法、固定化金属亲和层析法等,有很多的研究应用多种方法结合的方式来达到更好的分离效果。
1.1 酶解法
目前,酶水解是从禽蛋中制备生物活性肽的主要方法。许多模拟禽蛋胃肠道消化的研究表明,胃肠道酶在水解卵转铁蛋白、卵黏蛋白、卵白蛋白等禽蛋蛋白质方面效率并不高。植物或微生物来源的蛋白酶(如嗜热菌蛋白酶、碱性蛋白酶、中性酶等)具有比胃肠道酶更丰富的切割位点,因而这些非胃肠道蛋白酶也陆续被用来从禽蛋蛋白质中获得更多种类的生物活性肽。最近,一些主要的蛋清蛋白质(卵白蛋白、类卵黏蛋白和卵黏蛋白)在37 ℃下使用多种酶(胰蛋白酶、胃蛋白酶、糜蛋白酶、木瓜蛋白酶和碱性蛋白酶)组合进行水解可产生多种生物活性肽[15-17]。卵类黏蛋白经碱性蛋白酶和胰蛋白酶处理后得到的水解肽具有多种生物活性,包括抗氧化、金属离子螯合和血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制活性[16]。除酶种类的影响外,采用预处理技术(如超声波、脉冲电场、高静水压力)和烹调方法(如蒸煮、油炸)也能促进禽蛋蛋白质酶解产生生物活性肽。禽蛋蛋白质水解前通过适当热处理可使蛋白质变性,并暴露更多的蛋白质切割位点,从而使蛋白质更容易被蛋白酶水解和产生更高的水解效率[18]。油炸全蛋的肠道消化液显示出很强的体外ACE抑制活性,并且在连续18 d口服1 000 mg/kgmb后,自发性高血压大鼠(spontaneous hypertension rats,SHRs)的收缩压从191.4 mmHg下降到172.1 mmHg[19]。除了加热,Majumder等还比较了超声波和还原剂辅助下嗜热菌蛋白酶处理的禽蛋蛋白质水解物对ACE活性的影响。结果表明,两者均进一步促进了ACE抑制肽的产生[20]。此外,在胃蛋白酶和糜蛋白酶的作用下,采用高静水压力有助于卵白蛋白水解产生生物活性肽,特别是能够促进多种降血压肽的释放[21]。已报道的大多数多肽制备方法在实验室规模下都是有效的,但技术的不适用性和高昂的纯化技术成本限制了多肽的大规模生产[22]。值得注意的是,当前已初步建立了嗜热菌蛋白酶和胃蛋白酶处理的全蛋清水解物的大规模生产,所得水解物的降血压效果已在SHRs中得到验证[23-24]。与传统的水解技术相比,生物活性肽的生产逐渐采用了一些新型连续水解手段,如使用固定化酶和酶膜反应器(enzymatic membrane reactor,EMR)[25-26]。酶固定化是指将酶定位在特定基底材料上以保持其长期催化能力,其可重复使用性且反应可控[27]。EMR由于具有酶和过程稳定性、酶的可重用性、催化效率和产品回收率高等优势,已被广泛开发用于生产生物活性肽[28-29]。Wu Shufen等通过EMR和色谱法联用的方式实现了多功能肽的连续水解和分离,且发现比传统的间歇反应器更有效,实验过程中以酪蛋白为原料,采用EMR、分子排阻色谱和阳离子交换色谱法同时制备了3 种生物活性肽,即ACE抑制肽、酪蛋白磷酸肽和抗菌肽[30]。
1.2 化学水解法
酸水解、碱水解和其他化学试剂也常被用来从蛋白质中制备生物活性肽。卵黄高磷蛋白是一种高度磷酸化的蛋白质,具有很强的抗氧化和金属结合活性,但它对蛋白酶的超强抵抗力限制了其作为生物活性肽的来源[31]。Samaraweera等探索了利用碱和酸水解手段从卵黄高磷蛋白中制备多肽的可能性,并研究了所得多肽的功能活性。结果表明,HCl或NaOH可使卵黄高磷蛋白水解程度增加,但均对水解产物的抗氧化能力和铁螯合能力产生负面影响,而对Cu2+螯合能力有明显提高[32]。特别地,相比木瓜蛋白酶或碱性蛋白酶处理,卵黏蛋白碱性条件下于100 ℃加热15 min产生的多肽具有更高的Fe2+结合能力和抗氧化活性[33]。人们还研究了亚临界水水解方法以从包括禽蛋蛋白质在内的食品蛋白质中制备生物活性肽。亚临界水提取法具有成本低、反应时间短、无需使用溶剂和酶、对环境友好等优点。以脱脂蛋黄颗粒蛋白质为原料,采用胰蛋白质酶和亚临界水提取法对脱脂蛋黄颗粒蛋白质进行水解。研究发现,用胰蛋白质酶水解360 min,水解物中蛋白质量分数可达50%,而采用亚临界水提取,反应时间明显缩短,得率提高到95%。胰蛋白质酶水解物和亚临界水解物中的低分子质量多肽(<1 kDa)分别占14%和63%[34]。亚临界水水解最大的问题是它在蛋白质中裂解肽键的非特异性,这种方法也会导致非常有限的二硫键断裂。因此,可能需要在亚临界水处理之前或之后对蛋白质进行还原和烷基化,以改善已报道的蛋白质序列的覆盖率[35-36]。总的来说,与酶水解相比,化学水解过程更难控制,而且可能从L-氨基酸中产生各种不需要的次级化合物[32]。此外,化学水解的最终产物含有更多的盐,且一些功能特性(如水溶性、吸湿性)不尽如人意[37]。这些问题限制了化学水解在生物活性肽制备中的应用。
1.3 微生物发酵法
除了水解之外,通过微生物酶系统发酵也是一种很有前景的制备生物活性肽的方法,特别是利用废弃的蛋白质源进行发酵[38]。在发酵过程中,枯草芽孢杆菌、乳酸菌和真菌能够释放大量的二肽、三肽和其他生物活性肽[39-40]。一般来说,在乳酸菌发酵过程中,禽蛋的蛋白质和游离氨基酸的组成和含量均会发生较大的变化[41]。Li Sen等[42]为了确定乳酸菌发酵是否会降低蛋清的免疫球蛋白(immunoglobulin,Ig)E结合能力,选择桑氏乳杆菌、清酒乳杆菌和德氏乳杆菌分别对蛋清进行发酵,发现只有德氏乳杆菌组的IgE结合能力降低了50%。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测到蛋清发酵液没有明显的蛋白质降解。进一步研究发现,异硫氰酸荧光素标记的卵类黏蛋白在蛋清发酵后强度降低。基质辅助激光解吸电离-飞行时间-质谱(matrix-assisted laser desorption ionization-time of flightmass spectrometry, MALDI-TOF-MS)分析分子质量变化,发现含乙酰己糖胺的糖肽的峰强度发生了变化。这说明蛋清IgE结合能力的降低主要是由于卵类黏蛋白降解为糖肽,减弱了其过敏原性。Jain等以植物乳杆菌为菌种发酵禽蛋壳膜以制备功能性和生物活性蛋白质水解物;这些壳膜水解物具有明显的生物活性,如还原力、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力、ACE抑制活性以及对多种食源性致病菌生长的抑制作用;通过发酵蛋壳膜获得的蛋白质水解物可以加入到功能性食品和营养食品中,从而促进壳膜副产物的利用[43]。
1.4 化学合成法
随着对生物活性肽结构和功能的深入研究,许多研究表明,通过N-9-芴甲氧羰基(9-fluorenylmethyl,Fmoc)固相多肽合成法(solid phase peptide synthesis,SPPS)可以有目的地合成具有特定氨基酸序列的活性肽[44]。简而言之,SPPS首先将C-末端氨基酸固定在支撑的保护基团上,然后通过保护氨基酸的顺序偶联和洗脱来延长C-末端氨基酸的肽链[45]。ZhaoWenzhu等通过计算机模拟酶解和分子对接选取了蛋清中5 条肽段(ADF、MIR、FGR、FK和CDR),在Apex 396肽合成仪(美国AAPPTEC公司)上使用标准的Fmoc固相合成法合成了这些肽段,并用反相高效液相色谱联合电喷雾串联质谱(reverse phase-high performance liquid chromatographyelectrospray ionization-mass spectrometry,RP-HPLCESI-MS/MS)测定了合成肽的分子质量和纯度。通过体外实验证实肽段具有ACE和二肽基肽酶(dipeptidyl peptidase,DPP)-IV抑制活性[14]。Ding Long等也采用固相合成法获得了一条卵转铁蛋白源五肽(AVPSL),并通过RP-HPLC-MS/MS对五肽的序列和纯度进行了鉴定,后续细胞实验证明此多肽具有抗血压作用[46]。鉴于采用酶解法、化学水解法和微生物发酵法制备生物活性肽会伴随着耗时和高成本等问题,多肽化学合成法的应用将会越来越广泛。
2 生物活性肽的鉴定与表征
当蛋白质水解物经过分级纯化后,需要采用多种表征手段来获得多肽组分的分子质量、氨基酸组成、结构特征等信息。关于多肽的鉴定技术和方法主要有SDSPAGE法、RP-HPLC-MS/MS法[47]、四极杆飞行时间质谱法(quadrupole-time of flight-mass spectrometry,Q-TOF/MS)[48]、MALDI-TOF-MS[49]、同位素标记-液相色谱质谱联用法[50]、中红外光谱法、毛细管电泳-质谱法[51]等。Huang Xi等用串联质谱分析了高温常压(high temperature and moderate pressure,HTMP)预处理对卵黄高磷蛋白酶解的及产物的结构特征的影响。研究发现单独使用HTMP预处理可产生154 个肽,而胰蛋白酶、碱性蛋白酶和中性蛋白酶与HTMP联合使用则分别产生252、280 个和164 个肽。这表明HTMP预处理可以提高卵黄高磷蛋白的酶解效率,便于活性肽的制备[52]。Shen Shengwen等采用离子交换色谱和反相高效液相色谱对嗜热菌蛋白酶处理的卵转铁蛋白酶解液进行分离纯化,获得了14 条肽段。随后通过LC-MS/MS鉴定了这些肽段,并测定了它们的氧自由基清除能力(oxygen radical absorbance capacity,ORAC)[47]。蛋黄磷脂提取的副产物可作为抗氧化和ACE抑制活性肽的良好来源,有研究者利用酵母丝氨酸蛋白酶对蛋黄磷脂提取的副产物进行酶解,随后通过膜过滤、凝胶过滤层析、反相高效液相色谱、质谱等纯化和表征方法,得到了具有较强清除DPPH自由基和ACE抑制活性的十肽(QSLVSVPGMS)[53]。采用多种酶对卵白蛋白、卵类黏蛋白和卵黏蛋白进行水解,通过LC-Nano ESI-MS/MS对酶解液进行分析,表明每种水解物中含有数十至数百种多肽,且大多数多肽的分子质量均小于2 kDa。一般而言,含有短肽的水解物比含有长链肽的水解物具有更强的功能活性,但从水解物中提纯具有特定功能的单一肽似乎不太可行,甚至是没有意义的[15-16,33]。
3 生物活性肽的计算机辅助筛选
传统上,基于活性导向的分级是筛选和鉴定生物活性肽的主要方法,即通过前人的研究来选择食品级蛋白质酶对目标蛋白质进行水解,优先释放特定的生物活性肽。随后根据感兴趣的结构特征,用适当的多肽纯化手段对所得蛋白质水解物进行分级和纯化,可以得到具有生物活性和预期健康益处的高纯度多肽。这些活性肽的序列常可通过生物活性肽的网络开放获取数据库中查询到,例如BIOPEP和PepBank,以供研究员参考。简而言之,它涉及了一系列的过程,包括水解组分筛选、分离和纯化技术(如超滤和RP-HPLC)以及鉴定(如LC-MS/MS和核磁共振),这些都是低效和耗时的[54]。随着人们对生物活性肽的研究逐渐深入,基于定量构效关系(quantitative structure-activity relationship,QSAR)辅助的计算机模拟酶解方式在生物活性肽的筛选上得到了探索。该方法首先从国家生物技术信息中心(the National Center for Biotechnology Information,NCBI)和UniProt知识库(UniProtKB)等数据库中获取蛋白质序列,然后利用生物信息学软件BIOPEP和ExPASy PeptideCutter对蛋白质水解过程进行了计算机模拟。随后,收集计算机模拟的多肽片段,并基于QSAR模型预测它们的活性。虽然QSAR建模识别的多肽也需要验证其活性,但生物信息学方法优化了生物活性肽的蛋白质源的筛选,并节省了寻找有效生物活性肽所需的大量时间和成本[55]。关于发掘生物活性肽的经典方法和生物信息学方法如图1所示。

图1 用于发掘生物活性肽的经典方法和生物信息学方法示意图Fig. 1 Classical and bioinformatics approaches for discovering bioactive peptides
QSAR建模方法已经成功地应用于从禽蛋蛋白质中筛选ACE抑制肽,并制备了3 种有效的ACE抑制肽,即IRW、IQW和LKP[55]。Wang Xiong等借助Peptide cutter软件,以胃蛋白酶和胰蛋白酶模拟卵转铁蛋白的酶切过程,获得了多条二肽序列,并合成了18 条纯度达98%的二肽,随后通过抗炎实验验证了其中5 条肽段有较好的抗炎效果[56]。Salim等从NCBI数据库中获得卵白蛋白序列,然后在peptide cutter软件的辅助下使用不同的单一酶或组合酶进行计算机模拟酶解,共产生71 条肽段。根据氨基酸组成序列以及多肽与ACE、DPP-4的相互作用来预测肽段的生物活性,共筛选出10 条有潜在活性的肽段。体外验证实验结果表明,筛选出的多肽均能抑制ACE和DPP-4的活性[57]。类似地,Zhao Wenzhu等选择了禽蛋中8 种蛋白质(卵转铁蛋白、类卵黏蛋白、溶菌酶、卵巨球蛋白、抗生物素蛋白、卵黄高磷蛋白、卵白蛋白和肌球蛋白-10)进行计算机模拟酶解,并通过分子对接预测了肽段对ACE和DPP-IV的抑制活性。之后采用固相合成法合成了有潜在活性的5 条肽段,并进行体外实验,结果发现5 条肽段均对ACE有抑制活性,而有4 条肽段可抑制DPPIV活性[14]。然而,考虑到蛋白酶与蛋白质相互作用的复杂性,并不能保证采用计算机模拟手段所得多肽可以在实验中得到活性验证。
4 禽蛋源生物活性肽功能活性及相关作用机制
4.1 抗氧化活性
食品蛋白质源生物活性肽是一类具有潜在抗氧化活性的天然化合物。虽然潜在的机制还不完全清楚,但螯合金属离子和直接清除自由基作用是关键所在[58]。在禽蛋蛋白质中,卵白蛋白、卵转铁蛋白、溶菌酶、卵黄高磷蛋白、卵抑制剂等均被报道具有抗氧化特性,且它们经酶水解后也会产生具有抗氧化活性的多肽[59-60]。酶的种类对抗氧化肽的释放有着显著影响,碱性蛋白酶、胰蛋白酶、胃蛋白酶、胰蛋白酶和嗜热菌蛋白酶是用于在细胞或动物实验中产生抗氧化活性多肽的酶。虽然嗜热菌蛋白酶和胃蛋白酶都能产生抗氧化肽,但嗜热菌蛋白酶似乎是一种更能促进释放蛋清抗氧化肽的酶。鉴于一些芳香族氨基酸(Tyr、Trp、Phe)和疏水性氨基酸(Ala、Val、Leu、Ile)等在体外都显示出抗氧化活性,那么氨基酸组成、序列以及分子质量对蛋白质源多肽的抗氧化能力起着至关重要的作用[61]。此外,通过糜蛋白酶和胃蛋白酶组合水解蛋清,采用响应曲面法优化水解条件,所得水解物用氧化损伤模型和IgE结合能力实验进行评价,发现所得多肽具有高抗氧化活性和较低的致敏性[62]。Lin Songyi等以蛋清蛋白粉为主要原料,分别用碱性蛋白酶、胰蛋白酶和胃蛋白酶水解制备抗氧化肽。随后采用高场强脉冲电场对抗氧化肽进行处理,发现经高场强脉冲电场处理的抗氧化肽比未处理组有更强的抗氧化能力[63]。Zhang Biying等采用超滤和Sephadex G-15柱层析对蛋清水解物进行纯化和表征,鉴定出了4 种抗氧化多肽(VYLPR、EVYLPR、VEVYLPR和VVEVYLPR),其中VYLPR抗氧化活性最高。他们进一步进行抗氧化机制探讨,发现VYLPR能抑制脂质过氧化过程,保持细胞膜完整性,抑制细胞内乳酸脱氢酶(lactate dehydrogenase,LDH)活性,降低丙二醛(malondialdehyde,MDA)含量,提高总超氧化物岐化酶(total superoxide dismutase,T-SOD)和谷胱甘肽氧化物酶(glutathione peroxidase,GSH-Px)活性[64]。Xue Hui等对孵化第6天的胚蛋进行水解和超滤分离,获得了不同分子质量范围的多肽组分,并通过DPPH自由基清除活性、羟自由基清除活性、超氧阴离子自由基清除活性、总抗氧化能力和还原力实验考察了它们的抗氧化活性[65]。开发新型蛋白酶也有利于获取更多种类的抗氧化肽,Hamin等从爪哇正青霉和嗜热菌中分离出两种新的真菌蛋白酶,对鸡蛋和牛奶蛋白质进行水解,也获得了具有DPPH自由基清除能力和金属螯合能力的抗氧化肽[66]。Zhang Deju等研究了卵黏蛋白胃蛋白酶水解产物五肽及其片段对细胞抗氧化酶活性的影响,发现不同多肽的组合具有协同抗氧化作用,且在一定程度上表现出剂量依赖性。在细胞水平上,与过氧化物暴露组相比,多肽处理组的SOD、GSH-Px、过氧化氢酶活性较高,而MDA、LDH释放水平较低[67]。Wang Jiapei等将煮熟的鸡蛋在胃肠消化的体外模拟模型中进行消化。所得的消化物用液相色谱进行分级,并以血管平滑肌细胞(A7r5)为模型,测定了各肽段组分的体内抗氧化活性。随后从具有最高抗氧化活性的肽组分中进一步鉴定出了3 条源于卵白蛋白的肽段(DSTRTQ、DVYSF和ESKPV),并通过合成肽段验证了它们在A7r5细胞中可降低ROS水平[68]。Carrillo等从胃蛋白酶处理的溶菌酶水解物中鉴定到5 条带正电荷的多肽,采用ORAC实验证实它们均表现出抗氧化活性。在斑马鱼实验模型中,通过测定硫代巴比妥酸反应物值,发现这5 种肽均能有效抑制脂质过氧化,但当多肽质量浓度高于50 μg/mL时会对斑马鱼产生细胞毒性[69]。另外,当前发现的卵转铁蛋白源抗氧化肽在内皮细胞中具有ORAC活性,但这些肽都没有降低细胞中超氧化物的基础水平及细胞因子诱导的超氧化物水平[70]。这一发现进一步强调了在评价抗氧化肽的抗氧化能力时,有必要使用更多与生理相关的评价指标。
4.2 降血压和ACE抑制活性
食品蛋白质源降血压肽得到了研究者的极大关注,不同的食物蛋白质中已经鉴定了各种降血压肽[71]。作为生物活性肽的一大类,降血压肽的研究已从鉴定拓展到机制、临床试验和商业化。禽蛋作为一种丰富的蛋白质来源,一直是鉴定降血压肽的热门研究对象。由于ACE抑制剂是治疗高血压的一线药物,从禽蛋蛋白质中鉴定降压肽通常是从体外ACE抑制实验开始的,这使得鉴定出的多肽被称为ACE抑制肽。近些年来,许多ACE抑制肽被从禽蛋中鉴定出来,它们大多来自蛋清蛋白质,如卵白蛋白、卵转铁蛋白和溶菌酶。在制备ACE抑制肽时,尽管水解参数可能会不同,但酶种类在确定禽蛋蛋白质水解物的ACE抑制潜力方面发挥着重要作用[72]。与禽蛋水解物类似,这些ACE抑制肽(如LW、IVF、YAEERYPIL和FRADHPFL)通常由胃肠道酶产生,有些ACE抑制肽(如IRW、IQW和LKP)需要胃肠道酶辅助制备[73-74]。IRW、IQW和LKP是已报道的具有多种生物活性的ACE抑制肽,它们是由卵转铁蛋白经嗜热菌蛋白酶和胃蛋白酶水解后产生的,这些三肽的产生高度依赖于嗜热菌蛋白酶对卵转铁蛋白的预处理[75-76]。Khueychai等将卵白蛋白在40 ℃下进行碱水解,在水解8 h时观察到水解产物具有最佳ACE抑制活性,通过RP-HPLC纯化水解产物获得肽段YV。使用Lineweaver-Burk图分析,YV被确定为竞争性抑制剂。分子对接分析表明,YV与ACE的S1和S2口袋位点之间的结合主要通过氢键稳定。YV在胃肠道消化后仍保持ACE抑制活性,对红细胞、角质形成细胞(HaCaT)和肺成纤维细胞(MRC-5)没有细胞毒性。肠道吸收的体外模型表明,YV具有很高的Caco-2细胞单层模型吸收潜力[77]。Fan Hongbin等从嗜热菌蛋白酶处理的蛋清水解液中筛选出6 种能被胃肠道消化的ACE抑制肽,即LAPYK、LKISQ、LKYAT、INKVVR、LFLIKH和LGHWVY,这进一步证明了蛋清肽作为功能食品配料应用的潜力[78]。源于卵白蛋白的活性肽QIGLF已被体外表征为有效的ACE抑制剂。通过尾袖法评估口服QIGLF对SHRs的体内降压作用,发现单次口服后,SHRs的收缩压明显降低,且QIGLF(50 mg/kgmb)与降血压药物卡托普利(10 mg/kgmb)的作用效果相似[79]。然而,卵白蛋白衍生肽ERKIKVYL和FFGRCVSP在体外有较强的ACE抑制活性,而在SHRs中没有任何降血压作用[80]。因此,基于体外ACE抑制实验鉴定的ACE抑制肽也需要进一步证实其在体内的有效性。
于是,人们逐渐发现这些降压肽的机制实际上超出了ACE抑制的范畴。IRW是源于蛋清卵转铁蛋白的ACE抑制肽,研究发现它可以通过多种途径降低SHRs的血压,包括减少血管紧张素II(angiotensin II,Ang II)的循环,增强NO介导的血管舒张,改善内皮炎症和氧化应激以及上调ACE2活性[19,71,76]。此外,IRW可以减弱因Ang II作用所引起血管平滑肌细胞的增殖、氧化应激和炎症,这表明其通过减缓血管重构来降低血压[81]。由Ang II诱导的血管平滑肌细胞迁移也是高血压发病的机制之一。Liao Wang等评价了IRW在Ang II诱导的血管平滑肌细胞系A7r5细胞中的抗迁移活性。研究发现,IRW可下调基质金属肽酶9的表达,抑制Ang II诱导的A7r5细胞迁移,这与p38/丝裂原活化蛋白激酶(p38/mitogenactivated protein kinase,p38/MAPK)信号转导失活有关。更重要的是,IRW的抗迁移活性依赖于血管紧张素I型受体(angiotensin I receptor,AT1R)[82]。RVPSL也来自于蛋清卵转铁蛋白,已被证明可通过调节肾素、ACE、AT1R和AT2R等血管紧张素系统组成部分的mRNA水平来降低SHR的血压[83]。有研究者探讨了嗜热菌蛋白酶和胃蛋白酶水解的蛋清多肽对SHRs降压作用的分子机制。主动脉ACE和AT1R表达下调,AT2R表达上调,参与了降压机制[23]。因此,虽然禽蛋中已鉴定出丰富的ACE抑制肽,但这些多肽的作用机制可能并不局限于对ACE活性的抑制,还可以调节参与高血压发生和发展的相关分子的表达,最终导致血压下降。目前已报道的降血压作用机制如图2所示。
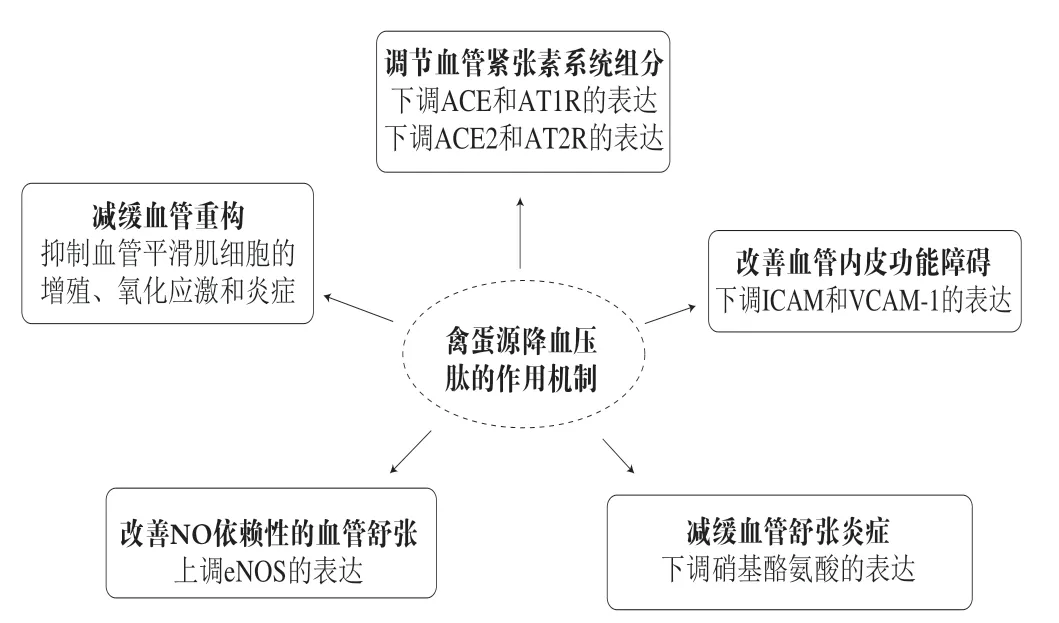
图2 禽蛋源降血压肽的作用机制Fig. 2 Antihypertensive mechanisms of egg-derived peptides
4.3 抗菌活性
禽蛋中有着丰富的抗菌蛋白质,且这些蛋白质水解产生的多肽也表现出较强的抗菌活性。早有研究者通过酸水解技术从卵转铁蛋白中纯化出抗菌肽OTAP-92,该肽由92 个残基组成,具有与昆虫防御素相似的独特结构基序。这种抗菌肽能够通过自我促进吸收导致细菌外膜渗透性改变,并对其生物功能造成损害,从而杀死革兰氏阴性菌[84]。卵黏蛋白是一种从蛋清中提取的糖蛋白,具有潜在的抗黏附性。用酸性蛋白酶制备的卵黏蛋白水解物对两株猪K88产肠毒素大肠杆菌具有抗凝集活性。将水解物纯化后,共鉴定出6 种具有抗黏附活性的糖肽。通过结构表征,这些肽具有1 个由双乙酰氨基葡萄糖、3 个甘露糖残基和1 个N-乙酰氨基葡萄糖组成的戊多糖中心结构[85]。溶菌酶可有效抑制革兰氏阳性菌增殖,同时一些研究通过额外的化学修饰来扩大其对特定革兰氏阴性菌的损伤作用[86]。酶水解过程也能够使溶菌酶释放有效的抗菌肽,经胃蛋白酶和胰蛋白酶水解的溶菌酶对革兰氏阳性菌(如金黄色葡萄球菌)和革兰氏阴性菌(如大肠杆菌K-12)均有抑菌活性。从水解液中分离纯化出的两种抑菌肽IVSAGAGMAAT和HGLAATA,它们可分别抑制大肠杆菌K-12和金黄色葡萄球菌增殖。这些抗菌肽将溶菌酶的抗菌活性扩大到了革兰氏阴性菌上[87]。Carrillo等采用RP-HPLC-ESI-MS/MS从经胃蛋白酶水解的天然和加热处理蛋清溶菌酶水解物中鉴定到51 条肽段,它们对大肠杆菌和肉质葡萄球菌均表现出较高的抑菌活性。经鉴定这些肽段为阳离子抗菌肽,富含阳离子氨基酸Lys和Arg[88]。类似地,采用胰蛋白酶和胰凝乳蛋白酶水解卵白蛋白可分别产生5 种和3 种抗菌肽。胰蛋白酶水解产生的肽仅表现出对枯草芽孢杆菌的强杀菌活性,而胰凝乳蛋白酶水解产生的肽对革兰氏阳性菌(如枯草芽孢杆菌和金黄色葡萄球菌)和革兰氏阴性菌(如博德特氏菌、大肠杆菌和肺炎克雷伯菌)以及真菌(如白色念珠菌)均显示出抗菌活性。采用风味蛋白酶、胃蛋白酶、胰蛋白酶、中性酶、木瓜蛋白酶和碱性蛋白酶对卵白蛋白进行酶解可得到抗菌肽。与其他组分相比,胃蛋白酶水解物显示出最高的抗菌活性[89]。Ma Bin等从纯化的卵转铁蛋白中鉴定出一种新型抗菌肽OVTp12,该天然抗菌肽对革兰氏阳性和阴性细菌均具有较强的抑制活性。借助激光共聚焦扫描显微镜和流式细胞仪分析OVTp12对细菌胞内外膜的影响,结果表明,这种抗菌肽可通过破坏细菌细胞膜的完整性和增加膜通透性来发挥抗菌活性[90]。为了纯化和鉴定抗菌肽,Tang Wenting等提出了一种将脂质体作为模拟生物膜系统的固定化脂质体结合提取方法。通过比较胃蛋白酶水解液与固定化脂质体膜作用前后的HPLC图谱,同时预测了4 个肽段。一种新阳离子抗菌肽OPep2被测序为RVASMASEKMKI。此外,抗菌实验表明,OPep2与细菌细胞膜相互作用导致钾离子外流和核苷酸泄漏,最终导致细胞死亡[91]。由于固定化脂质体结合提取法效率高、操作简单,能比常规方法更有效地筛选抗菌肽,为抗菌肽的生产提供了科学依据。
4.4 抗炎活性
一般而言,炎症是宿主抵抗病原体或有害内源性物质的伤害而产生的一种防御性反应,最终会消除坏死细胞和病原体,通常以肿胀、发红、发热和疼痛为特征。炎症可以为生物体提供保护作用以及附带的不利损伤[92]。病原体相关分子(如脂多糖(lipopolysaccharide,LPS))可以激活MAPK及其下游因子,包括核转录因子(nuclear factor kappa-B, NF-κB)和环磷酸腺苷反应序列,从而导致免疫相关的促炎蛋白质(包括诱导型NO合成酶和环氧合酶-2)表达上调[93]。NO可以随着诱导型NO合成酶浓度的增加而紧密积聚,并促进炎症因子如细胞因子、肿瘤坏死因子(tumor necrosis factor,TNF)-α和白细胞介素(interleukin,IL)的产生[94]。Jiao Huanli等的研究表明卵转铁蛋白衍生肽IRW可通过减少大鼠血清中TNF-α、IL-6和髓过氧化物酶活性来减缓LPS诱导的腹膜炎[95]。也有研究者通过计算机模拟酶解卵转铁蛋白,获得了18 条二肽,研究发现有5 条肽段(CR、FL、HC、LL和MK)均能显著抑制Caco-2细胞促炎细胞因子TNF-α、IL-8、IL-6、IL-1β和IL-12基因表达,促进抗炎细胞因子IL-10基因表达。其中,CR和HC抑制了TNF-α诱导的Caco-2细胞中NF-κB和MAPK信号通路,而LL、FL和MK则通过抑制MAPK信号通路来发挥抗炎作用[56]。Zhang Mengya等发现皮蛋的胃肠道消化产物对Caco-2细胞和葡聚糖硫酸钠诱导的结肠炎小鼠模型具有抗炎活性。随后,他们从消化产物中分离纯化得DEDTQAMPFR(DR-10)、DEDTQAMPF(DF-9)、MLGATSL(ML-7)和MSYSAGF(MF-7)4 条肽段,通过TNF-α诱导的Caco-2细胞探索了肽段的抗炎作用机制。研究发现,这4 条肽段可显著抑制相关促炎细胞因子的基因表达,促进IL-10基因表达以及抑制c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)的磷酸化。同时,DR-10和DF-9降低了IκB和p38的磷酸化[96-97]。Sun Xiaohong等发现由碱性蛋白酶产生的卵黏蛋白衍生肽具有抗炎活性,其通过抑制TNF介导的NF-κB通路而发生作用[85]。Yoo等从蛋壳膜水解产物中获得了3 个组分,即组分I(>10 kDa)、组分II(3-10 kDa)和组分III(<3 kDa)。研究表明,不同组分均能抑制由脂多糖和干扰素-γ引起的Raw 264.7细胞炎症反应,减缓皮肤炎症以及抑制胶原酶和弹性蛋白酶活性,其中组分I的抑制活性最显著[98]。
4.5 抗癌活性
禽蛋蛋白质已被认为是治疗或预防癌症的候选蛋白质,其中溶菌酶是研究最广泛的一种。溶菌酶被报道具有治疗肺癌的潜力,实验结果表明口服溶菌酶可以减缓肺癌小鼠的癌细胞转移,其作用机制可能是激活脾脏和巨噬细胞[99]。不同酶制备的禽蛋蛋白质水解物也具有一定的抗癌活性。有许多研究实例证明禽蛋蛋白质及其多肽的抗癌活性是通过多种机制发生的,包括诱导细胞凋亡、防止DNA损伤、降低癌细胞的侵袭能力以及加强正常细胞对抗癌细胞的能力和抗诱变活性[100]。Moon等用不同的酶制备了9 种蛋清卵转铁蛋白水解物,并评价了其对7 种不同癌细胞株增殖活性的影响。虽然卵转铁蛋白处理也会降低这些癌细胞的活力,但每种水解物的半抑制浓度远低于卵转铁蛋白,这表明卵转铁蛋白经酶水解释放出的多肽可能对这些癌细胞更敏感[101]。Lee等也发现,相比天然卵转铁蛋白,经两步酶水解所得的卵转铁蛋白水解产物对癌细胞具有更强的细胞毒性[102]。蛋清卵黏蛋白糖肽的抗癌潜力也被报道,它被证明在小鼠双移植瘤系统中能抑制肿瘤的生长,但具体机制尚不清楚。作为一种高黏度糖蛋白,卵黏蛋白由α亚基和β亚基组成,其β亚基对黑色素瘤细胞、Lewis肺癌细胞和肉瘤细胞(SR-180)具有细胞毒性作用[103]。这些发现提示β亚基可能是蛋清卵黏蛋白抗癌活性的功能基团。此外,用灰色链霉菌的蛋白酶水解卵黏蛋白能释放出α亚基的3 种糖基化寡肽,此类肽可有效抑制肿瘤生长。也有研究者发现从蛋黄中获得的多肽对结肠癌细胞具有抗增殖活性[104]。目前,植物源多酚是研究最多的具有抗癌潜力的天然物质,而对食品蛋白质源抗癌肽的了解还很有限,这可能会促进这一领域的研究,为抗癌治疗的替代方案探索新的机会。
4.6 抗糖尿病作用
血糖水平是通过大脑、胰腺、肝脏、肠道、脂肪和肌肉组织释放的各种激素和神经肽来调节的。事实上,来自肠道的葡萄糖吸收、肝脏产生的葡萄糖以及外周组织对葡萄糖的吸收和代谢决定了体内的血糖浓度[105]。生物活性肽可以通过影响体内不同的靶点,包括饱腹感反应、胃肠激素释放、肠道葡萄糖吸收、胰岛素分泌和敏感性、葡萄糖吸收和脂肪组织修饰,来对葡萄糖稳态产生积极影响[106]。然而,在所有这些靶点中,禽蛋源多肽作为α-葡萄糖苷酶和DPP-IV活性的潜在抑制剂被研究得最多。食源性α-葡萄糖苷酶抑制剂已经从包括禽蛋蛋白质在内的不同蛋白质来源中鉴定出来。例如,蛋清蛋白质的碱性酶酶解产物中含有具有α-葡萄糖苷酶抑制活性的多肽。其中,RVPSLM和TPSPR是最有效的活性多肽。KLPGF是一种卵白蛋白衍生肽,对α-葡萄糖苷酶和α-淀粉酶也具有一定的抑制活性[107]。虽然已有文献报道了食源性多肽在体外对α-葡萄糖苷酶活性的抑制作用,但似乎α-葡萄糖苷酶的抑制活性与α-葡萄糖苷酶的来源有关[108]。因此,这就需要进一步通过体内研究来验证这些肽在生理条件下的有效性。DPP-IV会降解胰高血糖素样肽-1,而这种肽在机体内能通过增加餐后胰岛素分泌来调节葡萄糖稳态[109]。近年来,许多研究揭示了食物蛋白质作为DPP-IV抑制肽前体的潜力。胃蛋白酶水解脱脂蛋黄蛋白质后,会产生对α-葡萄糖苷酶和DPP-IV具有抑制活性的YIEAVNKVSPRAGQF、YINQMPQKSRE、YINQMPQKSREA和VTGRFAGHPAAQ 4 种多肽。这些多肽还在体外发挥了ACE抑制活性和抗氧化活性[110-111]。增强胰岛素敏感性和脂肪细胞分化以及减轻脂肪组织炎症是生物活性肽影响葡萄糖稳态的另外机制。虽然从大豆和乳清蛋白中提取的几种肽已被报道可以恢复胰岛素信号,促进胰岛素敏感性和前脂肪细胞分化,并减轻脂肪细胞炎症,但在禽蛋蛋白中几乎没有鉴定出类似的多肽[112-113]。最近发现卵转铁蛋白源多肽IRW可通过刺激胰岛素信号来改善L6成肌细胞的胰岛素抵抗,它主要是减少Ang II刺激的AT1R表达和氧化应激来改善胰岛素抵抗[114]。他们后续也使用大鼠骨骼肌细胞研究蛋清酶解产物及其核心多肽IRW对TNF-α诱导的胰岛素抵抗的影响以及潜在的分子机制。研究发现两种产物均可改善TNF-α诱导的细胞对葡萄糖的摄取,增加胰岛素受体底物(insulin receptor substrate-1,IRS-1)酪氨酸残基和蛋白激酶B的活化,而降低IRS-1丝氨酸残基的活化。它们还可降低TNF-α诱导的促p38和JNK 1/2的激活,从而改善胰岛素敏感性受损[115]。此外,用嗜热菌蛋白酶和胃蛋白酶处理的蛋清水解物在脂肪细胞中显示出胰岛素模拟和增敏作用[116]。
4.7 金属离子结合与转运活性
在肠腔内,矿物质的结合与释放是一个动态过程。一些活性肽具有金属离子螯合性质,它们可以与矿物质(如钙、铁、锌离子)结合,促进矿物质在体内的吸收与转运,以改善矿物质的生物利用率[117-118]。Abeyrathne等采用加热、碱和酶处理卵黏蛋白,以探讨处理后水解产物抗氧化、ACE抑制活性和金属离子螯合活性的差异。结果表明,在碱性条件下经胰蛋白酶处理的卵黏蛋白水解物对Cu2+有最高的螯合活性,而卵黏蛋白在碱性条件下加热15 min所产生的水解物有最高的Fe2+螯合活性[33]。Hou Tao等研究发现鸭蛋清肽在草酸、磷酸和锌离子存在下可促进Caco-2细胞单层对钙的摄取。动物实验结果表明,蛋清肽能有效促进机体对矿物质的吸收,并能拮抗植酸的毒害作用。这些结果表明,蛋清肽可能通过3 条途径促进钙摄取,包括蛋清肽与钙结合形成可溶性螯合物,避免钙沉淀;螯合物以小肽形式被肠细胞吸收;蛋清肽通过与瞬时受体电位辣椒素(transient receptor potential cation channel subfamily V member 6,TRPV6)钙通道相互作用,调节肠细胞的增殖和分化[119]。通过同源建模和分子对接方法分析已鉴定出的促骨形成四肽(VSGG)和TRPV6钙通道的相互作用,确定了两个可能的活性位点[120]。Sun Na等采用傅里叶变换红外光谱、核磁共振氢谱和等温滴定量热法分析蛋清水解液中五肽(DHTKE)的结构和热力学特征,阐明了DHTKE与钙离子的结合方式。研究表明,DHTKE能以1∶1的化学计量比自发地结合钙,钙结合位点对应于DHTKE的羧基氧、氨基氮和咪唑氮原子。此外,利用Caco-2细胞体外研究了DHTKE-钙复合物对钙吸收的影响。结果表明,与对照相比,DHTKE-钙复合物能促进钙离子进入胞浆,进一步提高钙在Caco-2细胞单层的吸收率(提高7 倍以上)[121]。同时,他们团队的后续研究也发现这个五肽可以与锌离子形成复合物,促进锌离子在胃肠道中吸收和转运[122]。Li Bo等以缺铁性贫血大鼠为实验对象,FeSO4作阳性对照,研究鸭蛋清肽对铁在体内生物利用率的影响。在喂食不同剂量蛋清肽-铁螯合物后,贫血大鼠的血常规相关指标在3 周后恢复到正常水平。研究发现这种螯合物可以调节二价金属转运蛋白1、铁转运蛋白1和铁调素的基因表达。通过HPLC-ESI-MS/MS对螯合物进行结构表征,分析鉴定了8 种关键铁螯合肽,且表明Glu、Asp、Lys、His、Ser和Cys残基可能在蛋清肽与铁的螯合中起着关键作用[123]。这些研究有助于了解多肽与矿物质的结合机制,并提示蛋清肽作为功能食品在促进矿物质吸收方面有着潜在的应用前景。
4.8 免疫调节作用
免疫系统的不健康与慢性病的发展有关。例如,由免疫系统反应不当引起的慢性炎症与糖尿病、肥胖、动脉粥样硬化和癌症有关[124-125]。因此,保持健康的免疫系统对健康至关重要。除了各种类型的免疫疗法外,食物中活性成分也与调节免疫系统有关。食源性免疫调节肽从经胰蛋白酶处理的酪蛋白水解物中鉴定出来后,激发了将牛奶蛋白水解产物开发为免疫调节肽商品的探究[126]。禽蛋蛋白质是免疫调节肽的另一来源。目前,已有源于禽蛋蛋白质的免疫刺激多肽和免疫抑制多肽的报道。用胃蛋白酶消化制备的蛋黄水解物已被证明能够诱导免疫反应,从而增加免疫缺陷小鼠(BALB/c)小肠黏膜细胞中IgA水平,表明其具有增强黏膜免疫反应的潜力[127]。关于免疫抑制肽,研究发现蛋清蛋白质的水解物,包括由胃蛋白酶、中性酶和碱性蛋白酶制备的卵白蛋白、溶菌酶和全蛋清蛋白质水解物,可以刺激淋巴细胞增殖和细胞因子的产生[128]。LPS可刺激巨噬细胞分泌促炎性细胞因子酶,而卵黄球蛋白及其胃蛋白酶和碱性蛋白酶水解物则能不同程度地降低巨噬细胞中这些标志物的水平[129]。用消化酶处理溶菌酶,并在LPS刺激下用溶菌酶水解物在Caco-2细胞中测定IL-8的产生,结果表明,胃蛋白酶水解溶菌酶产生的肽降低了IL-8水平[130]。由卵白蛋白产生的多肽可提高巨噬细胞吞噬活性以及在癌症免疫治疗中增强免疫应答[131]。Polanowski等在从蛋黄中提取卵黄免疫球蛋白时,也获得一些具有免疫调节活性的多肽。他们采用分子排阻色谱、SDS-PAGE和HPLC对多肽混合物进行纯化分级和鉴定,获得了8 条肽段,随后通过促细胞因子实验证实这些多肽可作为细胞因子IL-1β和IL-6释放的有效诱导剂[132]。Martinez等用小鼠的肠上皮细胞和树突状细胞进行蛋清过敏性实验,发现蛋清能诱导肠上皮细胞和树突状细胞中促炎性细胞因子上调。而当以胃蛋白酶处理的卵白蛋白水解物作为免疫治疗剂加入到这两种细胞中时,细胞对蛋清的致敏性产生了耐受。进一步研究表明,卵白蛋白水解物可诱导免疫细胞中乙醛脱氢酶的表达以及促进与调节性T细胞生长和分化相关的转录因子的产生[133]。其他研究者也发现喂食蛋清致敏小鼠一定量蛋清产物后,由于促进了小鼠体内Foxp3+调节性T细胞的生长发育,过敏反应明显得到了改善[134-135]。
4.9 改善骨骼健康
蛋白质对骨骼健康既有积极影响,也有不利影响,这取决于各种因素,如蛋白质来源、蛋白质摄入量、钙摄入量和饮食中的酸平衡。一项由65 名绝经期妇女组成的随机双盲临床实验表明口服蛋黄多肽制剂6 个月可显著降低骨质重吸收标志物的水平。在摄入蛋黄多肽时骨质密度维持在健康的数值,而不摄入时则会下降[136]。细胞和动物实验研究进一步证实了蛋黄肽对骨骼健康的作用。研究发现,蛋黄水溶性蛋白组分能促进前成骨细胞MC3T3-E1增殖和青春期雄性大鼠骼生长[137]。据报道,蛋黄中另一种不同酶水解的多肽具有抗骨质疏松的作用。蛋黄源多肽对前成骨细胞MC3T3-E1的增殖有激活作用,对破骨细胞生成有抑制作用。喂食去卵巢大鼠一定量蛋黄多肽,发现蛋黄多肽可通过增加骨密度和防止去卵巢引起的松质骨丢失来起到骨质保护作用。此外,蛋黄多肽可通过调节成骨基因表达来剂量依赖性地促进成骨细胞MG-63增殖、胶原合成和钙沉积[138]。Kobayashi等研究了禽蛋蛋黄水解物对5~8 月龄去睾丸小狗的骨代谢影响。以骨形成标志物骨碱性磷酸酶(bone alkaline phosphatase,BAP)和骨吸收标志物尿脱氧吡啶酚(deoxypyridinoline,DPD)水平作为骨代谢指标。在整个临床研究过程中,相比对照组,喂食富含蛋黄水解物的小狗血清BAP水平较高,且DPD水平较低。特别地,在睾丸切除后2 个月,喂食富含蛋黄水解物的小狗血清BAP水平显著高于非喂食组。这表明蛋黄水解物在小狗睾丸切除后会快速促进骨形成[139]。陈宏杰的研究也表明蛋黄经胰蛋白酶水解后,水解产物可促进前成骨细胞MC3T3-E1细胞的增殖、分化和矿化[140]。同样地,蛋清肽在促进骨骼形成方面也发挥着重要作用[141]。Hou Tao等采用维甲酸诱导的骨丢失模型评价蛋清肽对钙吸收和骨形成的影响。骨丢失模型雌性大鼠在补充蛋清肽后,钙吸收率增加,部分血清和骨指标恢复正常。形态学结果显示,大鼠在补充蛋清肽后骨组织形态得到改善,破骨细胞数量减少。体外研究表明,TRPV6钙通道是蛋清肽和已鉴定的四肽(VSGG)的主要转运途径[142]。后续研究也证实此四肽可通过介导细胞外因子β-连环蛋白信号通路和肠道微生物区系来促进骨骼生长和抑制脂质异常代谢[143]。由于能促进钙的摄取和骨形成的调节,蛋清肽有望成为一种很有前景的骨丢失治疗药物的替代品。
4.10 其他功能活性
随着对生物活性肽研究的逐渐深入,生物活性肽的一些其他功能活性也被发掘出来。例如,蛋清肽可以减少肝脏和肌肉中异位脂肪堆积,促进脂肪排泄,从而起到抵抗肥胖的作用[106]。Hou Tao等报道鸭蛋清肽还能促进钙代谢以及通过对肠道微生物区系和十二指肠绒毛表面积产生有益影响来改善肠道健康[144]。也有研究者从卵白蛋白中获得了具有治疗阿尔茨海默病潜力的三肽。他们鉴定出了3 条三肽(IEK、LYR和CIK),通过分子对接确定了这3 条多肽分别与乙酰胆碱酯酶(acetylcholinesterase,AChE)、丁酰胆碱酯酶(benactyzine hydrochloride,BChE)和β位点淀粉样前体蛋白裂解酶1(β-site amyloid precursor protein cleaving enzyme 1,BACE1)相互作用的最佳位置。体外实验结果表明,这3 种多肽均对AChE 、BChE和BACE1有较好的抑制活性[145]。另外,蛋清源多肽还具有抗病毒[146]、抗焦虑[147]、改善生殖功能失调[148]等功能。而蛋黄中水溶性多肽还可以通过刺激血管内皮生长因子来促进毛发的生长[149]。蛋壳膜中含有胶原蛋白、角蛋白、卵白蛋白、卵转铁蛋白、溶菌酶等,对其进行酸、碱和酶水解也可以产生具有生物活性的产物[6]。Park等探讨了蛋壳膜水解产物对皮肤美白、创面愈合和紫外线防护的影响。按分子质量将水解产物分为组分I(大于10 kDa)、组分II(3~10 kDa)、组分III(小于3 kDa),所有组分的蛋白质量分数都在90%以上。用永生化表皮细胞(HaCaT)进行的伤口愈合实验表明,在质量浓度为1 mg/mL时,组分I对伤口愈合的促进作用效果略好于其他组分,但随着浓度的增加,效果差异不显著。在抑制酪氨酸酶和L-3,4-二羟基苯丙氨酸氧化的美白效果实验中,完整的蛋壳膜水解产物表现出与熊果苷(阳性对照组)相近的抑制效果。在抑制B16-F1黑色素瘤细胞黑色素形成的实验中,组分I表现出较强的抑制作用。皮肤紫外线防护实验中,各组分的HaCaT细胞存活率均高于空白对照组[150]。这一研究表明蛋壳膜水解产物有作为功能性化妆品配料的潜力。禽蛋中主要蛋白质源多肽的功能活性总结见表1。

表1 禽蛋中主要蛋白质源多肽的功能活性Table1 Functional activities of peptides derived from egg proteins
5 生物活性肽的胃肠道消化吸收与转运
生物活性肽需以完整形式或其他活性片段在小肠中被吸收,以发挥生理健康益处。在到达血液循环之前,生物活性肽必须经历一系列复杂的反应,如经消化酶、肠上皮和肠细胞肽酶水解[54,178]。与非胃肠道蛋白酶相比,体外模拟胃肠道消化产肽的研究特别有意义,因为体外测定的多肽效价和生物利用率可能反映口服和体内胃肠道消化后蛋白质的生理益处。体外模拟胃肠道消化通常用于简单模拟体内消化过程,模拟体系主要包括胃蛋白酶和胰液(包括胰蛋白酶、糜蛋白酶、弹性蛋白酶、羧肽酶等)。有研究认为短肽(少于6 个氨基酸)可抵抗胃肠道消化,并能完好无损地穿过肠上皮[179]。蛋清源降血压肽TNGIIR、RVPSL和QIGLF很难被胃肠道酶水解,其他肽如RADHP、YAEER、YPI、IQW和LKP可以抵抗胃肠道消化[43,73,164,180]。然而,较长的肽段,如FRADHPFL和YAEERYPIL,可被完全地消化成FRADHPF、RADHPF、ADHPF、RADHP、YAEER和YPI。这些较长的肽可能通过RADHPF、YAEER和YPI等片段发挥生理降血压作用,但这些肽片段在体外并没有显示出更好的ACE抑制活性[74,152-153,164]。此外,胃肠道消化还可能产生有效的生物活性肽。例如,IRW、IQW和LKP都是由胃蛋白酶和嗜热菌蛋白酶水解的卵转铁蛋白所产生的,并且IQW和LKP可以有效地抵抗胰腺的消化[73]。胃肠消化可以使肽变得更小,这有利于它们稍后在小肠的管腔中吸收。在胃肠道酶消化过程之后,多肽需抵抗肠细胞肽酶消化以通过肠上皮,这样才能最终被吸收。
结肠癌细胞系(Caco-2)是一种被广泛接受的模拟小肠吸收食物成分的模型。这是一种比体外和体内模型更容易和更低成本的方法,常用来研究肽的吸收情况。成熟的Caco-2功能类似成熟的肠细胞,可稳定表达刷状缘肽酶和转运蛋白,这是小肠转运和吸收的前提[181]。目前,生物活性肽有多种转运途径,包括肽转运蛋白1(peptide-transporters 1,PepT1)介导的主动转运、紧密连接的细胞旁路转运、细胞胞吞转运和被动跨细胞转运途径。肠细胞转运系统中存在一个pH依赖性的H+/Na+交换通道,转运多肽过程中会依靠H+电化学质子梯度供能。肠上皮细胞单层转运多肽的途径如图3所示。简而言之,在H+电化学梯度的协助下,PepT1介导的转运主要参与二肽和三肽的转运,且这些肽一般为中性电荷的非极性疏水肽。细胞旁路转运首选中性或带负电荷、小分子和亲水性多肽。长链和高疏水性的多肽容易通过胞吞作用转运。而带正电荷且疏水的大分子肽倾向于被动跨细胞转运[179,182]。在蛋源生物活性肽中,较小的肽更能抵抗肠细胞肽酶的降解。较大的肽如FRADHPFL和YAEERYPIL会被水解,其中水解程度最高的是YAEERYPIL,它被完全降解为YAE和YPI[183]。虽然IQW、IRW和RVPSL等较小的肽在运输过程中也被降解,但其他如LKP、YAEER和YPI被发现运输时完好无损,没有任何降解。五肽和六肽(RVPSL、QIGLF和TNGIIR)通过细胞旁路途径转运,三肽(YPI、IRW、IQW和LKP)通过PepT1转运。事实上,IRW、IQW和LKP还参与了细胞旁路转运,这可能是归因于中间位置的R、Q和K残基所体现的亲水性[46,180,184-185]。FRADHPFL和YAEERYPIL的胃肠消化吸收结果进一步表明,较长肽段的生物活性可能是由小的活性片段(如RADHP、YAEER和YPI)介导的。有趣的是,在细胞单层膜的基底外侧表面没有检测到RADHP,这表明RADHP似乎不需要被吸收就能发挥降血压作用,这可能是多肽通过与胃肠道中的受体相互作用来调节血压[186]。Wang Liying等研究了蛋清肽在Caco-2细胞单层和外翻大鼠肠囊中跨膜转运情况。结果表明,与外翻大鼠肠囊相比,蛋清肽在Caco-2细胞单层中具有更高的通透性,但降解程度更低。从Caco-2细胞单层的基底外侧和外翻大鼠肠囊的浆液侧均鉴定了4 种肽(LGAKDSTRT、DGSRQPVDN、VNDLQGKTS和GKKDPVLKD),这表明这4 种肽可以在两个模型系统中以完整序列运输。同时,从Caco-2细胞单层的顶端侧和外翻大鼠肠囊的黏膜侧鉴定出了24 种肽,表明这些肽对刷状缘膜肽酶有着潜在抗水解性。其中,IRDLLER、YAEERYP和IRNVLQPS被证明具有DPP-IV抑制活性。此外,分子对接揭示了DPP-IV抑制肽可能与活性位点之间形成了氢键、π-π键以及电荷相互作用[187]。禽蛋中的许多生物活性肽已被证实在体内的作用,但这些肽是如何到达循环系统并参与生理代谢的还需要更多的确凿证据来进一步揭示。
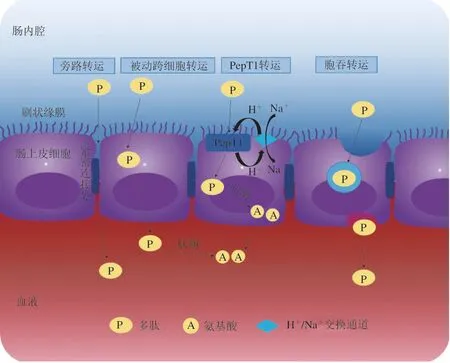
图3 肠上皮细胞单层转运生物活性肽的途径[182]Fig. 3 Pathways for transporting bioactive peptides across intestinal epithelial cell monolayers[182]
6 结 语
禽蛋源生物活性肽具有巨大的研究潜力,可以开发成改善类健康的功能性食品,但仍需要深入且精准的研究以阐明生物活性肽的相关作用机制以及解决应用开发过程中所面临的问题。首先,传统的活性导向纯化和分级鉴定生物活性肽的方法非常耗时,因此有必要将经典方法与生物信息学方法相结合,以高效且全面地筛选隐蔽的生物活性肽序列或其蛋白质前体,这样就可发掘禽蛋蛋白质作为新型生物活性肽来源的潜力。同时,为了开发经济且规模化的生物活性肽生产技术,还需进一步结合多种预处理手段和新技术(如亚临界水提取法、固定化酶、酶膜反应器)来高效制备禽蛋蛋白质水解物及高纯度的肽组分。其次,虽然从禽蛋蛋白质中已鉴定出大量生物活性肽,但它们针对某一特定生物活性可能存在着多重作用机制,那就还需要在细胞和分子水平上详尽地阐明生物活性肽的作用机制。尽管生物活性肽的体外实验可以提供用于体内功能活性评估所需的初步证据,但它在很大程度上忽略了一个事实,即多肽可能存在较差的生理吸收和转运特性以及可能会在体内代谢为非活性序列。因此,考虑到这些多肽可能存在胃肠道代谢不稳定性或低生物利用率问题,可对活性肽进行适当的化学修饰或构建包埋递送体系(如微胶囊、纳米脂质载体、乳液体系、液晶相体系等)以提高生物利用率。而当前的新趋势是设计和研究对肽酶具有高抵抗力和对PepT1具有高亲和力的食源性活性肽。但这些方法可能会增加活性肽的生产成本以及造成安全问题。另外,目前多肽研究主要集中在体外或动物模型上的生物活性,这就缺乏强有力的临床证据来证实其有效性和支撑未来产品的健康益处声明。因此,在后续的临床实验中需要更多地关注生物活性肽的安全性、有效性、作用机制和剂量效应的关系、肽与其他药物的相互作用、吸收、分布、代谢和排泄等方面。此外,如果多肽在复杂的混合物中能保持其生物活性,那么使用含有生物活性多肽的粗水解物似乎更适用于功能性食品配方。但在生物活性肽转化为商业化产品时,还可能存在多肽产品溶解性差、有苦味(苦味肽)等问题,那么就需要开发有效的工艺技术来获得具有生物活性且消费者可接受的多肽产品。
