膳食中氧化蛋白对机体健康影响的研究进展
2021-10-31齐世超李洪军王俊鹏贺稚非
齐世超,李洪军,2,王俊鹏,贺稚非,2,
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715)
蛋白质作为人体必需的营养物质,具有为机体提供必需氨基酸、能量和调节免疫等多种作用[1]。早在20世纪早期,科学家研究发现机体内蛋白质氧化修饰后,溶酶体无法充分降解氧化蛋白,会造成蛋白质氧化产物在机体内积累,从而诱发糖尿病、白内障和阿尔茨海默病等多种慢性疾病[1]。食物作为人体摄入蛋白质的来源,其安全品质时刻影响着人体健康。由于蛋白质氧化产物会在加工和贮藏过程中积聚,因此,研究摄入食品中氧化蛋白对人体健康的影响至关重要。在过去的几十年中,对蛋白质氧化进行的研究多集中于氧化蛋白作为神经退行性疾病和其他疾病(阿尔茨海默病、急性心肌梗塞)的生物标志物[2],而有关食源性氧化蛋白对人体健康影响的研究较为缺乏。赵琪[3]采用H2O2/Cu2+催化体系氧化酪氨酸得到主要成分为双酪氨酸(di-tyrosine,Dityr)和3-硝基酪氨酸(3-nitrotyrosine,3-NT)的氧化产物。根据急性中毒分类标准,氧化酪氨酸产物的级别为无毒性,而在动物毒性实验中,长期摄入氧化酪氨酸产物会导致大鼠氧化还原状态失衡和心肌氧化性损伤,说明摄入氧化酪氨酸对机体的损伤作用可能存在长期累积性。同时,Cuq等[4]研究发现,氧化修饰后的氨基酸残基会被机体吸收,且氧化氨基酸会随着内循环到达机体各个组织器官。也有研究表明摄入大量氧化氨基酸会破坏小鼠内源性抗氧化系统,诱导炎症性肠炎,导致肝脏和肾脏纤维化[5-6]。
近几十年,大量研究主要集中在摄入脂肪对机体健康的危害,而忽略了蛋白质对机体健康的影响。目前我国饮食结构正在逐渐向西方饮食结构靠拢,蛋白质摄入的增加和食物的高加工率不可避免地会增加人体氧化蛋白的摄入,因此探究膳食中氧化蛋白对机体健康的影响机制是一个亟需解决的问题。故本文概述了膳食中氧化蛋白与机体氧化应激之间的联系,总结了膳食中蛋白质氧化机理及产生途径,并系统阐述了体内氧化蛋白的积累途径,同时对近些年膳食氧化蛋白对机体健康的影响研究进行了梳理,希望为膳食蛋白与机体健康关系的研究和合理膳食提供指导和参考。
1 膳食中氧化蛋白与机体氧化应激
氧化应激是指体内氧化因子与抗氧化机制失衡的一种状态,其倾向于氧化,导致机体内自由基含量增加[7]。活性氧(reactive oxygen species,ROS)作为细胞氧化反应的正常代谢产物,参与蛋白质、脂质和DNA等大分子的氧化损伤[8]。在生理条件下,内源性抗氧化防御机制可以抑制ROS的形成,保持正常的细胞功能和内稳态。通常,机体内的抗氧化系统主要分为两部分:1)抗氧化酶系统,主要包括超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶等;2)非酶抗氧化剂系统,包括VC、VE、谷胱甘肽、类胡萝卜素和微量元素(铜、锌、硒)等。一方面,机体必需的微量营养素需要通过饮食摄取;另一方面,不平衡的饮食(脂质/蛋白质/碳水化合物份额受损)和直接摄入的膳食中氧化产物可能引起机体氧化应激,如膳食中的氧化产物会通过肠道吸收、血流分布和诱导体内氧化产物积累,从而引起体内氧化应激。因此,膳食结构在调节机体氧化状态中发挥着重大作用。
1995年,Levander等[9]引入了一个新术语——“膳食氧化应激(dietary oxidative stress)”,它是指通过膳食摄入过多的氧化蛋白而引起的体内细胞氧化还原状态的紊乱。除此之外,Kanner等[10]将由于摄入过氧化饮食而产生的(体内)氧化应激定义为“餐后氧化应激(postprandial oxidative stress)”。但Kanner等定义的餐后氧化应激主要是针对摄入富含脂质和脂质氧化次级产物引起的机体氧化应激,而忽略了膳食中氧化蛋白及相关氧化产物对机体氧化应激的影响。蛋白质氧化是ROS直接或间接与氧化应激次级产物反应引起蛋白质共价修饰,导致蛋白质分子之间交联、氨基酸侧链的修饰与蛋白质骨架断裂等[11]。20世纪初,Dakin[12]最早报道了消化过程中特定氨基酸的氧化降解,并分析了氨基酸氧化的潜在生物学后果,但仍不清楚蛋白质氧化对人体健康的影响。在随后的研究中,研究人员逐渐发现蛋白质氧化与衰老、慢性病之间有着一定联系。Youngman等[13]在1992年报道了与衰老有关的蛋白质氧化可以通过限制蛋白质的摄入而减缓,这表明膳食中蛋白质与体内蛋白质氧化之间存在一定关系。与此同时,有研究发现摄入氧化蛋白会增加实验动物血液和内脏中的自由基含量,促进体内氧化应激现象的发生[14]。因此,膳食中氧化蛋白对机体餐后氧化应激具有推动作用。
2 膳食中蛋白氧化的影响因素及机理
2.1 膳食中蛋白质氧化的影响因素
蛋白质氧化是导致食品品质劣变的重要因素之一,其不仅会影响食品风味、感官和色泽,还会导致蛋白质营养价值下降。在食品加工过程中蛋白质氧化受多种因素影响,包括原料、加工方式等。
2.1.1 原料
脂质作为人体的重要营养素之一,为机体提供能量和必需脂肪酸。同时膳食中脂质含量也可以影响蛋白氧化反应。鉴于脂质氧化与蛋白质氧化同为自由基链式反应,一些研究者认为两者之间存在交互作用。如Soyer等[15]研究发现鸡肉在低温贮藏过程中脂质氧化和蛋白氧化之间存在一定相关性;Wang Zhaoming等[16]研究发现脂质氧化产物丙二醛(malondialdehyde,MDA)可以促进肌原纤维蛋白和肌红蛋白氧化。膳食中含有的金属离子(如Fe3+和Cu2+)也催化ROS的产生,从而促进蛋白质氧化[17]。外源添加物对食品中蛋白氧化也具有一定影响,如香辛料和天然抗氧化物质能抑制食品中蛋白质氧化[18];亚硝酸盐能抑制羰基和二聚酪氨酸的形成,阻止蛋白氧化[19];高浓度的NaCl能破坏细胞膜的完整性,降低抗氧化酶活性,从而促进蛋白氧化[20]。
2.1.2 加工方式
蛋白质氧化在食品加工过程中普遍存在,一般受热加工影响较大。热加工方式众多,包括蒸煮、挤压膨化、干燥和微波加热等,尽管这些热加工方式可能会对蛋白质氧化产生不同的影响,但热加工对蛋白质氧化的影响机制大致相同。热处理后自由基含量增加、抗氧化酶活性急剧下降以及肉中血红素的卟啉环氧化断裂,从而催化蛋白质氧化[21]。相较于热加工,非热加工对蛋白质氧化影响较小,但同样能引起蛋白质结构发生改变。例如经高密度二氧化碳加工技术处理后,乳清蛋白的疏水基团暴露、荧光强度上升以及热变性温度改变[22];超声波辅助腌制处理可以促进肌原纤维蛋白质羰基含量上升、巯基含量下降以及蛋白质结构发生改变[23];斩拌可以破坏肌肉纤维,增加肉与氧气的接触面积,促进蛋白质氧化[24]。
2.2 蛋白质氧化机理
2.2.1 ROS介导的蛋白质氧化机制
ROS介导的蛋白质氧化机制如图1所示。首先,O2和H2O会在X射线、γ射线和Fe2+的作用下生成·OH,·OH夺取蛋白质分子中的氢原子,生成以碳原子为中心的自由基(C·)(c反应),C·会与O2结合生成烷氧自由基(COO·)(d反应),COO·可以与Fe2+、另一个分子中的氢原子或超氧阴离子自由基反应生成烷基过氧化物(COOH)(f、g和h反应),COOH可以与过氧自由基或Fe2+进一步反应生成烷基自由基(CO·)和羟基衍生物(C—OH)(j和k反应)。在无氧条件下,两个以碳原子为中心的自由基会相互反应生成碳-碳交联衍生物(e反应)。除去以上途径外,CO·和COOH还可以通过酰胺化或α-酰胺化途径发生裂解(i和l反应)[8]。
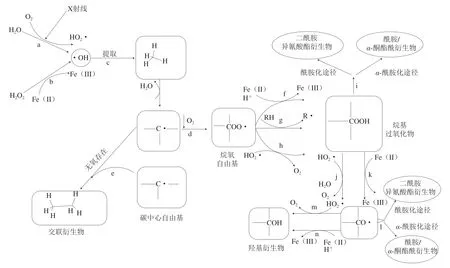
图1 ROS介导的蛋白质氧化机制[8]Fig. 1 Reactive oxygen species-mediated protein oxidation mechanism[8]
2.2.2 活性氮介导的蛋白质氧化机制
活性氮(reactive nitrogen species,RNS)是指一种具有较高活性的含氮自由基及自由基衍生物,主要是由一氧化氮自由基(NO·)和ROS反应生成[25]。NO·是L-精氨酸在一氧化氮合酶作用下转成瓜氨酸的过程中产生的。在NO·低浓度情况下,RNS具有调节信息传递和炎症的作用,在NO·浓度过高的情况下,NO·会与超氧阴离子自由基反应生成过氧亚硝基阴离子自由基(ONOO-),而ONOO-与·OH的性质相似,具有较高活性,容易对生物大分子造成损伤[26]。蛋白质巯基作为RNS的攻击对象,可以被氧化修饰生成亚硝基化巯基(—SNO)。其作用机制有两种:1)NO·与O2作用生成·NO2,NO·再与·NO2生成三氧化二氮(N2O3),N2O3与蛋白质巯基进一步反应生成—SNO[27]。2)·NO2对蛋白质巯基进行单电子氧化生成巯基自由基,巯基自由基与NO·进一步反应生成—SNO[28]。除此之外,蛋白质氨基酸残基也容易被RNS氧化修饰,如半胱氨酸、蛋氨酸和酪氨酸[29]。
2.2.3 脂质过氧化产物介导的蛋白质氧化机制
脂质氧化与蛋白质氧化均为自由基链式反应,脂质氧化过程中产生的自由基和氢过氧化物都能够促进蛋白质氧化[30]。脂质过氧化物介导的蛋白质氧化主要以两种方式进行:1)脂质氧化过程中产生的自由基或氢过氧化物等活性物质攻击蛋白质氨基酸侧链,诱导蛋白质氧化(引发、传递、抽氢)(表1)。2)脂质氧化产物直接与蛋白质反应,诱导蛋白质氧化(延伸、复合)(表1)。如MDA可以与蛋白质残基共价结合,使蛋白质结构发生改变[31];丙烯醛可以引起肌原纤维蛋白氧化修饰,导致蛋白质糖基化、巯基含量减少[32]。

表1 脂质氧化介导蛋白质氧化的可能作用机制Table1 Possible mechanism of lipid oxidation-mediated protein oxidation
3 体内氧化蛋白的积累
3.1 体内蛋白质氧化导致的积累
蛋白质氧化是机体进行有氧代谢的必然结果。一般来说细胞中氧化蛋白的积累主要是细胞代谢异常造成的。机体中蛋白合成与蛋白降解之间的动态平衡失调导致一些蛋白质无法降解,从而引起氧化蛋白在体内的积累。体内氧化还原稳态的维持受多种因素影响,其中包括细胞生成和自由基清除速率、内源性和外源性抗氧化剂的含量以及一些催化降解蛋白质溶酶体的状态[33]。细胞内蛋白被氧化修饰后,会导致蛋白功能丧失且抗酶解。除此之外,一些蛋白氧化产物还能抑制蛋白酶降解其他蛋白[34]。如果氧化蛋白在细胞内不能及时清除和修复,会在细胞内积累并破坏细胞生理功能,导致疾病的产生,如帕金森病、阿尔茨海默病、哮喘、动脉粥样硬化等[35]。蛋白质氧化产物的积累还可能是由于机体在进行呼吸代谢时产生的ROS对蛋白质进行氧化修饰从而导致水解性降低和加重蛋白聚集。
3.2 膳食中蛋白质氧化导致的积累
蛋白质氧化是导致食品在加工和贮藏过程中品质下降的主要原因之一,蛋白质在加工和贮藏过程中会受到高温、挤压和光照等物理因素的影响,从而导致蛋白氧化。膳食中蛋白被氧化后会引起其消化率降低和某些必需氨基酸的损失,从而引起食物的营养品质下降。有研究发现,当机体摄入大量蛋白质后,由于胃肠道中的ROS和酸性环境的存在,蛋白质会持续受到氧化损伤,在机体内进一步氧化。同时,Gu Chunmei等[36]研究发现摄入大量蛋白质可以通过破坏氧化剂和抗氧化剂的平衡来加剧自由基对胰腺功能的氧化损伤。在摄入过量蛋白质和半胱胺的实验组中,大鼠氧化应激状况减轻并且胰腺功能得到改善。高蛋白饮食引起氧化应激的机制可能与氧化剂和抗氧化剂系统失衡有关,而抗氧化系统的失衡和自由基含量的增加必然会使体内蛋白质氧化损伤。除此之外,有研究发现机体摄入氧化蛋白后,氧化蛋白会暴露在肠道黏膜,在小肠吸收并随着血液输送至机体各个部位[37]。Gurer-Orhan等[38]研究发现,氧化氨基酸会掺杂在机体蛋白质合成过程中,从而导致细胞凋亡,该学者还强调蛋白质翻译后氧化修饰不是造成体内蛋白质氧化修饰的唯一原因,外源性氧化氨基酸也可能会被用来合成蛋白质,从而使蛋白质具有毒性。因此可以推测食源性氧化蛋白可能会被机体所利用和堆积,从而导致体内蛋白质氧化产物积累。
4 膳食氧化蛋白对机体健康的影响
蛋白质中氨基酸比例直接关系到人体合成蛋白质和机体健康。膳食蛋白来源主要分为动物性蛋白和植物性蛋白。蛋白质来源不同,其氨基酸组成和含量也不同。有研究表明,不同来源的蛋白质在体外模拟消化后生成的肽也存在差异,因此摄入不同来源蛋白质会对机体生理功能造成不同影响[39]。Song Shangxin等[40]研究发现,短期摄入牛肉、鸡肉和鱼肉蛋白对大鼠脂质代谢和胰岛素抵抗有一定的积极作用,但长期摄入肉类蛋白会提高大鼠心血管疾病的发生几率。植物蛋白具有降低胆固醇、心血管疾病和高脂的风险,然而过量食用植物蛋白同样也会对机体造成负面影响。大量摄入植物蛋白会使肠道菌群中益生菌丰度下降,有害菌丰度上升。吴秋萍等[41]探究了氧化大豆蛋白对大鼠体内自由基及抗氧化能力的影响,结果发现摄入氧化大豆蛋白会导致小鼠机体自由基水平增加,且抗氧化能力下降。在添加抗氧化剂硫辛酸后,小鼠体内氧化应激现象减轻。因此,无论是植物蛋白还是动物蛋白氧化修饰后,均会对机体造成负面影响。
4.1 膳食中氧化蛋白对机体氧化应激的影响
在正常生理状况下,内源性抗氧化系统可以抵抗体内ROS的生成和危害,维持细胞稳定。在机体摄入氧化蛋白后,由于蛋白质会在机体中继续受到氧化损伤,会使机体内RNS和ROS自由基数量急剧上升,从而使体内抗氧化系统失衡,导致氧化应激。林诗曼[42]探究饲喂加工氧化猪肉对小鼠健康的影响,结果发现长期饲喂高氧化猪肉会导致小鼠体内氧化还原状态失衡;同时研究还发现,摄入氧化蛋白会增加机体ROS含量和下调与机体抗氧化机制有关的Nrf2基因表达。吴伶艳[14]研究发现短期饲喂氧化酪蛋白的小鼠,血液中的自由基含量显著升高,同时体内谷胱甘肽含量下降,从而引起小鼠机体氧化应激。继续饲喂小鼠,发现小鼠的记忆能力受损,且血液和组织器官的氧化还原状态失衡。
氧化蛋白的直接摄入可能不是导致体内氧化应激的唯一外源性因素。胃作为食物消化的场所,其酸性环境、促氧化剂(如铁离子和血红素等)和自由基含量会引起食物中的蛋白质在胃肠道发生氧化修饰,因此大量摄入蛋白质、脂质和其他促氧化剂同样有可能引起机体氧化应激。Kanner等[10]研究发现胃中的脂质氧化产物会引起氧化应激,其机制可能是MDA被血液系统吸收后,与体内蛋白反应形成加合物,生成高级脂质过氧化产物,从而导致氧化应激。Turner等[43]研究发现摄入大量红肉和乳制品均会引起大鼠体内氧化应激。陈佳[44]研究饲喂不同来源肉类对大鼠免疫系统的影响,结果发现,长期食用羊肉、狗肉和鸭肉均会导致大鼠抗氧化能力下降。这可能是由于肉类是摄入动物蛋白的主要来源,而肉中含有血红素、肌红蛋白和铁离子等促氧化剂,在胃部酸性环境下能促进蛋白质氧化,产生氧化产物和自由基,引起机体氧化应激。
通过上述研究发现,膳食氧化蛋白对机体氧化应激的影响机制可能包括:1)摄入氧化蛋白会导致机体内ROS含量增加,超出机体清除ROS的能力;2)体内谷胱甘肽等抗氧化剂活性和含量下降,导致体内抗氧化系统失衡。
4.2 膳食中氧化蛋白对机体肠道健康的影响
肠道作为人体重要的消化器官,与人体健康有着直接联系,而肠道健康与肠道菌群及局部氧化还原状态有着密切联系。有研究表明,摄入氧化蛋白会改变肠道菌群丰度、诱导肠道氧化应激并出现局部病理变化[45]。Keshavarzian等[46]研究发现炎症性肠病(inflammatory bowel disease,IBD)的严重程度与结肠黏膜组织和细胞骨架蛋白氧化相关,这表明IBD的发病机制可能是通过氧化反应破坏细胞骨架实现。并且该作者还强调肠黏膜的氧化损伤与肠腔内所含有的食物成分有关。在另一项研究中发现,小鼠食用抗氧化剂能够减轻IBD[47]。Xie等[48]研究发现,高级氧化蛋白产物(advanced oxidation protein products,AOPPs)能够通过诱导组织损伤促进IBD的发生,向大鼠腹膜内注射氧化蛋白可通过氧化还原依赖性途径提高局部肠组织和血液中AOPPs的含量,从而诱导肠上皮细胞凋亡。这些研究结果证明,蛋白质氧化产物可能与氧化应激从腔相向肠黏膜的固有层的转移有关,从而促进IBD的发生,影响肠道健康。
肠道菌群被称作人体的“第二基因组”,在长期的发展过程中与宿主之间形成了一种共生关系。肠道菌群与宿主之间存在能量、物质和信息的传递,且肠道菌群在维持宿主免疫反应中发挥着重要作用[49]。肠道微环境会随宿主年龄、饮食结构等因素发生改变,其中肠道菌群的构成和数量也会发生变化。如大量食肉者的肠道菌群主要以普拉氏梭杆菌为主,而素食主义者的肠道菌群以多枝梭菌和产气荚膜梭菌为主[50]。肠道菌群的构成与失衡能够直接影响宿主包括肥胖、IBD和糖尿病等多种与代谢过程相关疾病的病理状态,所以肠道菌群在膳食和宿主之间起到了重要的桥梁作用。有研究发现,肠道微生物可以发酵未被消化吸收的蛋白质,产生对机体有害的物质如硫化氢、氨气和胺类等,而硫化氢和一些生物胺存在毒性,会影响宿主的肠道健康和肠道菌群结构[51]。因此蛋白质摄入量也会引起肠道菌群的变化。表2为高蛋白饮食对肠道菌群丰度的影响,在提高蛋白质摄入量后,可以发现机体肠道中双歧杆菌丰度出现下降,乳杆菌和一些致病菌丰度出现上升。而双歧杆菌有助于产生丁酸和乳酸等代谢产物,可以使肠道微环境pH值下降,抑制致病菌在肠道定植,因此双歧杆菌丰度下降不利于机体肠道健康。
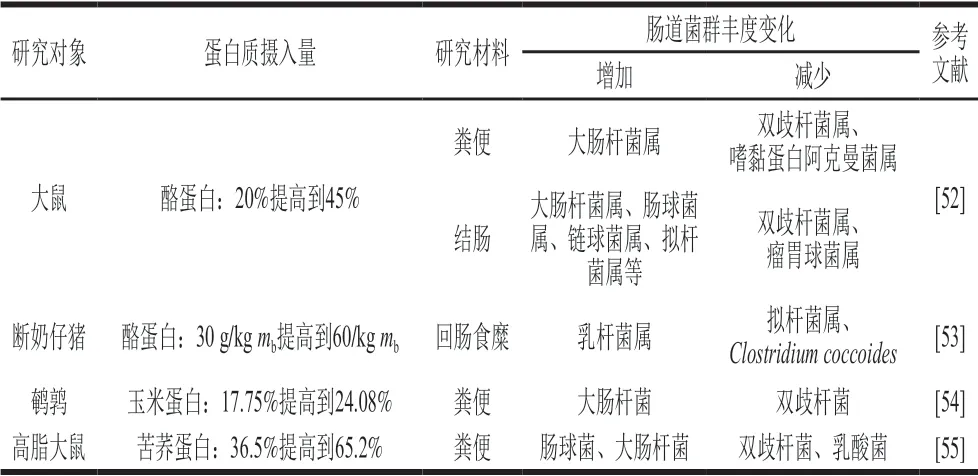
表2 高蛋白饮食对肠道菌群的影响Table2 Effect of high-protein diet on intestinal flora
食物中蛋白质受到氧化修饰后会导致食物蛋白消化率降低,从而增加结肠内蛋白质含量,蛋白质被结肠菌群发酵培养后会产生潜在致突变产物,进而改变肠道菌群结构。Al-Hilaly 等[56]研究发现高蛋白饮食及其衍生蛋白质氧化产物可引起肠道菌群紊乱、肠组织氧化还原状态失衡和局部病理发作,使肠黏膜更加敏感。方伟[57]探究了氧化蛋白对肠道菌群的影响,结果发现摄入氧化酪蛋白会降低小鼠结肠乳杆菌丰度和增加大肠杆菌、肠球菌丰度。其推测可能是由于氧化蛋白改变了肠道培养底物从而改变了肠道菌群结构。林诗曼[42]以不同氧化程度的猪肉饲喂小鼠,发现饲喂高氧化猪肉的小鼠肠道中嗜黏蛋白阿克曼菌和乳杆菌丰度明显下降,而大肠杆菌丰度出现上升。同样也有研究表明食物中氧化蛋白会导致小鼠结肠中有害菌丰度上升,双歧杆菌、乳杆菌等有益菌丰度下降[58]。在以上研究结果中均出现了益生菌丰度下降和有害菌丰度上升的现象,肠道中益生菌能够上调紧密连接蛋白表达,具有保护肠黏膜屏障完整性的作用,同时益生菌也能有效抑制致病菌定植,降低肠道ROS含量,从而抑制肠道炎症产生[59]。相反,肠道中大肠杆菌具有释放ROS的作用,而ROS可以直接作用于肠上皮细胞,导致细胞膜上的磷脂层发生脂质过氧化和诱导紧密连接蛋白发生氧化修饰,从而使肠上皮细胞通透性增强,进而引发炎症。
摄入氧化蛋白对肠道健康的影响机制如图2所示,1)摄入氧化蛋白使肠道ROS含量增加,从而攻击肠道紧密连接蛋白,影响肠道屏障功能。2)摄入氧化蛋白导致肠道内益生菌丰度下降和有害菌丰度上升,并促进肠道内ROS含量上升和下调与紧密连接蛋白相关的基因表达。
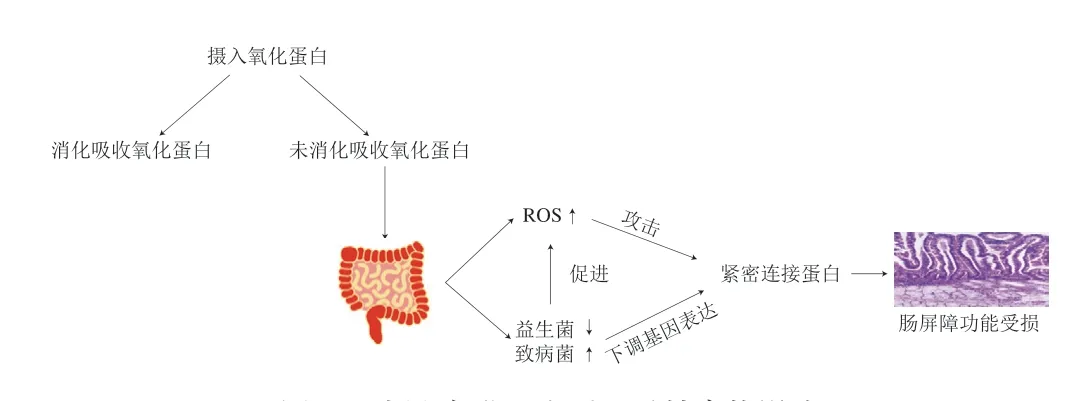
图2 摄入氧化蛋白对肠道健康的影响Fig. 2 Effect of oxidized protein intake on intestinal health
4.3 膳食中氧化蛋白对机体器官功能的影响
近年来,有许多学者利用动物实验研究氧化蛋白对机体器官功能的影响,但研究主要集中在氧化酪氨酸方面。酪氨酸易被氧化修饰形成Dityr、3-NT等物质,研究表明Dityr与高血压[60]、炎症[61]和神经退行性疾病[62]等疾病密切相关。3-NT是酪氨酸残基硝基化的产物,体外和体内实验均证实了3-NT能诱导多巴胺细胞凋亡,造成神经损伤[63],Dityr和3-NT也被认为是机体氧化应激的新型标志物[64]。Yang Yuhui等[65]探究了摄入双酪氨酸对大鼠机体氧化应激的影响,结果发现大鼠血浆中脂质和蛋白质氧化标记物水平升高,内源性抗氧化酶的合成和活性降低。此外,大鼠系统性代谢过程也受到影响,如能量代谢加速、VB3代谢改变和肠道菌群失调。在进一步研究中,Yang Yuhui等[66]采用代谢组学分析了膳食氧化酪氨酸对大鼠健康的影响,结果发现大鼠发生肝损伤和肾功能障碍,肠道微生物菌群功能紊乱,同时大鼠心血管疾病的患病几率增加,证实持续摄入氧化酪氨酸会对机体健康产生负面影响。Li Zhuqing等[67]研究了摄入不同周期和不同剂量氧化酪蛋白对大鼠肝脏纤维化的影响,结果发现摄入不同周期和不同剂量的氧化酪蛋白均会导致大鼠摄食量和体质量下降,肝脏中脂质氧化产物和蛋白质氧化产物存在积累现象,且肝脏抗氧化能力下降,从而引起大鼠机体氧化应激。在另一项研究中,Li Zhuqing等[68]探究了酪氨酸氧化产物对大鼠肾脏纤维化的影响,实验结果同样出现了肾脏氧化指标上升和抗氧化能力下降等现象,并且肾脏和肝脏出现纤维化病变。在探讨机制时发现,摄入氧化酪蛋白导致纤维化均是通过炎症因子和氧化应激触发丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)磷酸化,从而激活MAPKs/TGF-β1/Smads信号通路,引起纤维化病变。长期摄入酪氨酸氧化产物不仅会对机体肝脏、肾脏造成损伤,还会引起心肌组织功能受损。赵琪[3]探究了酪氨酸氧化产物对大鼠心肌组织氧化损伤的影响,结果发现短期和长期摄入氧化酪氨酸均会造成大鼠心肌组织出现氧化产物累积和氧化损伤现象,且随着摄入时间延长和剂量的增加,心肌组织受损程度愈加严重。
综上所述,膳食氧化蛋白对机体器官功能影响机制可能在于:1)摄入氧化蛋白会下调与抗氧化相关基因的表达,导致机体抗氧化系统失衡;2)摄入氧化蛋白导致氧化产物在体内积累,引起体内组织产生氧化应激。
4.4 膳食中氧化蛋白对慢性病的影响
与衰老相关的多种慢性疾病如糖尿病、阿尔茨海默病等都涉及氧化蛋白在体内的积累。然而在大多数情况下,膳食氧化蛋白在疾病的发作和发展中的作用还尚待研究。甲状腺激素与胰岛素的合成和分泌息息相关,甲状腺激素分泌过少会引起高血糖及胰岛素分泌不足等现象,并且恢复甲状腺功能被认为是治疗糖尿病的重要治疗手段之一[69]。Ding Yinyi等[70]研究了氧化酪氨酸产物对大鼠胰腺分泌胰岛素的影响,结果发现饲喂Dityr会导致大鼠血浆中胰岛素水平下降,同时胰腺中脂质氧化产物和蛋白质氧化产物增加,抗氧化酶活性下降,从而导致胰岛素合成减少。其推测膳食氧化酪蛋白触发的胰岛素分泌减少可能是胰腺β细胞的氧化应激和线粒体损伤所导致的。在进一步探究胰岛素合成减少机制时发现,Dityr与三碘甲状腺氨酸(triiodothyronine,T3)的化学结构相似,且Dityr与T3在甲状腺激素受体β1的结合位点相同,可能存在竞争性结合关系。此外,Dityr抑制了胰腺细胞转运T3的能力和T3对Akt磷酸化的刺激作用,同时抑制了T3对哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)及其下游基因的调控作用,从而减弱了T3对胰岛素合成的调节能力[71]。阿尔茨海默病是一种神经退行性疾病,其主要症状为记忆能力减退、认知功能障碍等。有研究发现,氧化应激在阿尔茨海默病、认知功能障碍等病症的发病机制中发挥着重要作用。Ran Yumei等[72]探究了长期饲喂Dityr对大鼠学习记忆能力的影响,结果发现长期摄入Dityr会导致大鼠海马组织中的脂质氧化产物和蛋白质氧化产物出现明显积累,且表现出对水迷宫空间学习与记忆的障碍,在进一步的研究中发现,摄入Dityr会下调大鼠海马组织中与学习记忆相关基因的表达,从而影响大鼠的学习记忆能力。
5 预防氧化蛋白引起损伤的调控措施
5.1 天然抗氧化剂的使用
天然抗氧化剂广泛存在于蔬菜、水果和天然香辛料等植物中,其具有安全性高、副作用小和易获取等优点。天然抗氧化剂通常包括多酚类、黄酮类、醛类等,这些物质可以用于抑制蛋白质氧化和脂质氧化,蛋白质氧化与脂质氧化类似,属于自由基链式反应。植物中的多酚物质可以清除自由基、非自由基衍生物和螯合过渡金属离子,抑制自由基链式反应,从而达到减轻蛋白质氧化的效果[73]。研究发现,摄入多酚物质可以达到预防疾病和缓解疾病的作用。Arcanjo等[74]研究了乙二醛和甲基乙二醛存在的条件下,白藜芦醇对人血清白蛋白的抗氧化作用。结果发现,白藜芦醇能有效抑制人血清白蛋白的糖基化和巯基损失。Sirota等[75]探究了咖啡多酚在胃介质中抑制食物脂质过氧化的能力以及在进食红肉时饮用咖啡对人血浆中MDA积累的影响,结果发现,咖啡多酚能够有效抑制餐后胃中的脂质过氧化,从而防止机体餐后吸收MDA并抑制血浆MDA积累。此外,上述研究还表明餐后饮用咖啡有利于机体健康。因此,人们日常饮食中可以增加富含天然抗氧化剂的果蔬摄入量,以预防体内氧化应激现象的发生。
5.2 控制动物饲料组成
肉作为人们摄入蛋白质的主要来源,其氧化程度对肉制品加工具有重要影响。饲料组成与动物机体氧化还原状态有关。在动物饲料中添加多酚、类胡萝卜素和维生素等能有效抑制动物宰后蛋白质氧化程度。Santé-Lhoutellier等[76]研究发现,饲喂牧草的羔羊宰后贮藏过程中蛋白质氧化程度要远低于饲喂饲料的羔羊。此外,研究表明由富含VE饲料喂养的猪制成的干腌肉制品中蛋白质氧化程度也明显低于由常规饲料喂养的实验组[77]。由此可见,通过动物饲料控制鲜肉及肉制品加工和贮藏期间的蛋白质氧化程度,从而减少人体氧化蛋白的摄入量是一个不错的选择。
6 结 语
蛋白质作为机体维持生命活动的重要营养成分,与机体健康有着密不可分的关系。食品领域主要的研究集中在蛋白质氧化对蛋白质结构、蛋白质消化率和食品品质的影响,而缺少食源性氧化蛋白对机体健康影响的研究。尽管已有多数体外实验和动物实验结果证明膳食氧化蛋白会对机体健康造成不同程度的影响,但其发病机制还尚未明确。想要明确膳食蛋白如何影响机体健康,未来还应从以下几个方面进行研究。1)从食品源头出发,明确食物中蛋白质氧化机制及其氧化产物的生物学效应,以及脂质氧化产物、蛋白质氧化产物与美拉德反应产物之间的相互作用。2)目前膳食氧化蛋白的研究方向主要集中在酪氨酸,未来还应研究其他几种易被氧化修饰的氨基酸及其产物对机体健康的影响。3)可以运用同位素标记的氧化蛋白对动物进行灌胃处理,探究食源性氧化产物在机体的分布状况、吸收机制、代谢途径及不同氧化产物的排泄速度。4)明确氧化产物对机体抗氧化系统、肠道微生物菌群和代谢的影响机制,分析不同
蛋白质的差异氨基酸对机体健康的影响,以及肠道菌群与机体代谢、氧化应激的关系。5)由于体外消化实验无法模拟化合物的吸收和肠道微生物之间的相互作用,因此还需要将体外消化实验、动物实验和营养研究模型相结合,全面阐明氧化蛋白在消化吸收过程中对人体健康的影响。最后,在明确氧化蛋白对机体健康影响的机制之后,还应进一步研究人体膳食氧化蛋白的安全剂量以及简单有效的饮食预防手段以减缓机体的氧化应激。
