食品中金刚烷胺残留检测方法新进展
2021-10-31赖科洋
彭 娟,赖科洋
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330031)
金刚烷胺是一种抑制流感病毒的抗病毒药物,其分子式为C10H17N,结构如图1所示,相对分子质量为151,易溶于有机溶剂,不溶于水,无嗅无味。金刚烷胺具有良好的抗病毒能力,曾经大量用于预防和治疗猪传染性胃肠炎和禽流感[1]。近年来的研究表明,A型流感病毒对金刚烷胺的耐药性逐渐凸显[2-3]。卢桂兰等[4]分析了2008—2011年连续3 个流感监测季80 株儿童甲型H3N2流感毒株金刚烷胺类耐药情况,结果显示甲型H3N2流感毒株耐药率分别为88%、100%和100%。周妍等[5]对2009—2012年上海地区儿童甲型H3N2流感病毒的耐药性进行监测,结果表明,测序的病毒株对金刚烷胺耐药率达到100%。长期滥用金刚烷胺会提高流感病毒株的耐药性,进而危害人类健康。因此,2005年农业部发布第560号公告,金刚烷胺类等人用抗病毒药物移植兽用,缺乏科学规范、安全有效的实验数据,用于动物病毒性疫病不但给动物疫病控制带来不良后果,而且影响国家动物疫病防控政策的实施,禁止金刚烷胺在畜禽养殖业中的销售和流通。然而,近年来食品中金刚烷胺检出事件仍时有发生。长沙河马市集商贸有限公司销售的农家鸡[6]、湖南牧胜飞农副产品贸易有限公司生产的农家鸡蛋[7]、重庆明品福冷链物流公司的冻鸡大腿[8]、拉萨堆龙德盛普惠农业科技发展有限公司销售的公鸡[9]和山东的粉壳鸡蛋[10]被检出含有禁用药物金刚烷胺。杨琳芬等[11]随机检测了606 批次禽蛋和278 批次禽肉,检出3 批金刚烷胺阳性样品。齐刚等[12]对12 批鸡蛋样品进行了检测,检出2 批金刚烷胺阳性样品。程静等[13]2017—2018年在内蒙古地区采集鸡蛋60 份、鸡肉60 份,总共检出26 份金刚烷胺阳性样品,检出率达21.7%。由此可见,目前食品中金刚烷胺仍在非法使用,需要严格管控。为了更有效地监管金刚烷胺,保障食品安全,近年来我国先后制定了食品中金刚烷胺检测的国家标准、行业标准和地方标准(表1)。

图1 金刚烷胺结构式Fig. 1 Structural formula of AMD

表1 食品中金刚烷胺检测的国家标准、行业标准和地方标准Table1 National standard, industrial standard, and local standards for the detection of AMD in foods
由此可见,现行标准中金刚烷胺残留的确证方法是液相色谱-质谱联用法,快速筛选方法可以选择酶联免疫吸附法。近年来,金刚烷胺残留检测方法的研究得到了学者们的关注,张颖颖等[20]介绍了食品中多种抗病毒类药物残留检测方法的研究进展,如采用酶联免疫吸附测定法、色谱法、光谱法、电化学传感器检测法和芯片法检测金刚烷胺和金刚乙胺等,其中重点介绍了色谱检测法。本文专注于金刚烷胺残留检测,在简要介绍传统检测方法的基础上,重点对基于抗原抗体反应的新型免疫分析法和基于金刚烷胺分子印迹的检测新方法进行了论述和分析。
1 金刚烷胺残留检测的传统方法
1.1 高效液相色谱法
高效液相色谱法是利用液体作流动相的分析方法。液体样本被注入色谱柱,通过压力在固定相中移动,不同物质与色谱柱中固定相的作用力不同,导致从色谱柱中流出时间不同而进行分离。根据出峰时间可对化合物进行定性分析;根据峰面积可对化合物进行定量分析。高效液相色谱法适用于分析不易挥发、不同极性的有机化合物。
Zhang Jinzhen等[21]建立了高效液相色谱法检测蜂蜜中的金刚烷胺。蜂蜜先用固相萃取小柱净化,再用4-氟-7-硝基-2,1,3-苯并恶二唑衍生,用C18色谱柱分离后用荧光检测器检测(激发波长470 nm、发射波长530 nm)。优化参数后高效液相色谱法最低检测限是0.008 μg/g,线性范围是0.025~1.000 μg/mL,回收率在90%以上,批内相对偏差和批间相对偏差范围是3.4%~5.1%。
1.2 液相色谱-质谱联用法
液相色谱-质谱联用法是一种将液相色谱法和质谱法有机整合的分析方法。液体样本经过液相色谱分离后进入质谱仪,液相色谱作为分离系统,质谱作为检测系统。液相色谱-质谱联用法体现了色谱和质谱优势的互补,将色谱对复杂样品的高分离能力,与质谱具有高选择性、高灵敏度及能够提供相对分子质量与结构信息的优点结合起来,是一种应用最广的确证方法。液相色谱-质谱联用法是一种灵敏准确的确证法,大量应用于鸡蛋[22-23]、禽肉[24-30]、猪肉[31]、牛奶[32]、蜂蜜[33]和水产品[34-35]中金刚烷胺的检测。
Tsuruoka等[36]建立了检测油炸鸡、煎鹌鹑蛋、烤鸡、鸡肝、鸡肫和鸡蛋中金刚烷胺的液相色谱-质谱联用法。该方法对这些样本的定量检测限均为1.0 μg/kg,回收率为79.9%~91.5%,相对标准偏差为1.2%~3.6%。
Tumipseed等[37]建立了液相色谱-质谱联用法检测鸡肉干、鸡肉块和鸡肉球中的金刚烷胺,2.5~50 μg/kg水平的添加回收率为76%~123%(氘标记内标,相对标准偏差均小于12%),实际样本的检测发现,金刚烷胺含量有的小于2.5 μg/kg,有的大于600 μg/kg。
1.3 酶联免疫吸附法
酶联免疫吸附法是利用酶(通常为辣根过氧化物酶或碱性磷酸酶)标记抗体或抗原以检测相应抗原或抗体的一种免疫学分析方法。首先将抗原或抗体结合到酶标板的固相表面,再加入相对应酶标抗体或酶标抗原。酶标抗体或酶标抗原可以与固相表面的抗原或抗体结合,加入底物后,底物被酶标抗体或酶标抗原上的酶催化为有色产物,有色产物的吸光度与受检抗体或抗原的量成比例,故可根据吸光度来定性或定量分析。酶联免疫吸附法具有灵敏性强、特异性高、重复性好、检测速度快的特点。
要建立高灵敏度的酶联免疫吸附法需要制备合格的检测抗原和抗体。范素菊等[38]对金刚烷胺进行改造,合成了免疫抗原,用免疫抗原免疫小鼠,经细胞融合,获得金刚烷胺杂交瘤,将细胞株注射小鼠腹腔得到腹水,腹水对金刚烷胺的半抑制浓度(the half maximal inhibitory concentration,IC50)为1.02 μg/L,只与金刚乙胺有9.82%的交叉反应率。
谭庶等[39]自主制备了检测抗原和抗体,建立了一种传统的酶联免疫吸附法检测鸡肉中的金刚烷胺,方法的检出限为0.21 μg/L,线性范围为0.07~6.15 μg/L,实际鸡肉样本的添加回收率为101.69%~108.71%,批间和批内变异系数均低于15%。除金刚乙胺外,与其余结构及功能类似物均无交叉反应,方法特异性好;实际样品检测中,酶联免疫吸附法与液相色谱-质谱联用法检测结果符合,整个检测反应时间需60 min左右。实验建立的金刚烷胺酶联免疫吸附法的准确度、精密度、灵敏度较高,可用于鸡肉中金刚烷胺残留的快速定量检测。
崔乃元等[40]建立了一种同时检测鸡肉、鸭肉中金刚烷胺等结构类似物的酶联免疫吸附法。金刚烷胺的最低检测限分别为0.57 μg/kg(鸡肉)和0.59 μg/kg(鸭肉);最低定量限分别为0.85 μg/kg(鸡肉)和0.94 μg/kg(鸭肉),添加回收率为87%~98%。
Xie Sanlei等[41]选择了抗金刚烷胺的单链抗体,通过生物素-链霉亲和素系统介导与辣根过氧化物酶偶联,再与金刚烷胺功能化磁珠结合形成免疫复合物,借助于生物素-链霉亲和素放大体系和免疫磁富集体系,相比传统酶联免疫吸附法的最低检测限(8.4 ng/mL),灵敏度有了明显提高(最低检测限0.64 ng/mL)。
1.4 免疫层析法
免疫层析法是一种以硝酸纤维素膜为固相载体的分析方法,以胶体金(或其他显色材料)为标记物与抗体结合,加样后在硝酸纤维素膜毛细管作用下泳动,在硝酸纤维素膜的检测线和质控线上发生高度特异性抗原抗体反应,显示肉眼可见的红色条带(或其他色带),从而实现对待测物的定性或定量分析。免疫层析法具有操作简便、经济适用、方便基层的优势,适用于金刚烷胺的快速检测[42-43]。
Wu Songsong等[44]制备了胶体金免疫层析试纸条检测鸡肉中的金刚烷胺,检测时间只需要12 min。基于便携式胶体金读取仪,方法的最低检测限为1.8 ng/mL,线性范围为2.5~25 ng/mL,平均回收率为81%~120%,批内、批间的相对标准偏差都小于15%,胶体金免疫层析试纸条的检测结果和液相色谱-质谱联用法的检测结果符合。
1.5 化学发光免疫分析法
化学发光免疫分析法是将具有高灵敏度的化学发光检测技术与高特异性的免疫反应相结合的分析方法,具有灵敏度高、检测范围宽、自动化程度高等优点。
崔廷婷等[45]将金刚烷胺单克隆抗体与磁珠偶联形成金刚烷胺免疫磁珠,然后加入待测样品和辣根过氧化物酶标记的金刚烷胺抗原。待测样品中的金刚烷胺和辣根过氧化物酶标记的金刚烷胺抗原竞争结合金刚烷胺免疫磁珠上的抗体,磁分离后加入化学发光底物A液和B液,辣根过氧化物酶催化发光底物液产生化学发光,发光强度与待测样品中的金刚烷胺含量成反比。化学发光免疫分析法的线性范围是0.085~2.729 μg/L。金刚烷胺在猪肉中的检测限为0.1 μg/kg,平均添加回收率为80.2%~94.5%,批内、批间相对标准偏差均小于10%。
许小炫等[46]建立了同时检测鸡肉、鸭肉、鸽肉中金刚烷胺等两种兽药的化学发光免疫分析法,采用碳酸钾和乙酸乙酯同时提取,检测金刚烷胺时,方法的最低定量限为0.06 μg/L,线性范围为0.06~1.77 μg/L,添加回收率为92.55%~105.14%,变异系数均低于10.48%。
2 新型检测方法
2.1 基于免疫学反应的检测新方法
基于特异性抗原抗体反应,最近出现了多种多样的新型免疫分析法。Zhu Fangfei等[47]基于DNA碱基互补配对和非共价交联胶体金建立了一种新型免疫分析法检测金刚烷胺。如图2所示,首先将金刚烷胺人工抗原包被在酶标孔内,将金刚烷胺抗体和引物1偶联在胶体金表面形成抗体-胶体金-引物1免疫复合物,将此免疫复合物和金刚烷胺标准品(或待检样本)同时加入酶标孔,包被在酶标孔内的人工抗原和金刚烷胺共同竞争免疫复合物中有限的抗体,经过洗板,再加入与引物1互补的引物2进行杂交配对。随后吸取上清中游离的引物2,先后向其中加入胶体金和NaCl溶液,根据胶体金溶液颜色变化检测金刚烷胺的浓度。单链DNA(引物2)能提高胶体金对盐离子的耐受能力,胶体金表面的单链DNA含量越高,胶体金对盐离子的耐受能力越强。样本中金刚烷胺浓度的提高将减少与包被在酶标孔内人工抗原结合的免疫复合物的量,从而导致引物1的量减少,与引物1结合的引物2的量也随之减少,因此游离的引物2的量将提高,使得胶体金对盐离子的耐受能力增强,使胶体金保持红色,反之胶体金溶液聚集变蓝。此方法检测金刚烷胺的灵敏度可以达到0.033 μmol/L。
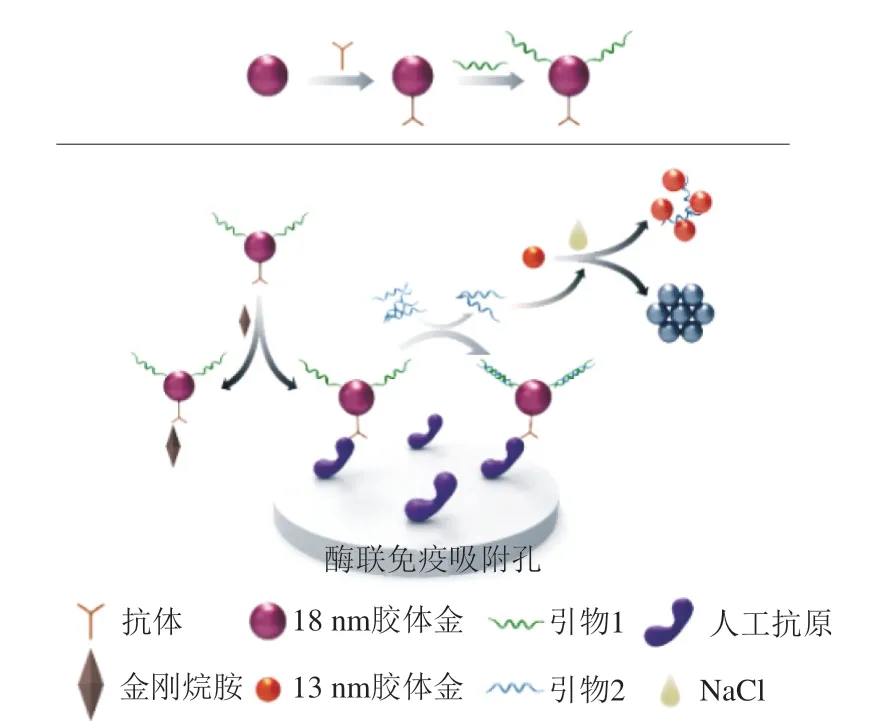
图2 基于DNA碱基互补配对和胶体金聚集检测金刚烷胺示意图[47]Fig. 2 Schematic illustration of the method based on DNA hybridization reaction and AuNPs aggregation for the detection of AMD[47]
Pan Mingfei等[48]基于抗原抗体反应,建立了新型表面等离子共振免疫抑制芯片法检测牛奶、鸡蛋、鸡肉和鸭肉中的金刚烷胺。如图3所示,表面等离子体共振(surface plasmon resonance,SPR)是一种物理光学现象,在发生全反射的芯片上涂上薄层金膜,由于金膜中有自由电子,它们不停在平衡位置附近振动,并具有一定的频率。检测抗原包被在芯片表面,当抗体和待检物质注射到微流孔中,在芯片表面会发生抗原-抗体反应,利用芯片表面的折射率的改变引起共振角的变化,来推断芯片表面的变化。检测器能跟踪检测溶液中的抗体与芯片表面上检测抗原的结合、解离整个过程的变化,最终确定金刚烷胺的浓度。方法的检测时间是6 min,最低检测限是1.3 ng/mL。每个芯片可以重复使用60 次,加标回收率为80.2%~102.9%,相对标准偏差小于5.2%,与液相色谱-质谱联用法检测结果的相关系数为0.98。
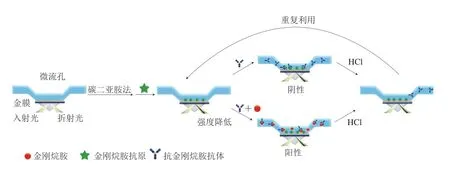
图3 等离子体共振免疫抑制芯片法检测金刚烷胺示意图[48]Fig. 3 Schematic illustration of the surface plasmon resonance immunosuppression chip for the detection of AMD[48]
Yun Yaguang等[49]设计了一种压电免疫传感器检测鸡蛋、鸡肉、鸭肉和猪肉中的金刚烷胺。这种压电免疫传感器基于免疫抑制原理,使用便携式石英晶体微天平芯片进行检测(图4)。石英晶片首先进行清洗和表面修饰,通过碳二亚胺法介导偶联检测抗原,加入抗体和待检物质后用石英晶体微天平可以获得物质吸附过程中频率的变化,频率的变化可以转化为质量的变化从而检测出金刚烷胺的质量浓度。方法的检测时间是5 min,最低检测限是1.3 ng/mL。每个芯片可重复使用20 次,加标回收率为83.2%~93.4%,相对标准偏差为2.4%~4.5%。
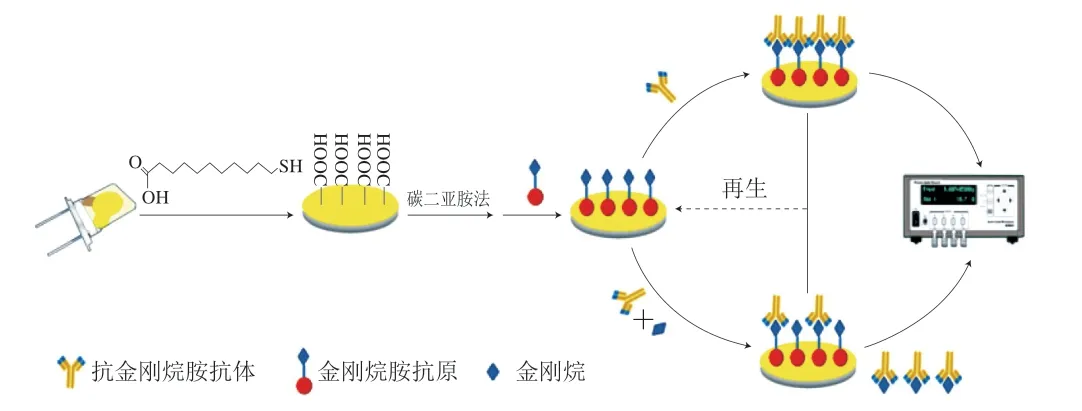
图4 压电免疫传感器法检测金刚烷胺示意图[49]Fig. 4 Schematic illustration of the quartz crystal microbalance immunosensor for AMD detection[49]
Ma Mingfang等[50]基于金花-二硫代双-(2-硝基苯甲酸)-金刚烷基乙二胺-牛血清白蛋白纳米探针,结合磁分离,建立了超灵敏表面增强拉曼散射免疫传感器均相检测方法(图5),可以一步完成鸡肉中金刚烷胺的检测。方法的最低检测限是0.005 ng/mL,加标回收率为74.76%~89.34%,相对标准偏差小于15.04%,方法的灵敏度比传统酶联免疫吸附法(应用同样的抗原和抗体)提高了两个数量级。

图5 表面增强拉曼散射方法检测金刚烷胺示意图[50]Fig. 5 Schematic illustration of the surface-enhanced Raman scattering for the detection of AMD[50]
Yu Wenbo等[51]建立了一种基于芬顿反应的可视化方法现场检测鸡肉中的金刚烷胺。在酶标孔中包被金刚烷胺检测抗原,加入金刚烷胺抗体和样本,完成竞争抑制免疫学反应后洗板,再分别加入葡萄糖氧化酶-二抗复合物、葡萄糖溶液、二价铁离子溶液、半胱氨酸溶液和红色的胶体金溶液。如果样本中没有金刚烷胺,金刚烷胺抗体将与酶标孔中包被的金刚烷胺检测抗原结合,葡萄糖氧化酶-二抗复合物将与金刚烷胺抗体结合而存在于酶标孔,葡萄糖氧化酶氧化葡萄糖后产生过氧化氢,过氧化氢与二价铁离子的混合溶液具有强氧化性,可以将半胱氨酸氧化,从而保护胶体金不聚集,胶体金保持红色。如果样本中金刚烷胺的量达到或超过最低检测限,葡萄糖氧化酶-二抗复合物将不能存在于酶标孔中,因此半胱氨酸不被葡萄糖氧化酶氧化,就能使红色的胶体金聚集并成为深紫色(图6)。经过3 轮信号放大,采用此方法裸眼判断的最低检测限是0.3 ng/mL。

图6 基于芬顿反应可视化检测金刚烷胺示意图[51]Fig. 6 Schematic illustration of colorimetric detection of AMD by Fenton reaction[51]
Dong Baolei等[52]基于传统的酶联免疫吸附法的竞争抑制原理,建立了一系列巧妙转换成荧光信号的新型免疫学方法。如图7所示,利用碳量子点的荧光内滤效应建立了一种检测鸡肉中的金刚烷胺的方法。辣根过氧化物酶可以催化无色的四甲基联苯胺变成蓝色的氧化产物。氧化产物的吸收峰与碳量子点的吸收峰重叠,通过内滤效应可以猝灭碳量子点的荧光信号,将传统的酶联免疫吸附法中氧化产物的发光信号转化成碳量子点的荧光信号,最低检测限达到0.02 ng/mL,从而提高了检测灵敏度。

图7 荧光酶联免疫吸附法检测金刚烷胺示意图[52]Fig. 7 Schematic illustration of fluorescent ELISA for the detection of AMD[52]
Dong Baolei等[53]将碱性磷酸酶催化底物变色的功能转化为控制碳量子点荧光猝灭,从而建立了另一种新型免疫学方法。通过自组装,碳量子点首先吸附在二氧化锰纳米片的表面(图8),碳量子点荧光被猝灭。碱性磷酸酶可催化2-磷酸抗坏血酸水解成抗坏血酸,并将二氧化锰纳米片还原分解,因此,吸附在二氧化锰纳米片的表面碳量子点游离出来而恢复荧光,荧光强度的变化与溶液中的金刚烷胺的浓度相关。这种荧光酶联免疫吸附法的最低检测限是0.035 ng/mL,线性范围是0.048~1.1 ng/mL。

图8 碳量子点荧光猝灭法检测金刚烷胺示意图[53]Fig. 8 Schematic illustration of carbon quantum dot fluorescent quenching for the detection of AMD[53]
Dong Baolei等[54]还建立了同时在鸡胸肉中检测两种禁用兽药的均相荧光酶联免疫吸附法。作者合成了具有丰富氨基的蓝色和绿色荧光碳量子点,将金刚烷胺检测抗原和氯霉素检测抗原偶联到碳量子点上形成荧光免疫探针,作为能量共振转移系统的能量供体。两维分别偶联金刚烷胺抗体和氯霉素抗体的二硫化钨纳米片具有较高的猝灭能力,是一种能量受体,如果样本中没有金刚烷胺或氯霉素存在,碳量子点上的金刚烷胺检测抗原或氯霉素检测抗原就会与二硫化钨纳米片上的金刚烷胺抗体或氯霉素抗体结合,碳量子点通过能量共振转移,将能量传给二硫化钨纳米片,荧光发生猝灭。如果样本中有金刚烷胺或氯霉素存在,金刚烷胺或氯霉素会先与二硫化钨纳米片上的金刚烷胺抗体或氯霉素抗体结合,碳量子点上的金刚烷胺检测抗原或氯霉素检测抗原就不能再与二硫化钨纳米片上的金刚烷胺抗体或氯霉素抗体结合,碳量子点因此和二硫化钨纳米片保持较远距离,不发生能量共振转移,荧光没有猝灭,从而保留较强的荧光信号(图9)。这种新型免疫学分析方法检测鸡胸肉中金刚烷胺时,最低检测限可以达到0.1 ng/g。

图9 基于荧光能量共振转移的均相免疫法检测金刚烷胺示意图[54]Fig. 9 Schematic illustration of homogeneous immunoassay based on fluorescence resonance energy transfer for the detection of AMD[54]
2.2 基于金刚烷胺分子印迹的检测新方法
近年来模拟抗体-抗原之间的相互作用,对金刚烷胺(印迹分子)进行专一识别,并利用荧光或电流等的变化进行检测的技术发展较快[55-58]。
Li Yan等[59]利用罗丹明6G与金刚烷胺的结构相似性,以罗丹明6G与金刚烷胺之间的竞争性主客体相互作用替代竞争性抗原抗体反应。作者合成了单[6-(2-氨基乙基)氨基-6-去氧]-β-环糊精(mono-[6-(2-aminoethylamino)-6-deoxy]-cyclodextin,EDA-CD)和氧化石墨烯,通过EDA-CD表面的氨基和氧化石墨烯表面的羧基共价偶联成EDA-CD-氧化石墨烯复合物,荧光材料罗丹明6G进入EDA-CD内部空穴后,由于罗丹明6G和EDA-CD-氧化石墨烯复合物之间的荧光能量共振转移而导致罗丹明6G荧光猝灭。当金刚烷胺加入到罗丹明6G-EDA-CD-氧化石墨烯复合物之中,会将罗丹明6G从EDA-CD内部空穴中竞争出来,可以重新检测到罗丹明6G的荧光信号(图10),根据荧光信号的强度可以确定金刚烷胺的浓度,方法最低检测限是0.005 mmol/L,线性范围是0.012 5~0.750 0 mmol/L。

图10 基于氧化石墨烯-环糊精复合物通过竞争性主客体相互作用检测金刚烷胺示意图[59]Fig. 10 Schematic illustration of the AMD fluorescence probing system based on graphene oxide-cyclodextin complex via competitive host-guest interaction for AMD detection[59]
Yun Yaguang等[60]成功设计了一种新型分子印迹电化学传感器检测鸡肉、鸡肝、猪肉、牛肉和羊肉中的金刚烷胺残留。通过循环伏安法在金电极表面上电沉积邻氨基硫酚而形成分子印迹膜(图11),分子印迹膜对金刚烷胺的印迹因子达到2.33,对其他3 种结构类似物的印迹因子分别是6.20、5.29和3.95。根据电流响应值可以测定金刚烷胺的浓度,方法的最低检测限是3.06×10-9mmol/L,线性范围是4.0×10-7~8.0×10-6mmol/L,真实样本的测量值与液相色谱-质谱联用法高度一致(R2>0.99)。

图11 金电极表面金刚烷胺分子印迹膜制备过程示意图[60]Fig. 11 Schematic illustration of the preparation process for AMDimprinted film on Au electrode surface[60]
Bardajee等[61]通过将谷胱甘肽修饰的量子点(CdTe/ZnS)嵌入海藻酸钠生物聚合物而合成了一种新型的有荧光的纳米复合材料(图12)。当一定浓度的金刚烷胺溶液加入到这种纳米复合材料后,纳米复合材料的荧光被有效猝灭。金刚烷胺是一种非荧光物质,它对荧光信号的猝灭可能是静态猝灭或动态猝灭。通过Stern-Volmer方程式的计算发现,荧光猝灭常数值随着温度的升高而升高,意味着量子点荧光信号被金刚烷胺猝灭是一种动态猝灭。研究证明在线性范围内,猝灭的程度与金刚烷胺的浓度成正比。基于这个原理建立了金刚烷胺的检测方法,方法的最低检测限是0.09×10-6mol/L,线性范围是3.1×10-6~27.9×10-6mol/L,方法的测量值与高效液相色谱法高度一致(相对标准偏差小于2.3%)。

图12 谷胱甘肽修饰-量子点复合物制备示意图[61]Fig. 12 Schematic illustration for the preparation of sodium alginate/quantum dots nanocomposites[61]
Pozo等[62]发现硫堇染料和金刚烷胺可以在流动注射分析系统中共同竞争葫芦[8]脲中的空穴(图13),流动注射分析系统根据硫堇染料荧光强度的变化从而间接检测金刚烷胺的浓度(图14)。方法的最低检测限是0.16 μmol/L,线性范围是0.5~2.4 μmol/L。每小时可以检测68 份样本,对真实样本进行检测时,方法的回收率为83%~98%。

图13 金刚烷胺、硫堇、葫芦[7]脲和葫芦[8]脲结构示意图[62]Fig. 13 Structures of AMD, thionine, cucurbit[7]uril, and cucurbit[8]uril[62]

图14 流动注射分析系统检测金刚烷胺示意图[62]Fig. 14 Schematic illustration for the detection of AMD by flow injection analysis system[62]
Xie Zhipeng等[63]建立了一种锥形纳米通道传感器定量检测金刚烷胺,通过自组装,作者构建了葫芦[7]脲-对甲苯胺复合膜。加入金刚烷胺溶液后,金刚烷胺会抢占复合膜的空穴,葫芦[7]脲将从葫芦[7]脲-对甲苯胺复合膜中游离出来,从而使纳米通道的疏水性有明显改变,进而影响离子电流,通过检测电流变化确定金刚烷胺溶液的浓度(图15)。方法的最低检测限是4.54 nmol/L,线性范围是10~1 000 nmol/L。采用这种检测方法,鸡肉样本的添加回收率为93.1%~107.8%(相对标准偏差为2.89%~7.99%),液相色谱-质谱联用法的添加回收率为92.3%~102.6%(相对标准偏差为1.9%~2.72%)。
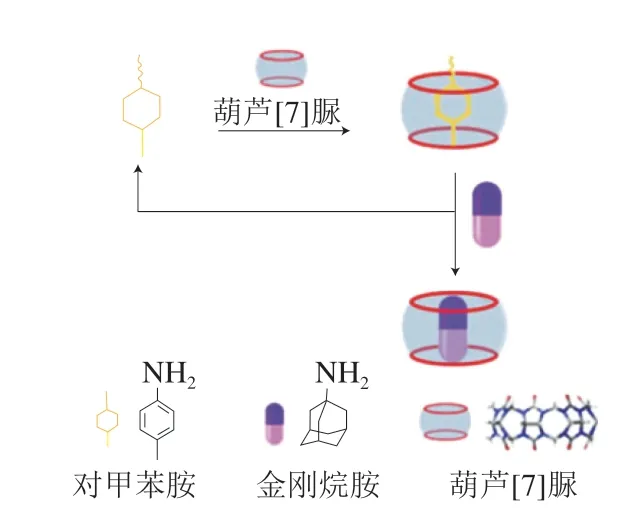
图15 纳米通道传感器法检测金刚烷胺示意图[63]Fig. 15 Schematic illustration for the detection of AMD by a nanochannel sensor[63]
3 结 语
尽管2005年农业部发布第560号公告,禁止金刚烷胺在畜禽养殖业中的销售和流通。但是近年来食品中金刚烷胺被检出的事件仍时有发生。快速、灵敏和准确的检测方法是监管金刚烷胺的重要技术手段。本文对广泛使用的传统金刚烷胺检测方法进行了介绍,同时,也对多种新型检测方法进行了重点阐述。采用酶联免疫分析法、免疫层析法或化学发光免疫分析法等快速检测方法对样本进行初筛,再用液相色谱-质谱联用法进行确证是目前效率较高的方法。在检测经费有限的条件下,可检测更多的样本,扩大食品安全监管范围,及时发现问题,从源头保障食品安全。然而,酶联免疫吸附法等传统的快速检测方法存在灵敏度偏低的问题。因此,近年来快速、灵敏检测金刚烷胺的新方法不断涌现。基于免疫学反应的检测新方法,其利用了抗原抗体结合的免疫学反应,不同于传统的酶联免疫吸附法依赖于辣根过氧化物酶或碱性磷酸酶催化无色底物为有色产物的信号模式,而是采用包括荧光猝灭在内的新的信号模式,提高了检测方法的灵敏度。基于金刚烷胺分子印迹的检测新方法模拟抗体-抗原之间的相互作用,对金刚烷胺(印迹分子)进行专一识别,利用荧光或电流等的变化进行检测,避免了费时耗力的高亲和力高竞争性配对抗原抗体的筛选。如何进一步提高这些新方法的重复性和稳定性,是今后研究工作的重点。
