补充益生菌对肥胖机体免疫调节作用的研究进展
2021-10-31蒙双利孟荟萃
蒙双利,孟荟萃,2,3,
(1.中山大学公共卫生学院(深圳),广东 深圳 518106;2.广东省营养膳食与健康重点实验室,广东 广州 510080;3.广东省营养转化工程技术研究中心,广东 广州 510080)
随着经济水平的提高,居民的膳食结构和生活方式发生改变,能量摄入过量导致的超重和肥胖已成为严峻的全球公共卫生问题[1]。世界卫生组织2016年报道,全球超过19亿成人超重,其中超过6.5亿成人肥胖[2]。2014年国民体质监测公报显示,我国成年人和老年人的超重率分别为32.7%和41.6%,肥胖率分别为10.5%和13.9%[3]。2004—2014年,中国成人肥胖率上升了近90%[4],超重与肥胖已经成为影响国民体质的突出问题。肥胖是多因素导致的机制复杂的慢性疾病,除诱发心血管疾病、2型糖尿病和睡眠呼吸暂停等疾病的健康风险外[5],近些年研究发现肥胖会导致免疫功能损伤[6]。动物研究证实肥胖会导致T淋巴细胞功能障碍[7],适应性免疫的记忆功能减弱[8],树突状细胞(dendritic cell,DC)数量减少且抗原提呈能力受损等[9]。在流感大流行期,肥胖成人疫苗接种反应不理想,免疫记忆维持不佳[10-11]。肥胖诱导免疫功能低下的潜在机制尚未明确,有研究认为可能与肥胖诱导的肠道菌群失衡有关[12-13]。
益生菌是对宿主健康有益的活微生物[14],研究表明益生菌可以通过直接与免疫细胞接触或调节肠道菌群组成来改善宿主免疫功能[15-19]。因此,补充益生菌可能是改善肥胖者受损的免疫功能的一个有效途径[20]。本文从益生菌对适应性免疫与固有免疫的影响为切入点,综述了益生菌对肥胖机体的免疫调节作用,并且讨论了菌株特异性、益生菌补充方式、补充剂量、使用者状态等对免疫调控的影响,进一步加深益生菌对肥胖机体免疫调节作用的认识,为合理应用益生菌提供参考。
1 肥胖与免疫
1.1 免疫系统概述
免疫系统由固有免疫和适应性免疫构成。固有免疫包括黏膜上皮屏障、抗菌蛋白质以及DC、巨噬细胞、自然杀伤(natural killer,NK)细胞、中性粒细胞等免疫细胞,是机体非特异性防御病原体的第一道防线[21]。固有免疫还能激活适应性免疫,DC和巨噬细胞等抗原呈递细胞将抗原成分内吞并向次级淋巴器官迁移,通过主要组织相容性复合体向T细胞呈递抗原肽,从而启动T细胞的活化、增殖和细胞因子分泌。其中DC是唯一能激活初始T细胞的抗原呈递细胞,在启动特异性免疫过程中起着关键作用[22]。
适应性免疫在机体清除外来病原体、抵抗感染的过程中发挥重要作用。适应性免疫细胞包括T细胞和B细胞。B细胞参与体液免疫反应,产生抗体。T细胞参与细胞介导的免疫反应,细胞毒性CD8+T细胞和辅助性CD4+T细胞是T细胞的主要亚群[23]。辅助T(T helper,Th)细胞主要分为Th1细胞和Th2细胞,共同协调免疫反应的平衡。Th1细胞主要参与细胞介导的免疫,Th2细胞参与体液免疫。后续发现了更多的Th亚群,包括Th17、Th22、Th9细胞和调节性T细胞(regulatory T cells,Treg细胞),也参与免疫反应的平衡调控[24-25]。免疫记忆是适应性免疫的一个独特标志,特点是机体第一次与抗原接触后,部分适应性免疫细胞分化成为长期存在的记忆性细胞,对二次感染的特定病原体迅速产生免疫反应[26]。
1.2 肥胖与免疫功能损伤
肥胖不仅诱发慢性代谢性疾病[5],还导致机体免疫功能低下。研究推断肥胖是甲型H1N1流感大流行导致发病率或死亡率增加的独立危险因素[10]。在流感大流行期,肥胖成人疫苗接种反应不理想,且肥胖导致流感感染后免疫记忆维持不佳[10-11,27]。动物研究也表明,肥胖影响机体免疫记忆。与瘦小鼠相比,肥胖小鼠再次接种流感疫苗后产生流感特异性记忆性CD8+T细胞的数量减少了1/3,且受到刺激时,记忆性CD8+T细胞干扰素(interferon,IFN)-γ分泌量减少了一半以上,表明肥胖导致小鼠记忆T细胞数量减少,功能显著降低[8]。此外,还发现肥胖小鼠由于白细胞介素(interleukin,IL)-2、IL-6、IL-12等细胞因子浓度改变,导致感染流感病毒的过程中,肺部DC数量减少,且DC的抗原提呈能力受损[9]。除上述表现,动物研究还发现与正常体质量小鼠相比,肥胖小鼠肺部NK细胞活性相关细胞因子的mRNA表达水平受抑制[28],肝脏自然杀伤T(natural killer T,NKT)细胞数量减少[29],外周血单核细胞减少[30],DC与巨噬细胞分泌肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的能力降低[31],腹膜与脾脏巨噬细胞的吞噬功能显著降低[32],小肠固有层巨噬细胞、免疫球蛋白(immunoglobulin,Ig)A+细胞数量锐减[32],肝、附睾、肠系膜和外周血B细胞浸润增加[33],血清卵清蛋白(ovalbumin,OVA)特异性IgG水平降低[32],体内Treg细胞占比显著降低[29-30,33-34],Th17细胞占比显著增加[30-31,33-34],肝CD8+T细胞占比增加[33]。其他多个物种中也观察到肥胖对象T细胞功能障碍[7]。
肥胖所致的巨噬细胞、Th17细胞和Treg细胞等免疫细胞及其分泌的细胞因子异常与肥胖机体的慢性低水平炎症有密切关联。肥胖机体脂肪组织扩张的过程中,肥大的脂肪细胞可产生促炎性细胞因子和趋化因子,引发局部炎症反应,同时趋化因子信号使巨噬细胞向脂肪组织浸润增加,巨噬细胞活化产生更多的促炎性细胞因子和趋化因子,放大了炎症信号,引起局部或全身低水平慢性炎症[35]。后续研究发现巨噬细胞不止一种活化类型,M1型活化的巨噬细胞是促炎性的,而M2型活化的巨噬细胞是抗炎性的[36]。还有研究表明CD4+T细胞亚群失衡与肥胖导致的炎症有关。Th17细胞属于促炎性免疫细胞,其分泌的促炎性细胞因子IL-17可调节下游炎性细胞因子的表达。Treg细胞属于抗炎性免疫细胞,可通过分泌抗炎性细胞因子和诱导M2型巨噬细胞,发挥其免疫抑制作用。因此,Th17细胞、Treg细胞间的失衡与肥胖引起的机体低水平炎症有关[37]。
随着肥胖与免疫功能关系研究的深入,肠道菌群也逐渐成为备受关注的影响因素[13]。人类的胃肠道有100万亿细菌,与古细菌、真菌和病毒共同形成肠道微生物群[38]。肠道微生物菌群参与维持宿主免疫,与固有免疫和适应性免疫均具有密切联系[38-41]。使用不同程度抗生素诱导的肠道菌群失调小鼠在接种流感病毒后,其Th1、Th2、Treg细胞等Th细胞亚群构成有差异[42]。肠道菌群的组成还对小鼠感染流感病毒后特异性CD4+T细胞和特异性CD8+T细胞的生成以及B细胞产生的抗体反应有重要影响[20]。肥胖人群与正常体质量人群相比,肠道菌群多样性降低,肠道菌群组成紊乱[12],拟杆菌门丰度减少,厚壁菌门丰度增加[43],这可能是正常体质量人群和肥胖人群感染流感病毒时症状严重程度不同的原因之一[13]。
2 益生菌
肠道天然存在大量定植微生物构成的肠道菌群。优势菌群的种类与肠道菌群有益菌比例都影响宿主营养的吸收代谢,还与宿主免疫功能相关[44-45]。益生菌是当给予一定剂量时能给宿主带来健康益处的活微生物[14]。益生菌有众多种属,常见的主要有乳杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)、丙酸杆菌属(Propionibacterium)等[46]。研究表明,补充益生菌有助于调节免疫力、平衡肠道菌群,可能有助于预防和治疗多种免疫相关的疾病,如湿疹、哮喘和慢性炎症性肠炎[47-48]。益生菌的作用机制除了与其与病原微生物竞争黏附部位、产生短链脂肪酸、增强黏膜屏障和直接对抗病原体相关外,跟其调节宿主免疫反应的能力也有很大关联[15]。益生菌的种属、补充方式、补充剂量、使用者的状态不同,所取得的效果不尽相同[16-19]。
3 益生菌对肥胖机体的免疫调节作用
3.1 益生菌对肥胖人群或动物适应性免疫的调节作用
补充益生菌对肥胖人群或动物T细胞和B细胞的数量和功能等适应性免疫反应调节作用见表1(表格顺序为先单株菌后混合菌,单株菌依照益生菌菌株名排列)。其调节作用受摄入的菌株、剂量、时长等诸多因素的影响。
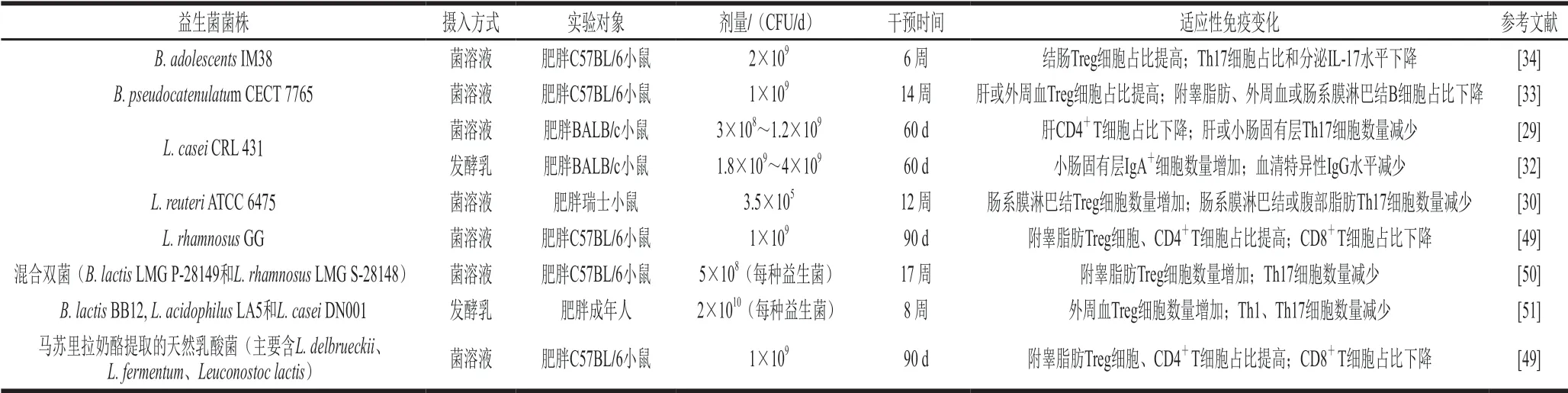
表1 益生菌对肥胖人群或动物适应性免疫的调节作用Table1 Immunomodulatory effect of probiotics on adaptive immunity of obese individuals and experimental animals
3.1.1 益生菌对肥胖人群或动物T细胞的调节作用
人群和动物研究均探讨了益生菌对肥胖机体T细胞及其亚群分布的影响。在一项随机双盲对照临床实验中,肥胖成年人每天服用含B. lactisBB12、L. acidophilusLA5、L. caseiDN001等益生菌各2×1010CFU的发酵乳,连续8 周,与干预前基线对比,外周血单个核细胞中的Foxp3基因表达量显著增加,Tbet、ROR-γt基因表达量显著减少[51]。实验结果提示这种益生菌酸奶可能使肥胖人群外周血中Treg细胞数量增加,Th1、Th17细胞数量减少。
益生菌调节T细胞及其亚群的分布的动物研究有许多成果。与未服用益生菌的肥胖小鼠相比,连续14 周,每天摄取1×109CFUB. pseudocatenulatumCECT 7765的肥胖小鼠,肝或外周血Treg细胞的占比显著提高[33]。连续6~17 周,每天摄取2×109CFUB. adolescentsIM38、3.5×105CFUL. reuteriATCC 6475或1×109CFU 混合双菌(B. lactisLMG P-28149和L. rhamnosusLMG S-28148)的肥胖小鼠,与对照组相比,结肠、肠系膜淋巴结或附睾脂肪组织中Treg细胞数量和占比显著提高,Th17细胞数量和占比显著减少[30,34,50]。肥胖小鼠连续60 d每天摄取3×108~2.4×109CFUL. caseiCRL 431,与对照组相比,肝CD4+T细胞占比减少,肝或小肠固有层Th17细胞数量显著减少[29]。高脂饮食的小鼠连续90 d每天摄取1×109CFUL. rhamnosusGG或马苏里拉奶酪提取的天然乳酸菌,与对照组相比,附睾脂肪Treg细胞、CD4+T细胞占比显著增加,CD8+T细胞占比显著减少[49]。以上研究证实,多种益生菌均具有调节肥胖动物外周血或组织T细胞及其亚群的分布的功能。
单一菌株与混合菌株的益生菌对T细胞亚群的调节作用存在差异。某研究对比了相同条件下,同等剂量的两种益生菌产品对高脂饮食的小鼠干预后,小鼠附睾脂肪免疫细胞计数的改变。结果表明,两种益生菌产品都能显著提高Treg细胞占比,而天然乳酸菌的调节效果优于L. rhamnosusGG[49]。该实验中的天然乳酸菌提取自马苏里拉奶酪,不是单株益生菌,主要由L. delbrueckii、L. fermentum、Leuconostoc lactis组成[49],推测其具有更优的效果可能是天然混合株益生菌存在协同作用或是其中某些菌株调节T细胞亚群的作用非常显著[52]。
益生菌的补充方式也可能对T细胞及其亚群分布的调节效果有影响。在同一实验中,肥胖小鼠分别以菌溶液或发酵乳的方式摄取L. caseiCRL 431,与未摄取益生菌的肥胖小鼠相比,菌溶液组肝CD4+T细胞占比显著降低,而发酵乳组肝CD4+T细胞占比虽然有降低趋势但不具有统计学意义[29]。同种益生菌采用不同的补充方式将获得不一样的免疫细胞数量调节效果,因此,探讨益生菌的高效食用方法,可能有利于可以更好地发挥益生菌的免疫调节作用。
益生菌可能调节T细胞的细胞因子分泌功能。与未服用益生菌的肥胖小鼠相比,连续6 周,每天摄取2.4×109CFUB. adolescentsIM38的肥胖小鼠结肠IL-17水平下降,但研究数量太少无法明确[34]。
总体而言,在人类和动物实验中,肥胖的实验对象连续每天摄入一定剂量的益生菌,可以有效提高Treg细胞数量及亚群分布。对于肥胖成人,摄入含B. lactisBB12、L. acidophilusLA5和L. caseiDN001的益生菌混合物可使外周血Treg细胞数量增加,Th1、Th17细胞数量减少。对于肥胖动物,如B. pseudocatenulatumCECT 7765、B. adolescentsIM38、L. reuteriATCC 6475、L. rhamnosusGG、混合双菌或天然乳酸菌,均能显著提高组织中Treg细胞数量或占比;B. adolescentsIM38、L. caseiCRL 431、L. reuteriATCC 6475或混合双菌均能显著降低组织中Th17细胞数量或占比。Treg细胞与Th17细胞的数量变化提示有效益生菌具有改善肥胖机体慢性低水平炎症的作用。L. caseiCRL 431还可使肝CD4+T细胞占比减少,而L. rhamnosusGG或天然乳酸菌使附睾CD4+T细胞占比增加,CD8+T细胞占比减少。益生菌对肥胖机体T细胞亚群分布的调节效果可能与益生菌菌株和补充方式有关。两项比较实验发现,天然混合菌株提高附睾脂肪Treg细胞比例的效果可能比单一L. rhamnosusGG的效果更好,L. caseiCRL 431采用菌溶液的补充方式才能发挥降低肝CD4+T细胞占比的作用。然而仅有两项实验仍不能确定益生菌菌株和补充方式是否为益生菌调节T细胞作用的影响因素。此外,T细胞增殖和细胞因子分泌是T细胞发挥免疫效应的重要方式,然而目前T细胞功能相关研究结果仅有B. adolescentsIM38可能降低IL-17水平。益生菌是否有调节T细胞增殖和细胞因子分泌的潜力仍有待进一步探索。
3.1.2 益生菌对肥胖人群或动物B细胞的调节作用
目前尚无益生菌对肥胖人群B细胞数量或功能的研究。一些动物实验证实了益生菌对肥胖小鼠的B细胞分布具有调节作用。与未服用益生菌的肥胖小鼠相比,肥胖小鼠连续14 周每天摄取1×109CFUB. pseudocatenulatumCECT 7765,附睾脂肪、肠系膜淋巴结或外周血中B细胞占比减少[33]。肥胖小鼠连续60 d每天摄取1.8×109~4×109CFUL. caseiCRL 431,与对照组相比,小肠固有层IgA+细胞数量显著增加[32]。不同益生菌菌株对B细胞分布的调节作用有差异。
益生菌的补充方式可能对B细胞数量的调节效果有影响。Nunez等观察了肥胖小鼠连续60 d以菌溶液或发酵乳的方式摄取L. caseiCRL 431后小肠固有层免疫应答改变。与肥胖对照组相比,菌溶液组IgA+细胞数量无显著差异,而发酵乳组IgA+细胞数量显著增加,甚至接近正常体质量对照组水平[32]。这表明发酵乳可能是这种益生菌达到升高IgA+细胞数量效果的适宜补充方式。因此益生菌所在基质对于益生菌在调节B细胞数量时的作用可能有影响。
通常认为益生菌可以调节免疫功能,因此现在也有基于益生菌可调节特异性免疫反应的假设的尝试实验。肥胖会导致小鼠血清OVA特异性IgG水平降低,实验尝试给肥胖小鼠补充L. caseiCRL 431以增强B细胞分泌特异性抗体功能,然而无论是以菌溶液方式每天摄取3×108~1.2×109CFU,还是以发酵乳方式每天摄取1.8×109~4×109CFU,与未摄取益生菌的肥胖小鼠相比,肥胖小鼠血清OVA特异性IgG水平并没有提高[32]。这表明采用以上干预方法,L. caseiCRL 431都不能增强宿主对OVA的特异性抗体反应。
总的来说,以上动物实验结果表明,摄入B.pseudocatenulatumCECT 7765可以减少B细胞的组织浸润和外周血B细胞占比,而摄入L. caseiCRL 431可以提高小肠固有层IgA+细胞数量,益生菌对肥胖小鼠B细胞分布的调节作用可能具有菌株特异性。益生菌的补充方式可能影响调节效果,其机制待进一步阐明。使用益生菌调节特异性免疫反应的尝试未达到预期效果,然而目前研究数量较少,可能需要调整益生菌菌株、剂量、补充时长等因素进一步探索。
3.2 益生菌对肥胖人群或动物固有免疫的调节作用
目前的研究表明,益生菌对肥胖动物巨噬细胞、DC、NKT细胞等固有免疫细胞的数量分布或功能有调节作用,摄入的菌株、剂量、时长取得的固有免疫调节效果不同(表2)。
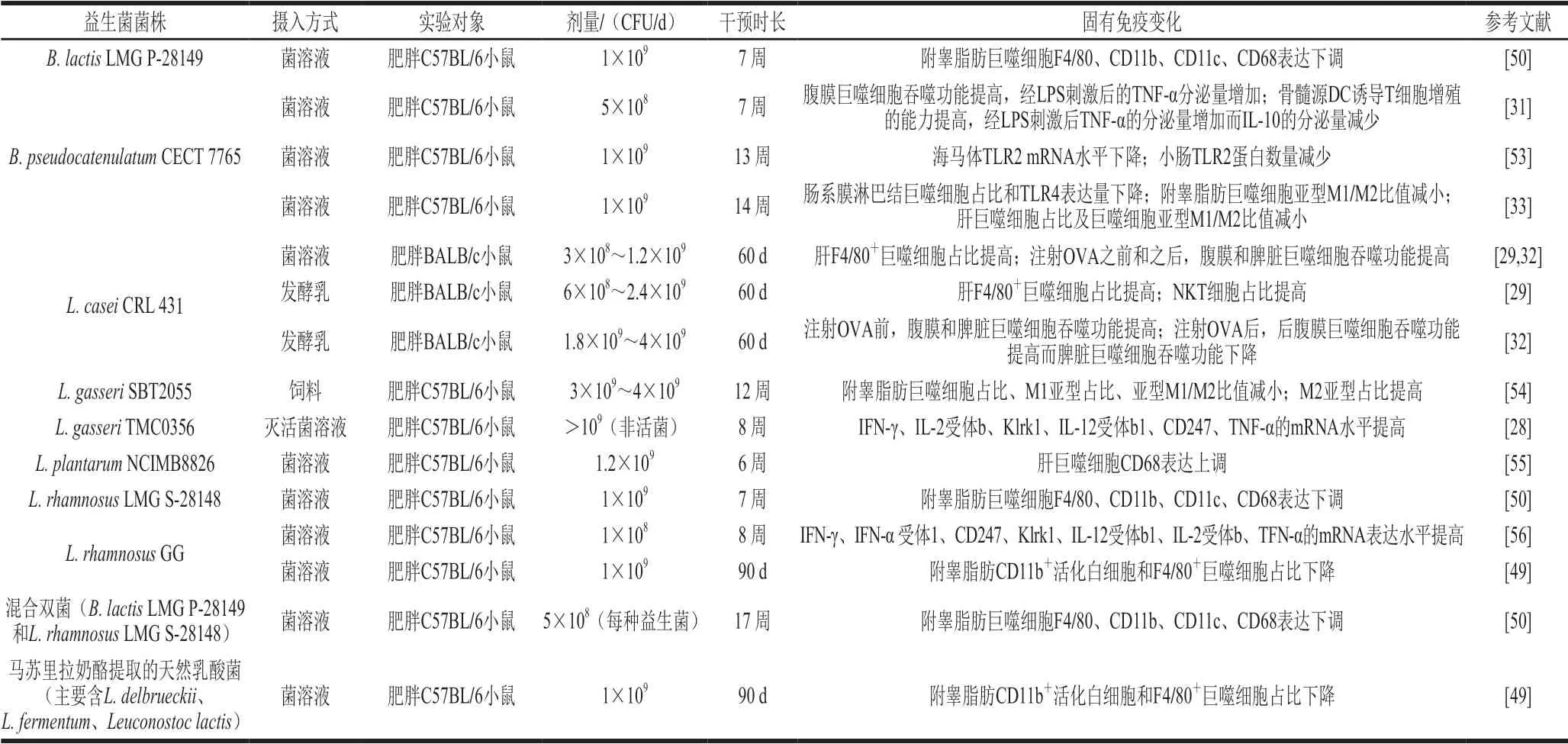
表2 益生菌对肥胖人群或动物固有免疫的调节作用Table2 Immunomodulatory effect of probiotics on innate immunity of obese individuals and experimental animals
3.2.1 益生菌对肥胖人群或动物单核细胞/巨噬细胞的调节作用
目前益生菌对单核细胞、巨噬细胞调节作用的研究尚缺少人群实验。已经有一些动物实验证实了益生菌对巨噬细胞数量及分布有显著影响[29,33,49-50,54-55],而暂未发现益生菌对肥胖动物外周血单核细胞数量有调节作用[33]。与未摄取益生菌的肥胖小鼠相比,肥胖小鼠连续90 d每天摄取1×109CFUL. rhamnosusGG或天然乳酸菌,附睾脂肪CD11b+活化白细胞和F4/80+巨噬细胞占比减少[49]。肥胖小鼠连续42~60 d每天摄取3×108~2.4×109CFUL. caseiCRL 431或1.2×109CFUL. plantarumNCIMB8826,肝巨噬细胞占比增加或代表巨噬细胞浸润的标志物CD68的表达量增加[29,55]。肥胖小鼠连续12~14 周每天摄取3×109~4×109CFUL. gasseriSBT2055或1×109CFUB. pseudocatenulatumCECT 7765,与对照组相比,肝、肠系膜淋巴结或附睾脂肪组织中巨噬细胞占比减少,肝或附睾脂肪巨噬细胞M1亚型(F4/80+CD11c+CD206-)与M2亚型(F4/80+CD11c-CD206+)的比值下降[33,54]。肥胖小鼠连续7 周每天摄入1×109CFUB. lactisLMG P-28149或L. rhamnosusLMG S-28148,或连续17 周每天摄入总量1×109CFU的前述两种菌的组合,与对照组比较,附睾脂肪巨噬细胞F4/80、CD11b、CD11c、CD68表达量减少[50]。此外,肥胖小鼠连续60 d每天摄取3×108~4×109CFUL. caseiCRL 431,小肠固有层巨噬细胞占比与对照组比较无显著差异[32],而肝巨噬细胞占比显著提高[29]。这提示益生菌对肥胖动物巨噬细胞数量及分布的调节作用可能与组织部位有关,因此探究益生菌的免疫调节作用时最好全面评估各组织器官的免疫细胞改变而不是局限于益生菌直接接触的肠道,以发现益生菌的免疫调节作用部位。
目前,益生菌对肥胖动物巨噬细胞功能调节的研究仅有两项。其中一项研究表明,益生菌对肥胖动物巨噬细胞的细胞因子分泌能力和吞噬功能具有调节作用。与未摄取益生菌的肥胖小鼠相比,肥胖小鼠连续7 周每天摄取5×108CFUB. pseudocatenulatumCECT 7765后,腹膜巨噬细胞吞噬功能提高,经1 μg/mL LPS刺激后TNF-α分泌量显著增多[31]。另一项研究表明,益生菌的补充方式可能对肥胖动物巨噬细胞吞噬功能有影响。连续60 d以发酵乳或菌溶液的补充方式给予肥胖小鼠L. caseiCRL 431,发现在注射OVA前,与肥胖对照组相比,发酵乳组和菌溶液组肥胖小鼠,腹膜和脾脏巨噬细胞吞噬功能均显著提高。注射OVA后,菌溶液组腹膜和脾脏巨噬细胞吞噬功能均显著提高,而发酵乳组仅腹膜巨噬细胞吞噬功能提高[32]。该研究提示L. caseiCRL 431有提升巨噬细胞吞噬功能作用,且菌溶液可能是一种更为高效的补充方式。然而目前研究数量不多,因此益生菌对肥胖机体巨噬细胞功能是否具有调节作用及其补充方式是否有影响仍待探讨。
总的来说,每天给予肥胖动物一定剂量的益生菌,可显著改变组织巨噬细胞数量,可能提高巨噬细胞功能,可以调节脂肪组织巨噬细胞亚型比值,使抗炎性作用的M2型巨噬细胞占比增多,提示有效益生菌菌株能改善肥胖机体引起的低水平炎症。综合多个研究发现,不同的益生菌对巨噬细胞数量调节呈现不一样的趋势。有些益生菌下调组织中巨噬细胞数量,如B.lactisLMG P-28149、L. gasseriSBT2055、L. rhamnosusLMG S-28148、L. rhamnosusGG、混合双菌或天然乳酸菌,均能使肥胖动物附睾脂肪巨噬细胞浸润显著减少,B. pseudocatenulatumCECT 7765可使肝和肠系膜淋巴结巨噬细胞减少。而有些益生菌则提高了组织中的巨噬细胞数量,如L. caseiCRL 431和L. plantarumNCIMB8826使肥胖动物肝巨噬细胞数增多。调节趋势不一致的原因为,不同实验中的肥胖对照组与正常体质量组相比,巨噬细胞数量本就不一致[29,33]。上述益生菌的调节作用都可视作有效改善了肥胖所致的巨噬细胞数量异常。除了对巨噬细胞数量的调节,L. gasseriSBT2055和B. pseudocatenulatumCECT 7765还可调控肝和附睾脂肪巨噬细胞亚型比值,B. lactisLMG P-28149和L. rhamnosusLMG S-28148无论单独使用还是组合使用均能减少附睾脂肪巨噬细胞多个标志物表达。此外,B. pseudocatenulatumCECT 7765还可能提高腹膜巨噬细胞细胞因子分泌和吞噬功能,L. caseiCRL 431可能提高腹膜或脾脏巨噬细胞吞噬功能,且以菌溶液形式摄入效果更好。然而目前益生菌对肥胖动物巨噬细胞功能调节的研究较少,仍不能得到确切结论。
3.2.2 益生菌对肥胖人群或动物树突状细胞的调节作用
目前益生菌对肥胖机体DC调节作用暂无人群实验。肥胖小鼠连续7 周每天摄入5×108CFUB. pseudocatenulatumCECT 7765,与对照组相比,骨髓源DC经1 μg/mL LPS刺激后,TNF-α分泌量增多,IL-10分泌量减少。骨髓源DC诱导T细胞增殖的能力显著提高,且在DC与T细胞数量比为1∶4时效果最好,1∶1或1∶2的细胞数量比也呈现出一定的效果[31]。说明这种益生菌可以调节DC分泌细胞因子能力,还可以辅助DC成熟启动T细胞增殖反应。
以上研究表明,B. pseudocatenulatumCECT 7765可提高肥胖小鼠骨髓源DC细胞功能,然而目前相关实验研究仅一项,益生菌是否能调节肥胖机体DC数量或功能仍需要更多研究确证。
3.2.3 益生菌对肥胖人群或动物自然杀伤细胞的调节作用
目前益生菌对肥胖机体NK细胞调节作用研究较少且缺少人群实验。现有研究表明,益生菌可能通过上调肺NK细胞活性来促进肥胖宿主健康。与未摄入益生菌的肥胖小鼠相比,肥胖小鼠连续8 周每天摄入1×108CFUL. rhamnosusGG或热灭活的L. gasseriTMC0356,均可使肺部NK细胞活性相关的mRNA表达增强[28,56]。值得关注的是,L. gasseriTMC0356非活性菌形式也能提高呼吸道免疫反应[28],非活性菌产品易于生产、贮存,开发此类产品有可观的市场前景和经济效益,但这与传统益生菌的定义不一致,且仅一项研究不能确证非活菌的效能,其作用机制也有待深入探讨。
NKT细胞是特殊的固有类淋巴细胞,NKT被激活后可以活化NK细胞[57]。肥胖小鼠连续60 d每天摄取6×108~2.4×109CFUL. caseiCRL 431发酵乳可以使肝NKT细胞比例显著提升,而3×108~1.2×109CFU菌溶液没有效果[29],但仅通过这一项实验,难以得到益生菌摄入方式是否影响NKT细胞数量的准确结论。
3.2.4 益生菌对肥胖动物固有免疫模式识别受体和信号通路的调节作用
微生物模式识别受体与固有免疫信号通路有关。已知益生菌与肠黏膜免疫细胞上的Toll样受体(Toll-like receptor,TLR)或其他微生物模式识别受体相互作用,从而直接影响其模式识别受体分子,如肠道菌可以通过TLR刺激DC,通过固有免疫和适应性免疫的交互关联,潜在地调节Th1/Th2细胞的平衡[58],促进T细胞细胞因子的分泌[59]。与未摄取益生菌的肥胖小鼠比较,肥胖小鼠连续13~14 周每天摄入1×109CFUB. pseudocatenulatumCECT7765,海马体中TLR2基因和小肠TLR2蛋白表达显著降低[53],肠系膜淋巴结TLR4表达下降[33]。益生菌干预可能改善肥胖导致的模式识别受体表达水平异常,但目前研究数量较少证据不充分,仍需要进一步研究。
3.3 益生菌对肥胖的免疫调节作用特点
益生菌对肥胖机体固有免疫或适应性免疫均具有影响。在适应性免疫方面,主要表现为连续每天摄入一定剂量的益生菌,肥胖成人[51]或肥胖动物[30,33-34,50]的外周血或组织中Treg细胞数量或比例增加,Th17细胞数量或比例减少,益生菌可能改善其低水平炎症。动物实验中,益生菌对T细胞或B细胞的数量及分布的调节作用有菌株特异性[29,32-33,49],并且受益生菌的补充方式影响。除了B. adolescentsIM38可能降低IL-17水平之外[34],益生菌对T细胞细胞因子分泌功能影响的研究不足,对T细胞增殖功能的研究鲜见报道。现有研究尚未能证明益生菌有增强B细胞分泌特异性抗体功能[32]。
在固有免疫方面,缺少人群研究。动物实验证实,连续每天摄入一定剂量的益生菌能增加或减少组织中巨噬细胞数量,具体趋势与各实验中动物状态有关,益生菌的调节效果都是改善了其实验中肥胖所致的巨噬细胞数量异常[29,33,49-50,54-55]。少量动物实验表明益生菌还能降低巨噬细胞M1亚型与M2亚型的比值[33,54]、提高巨噬细胞细胞因子分泌和吞噬功能[31-32]、提高DC细胞功能[31]、增强NK细胞活性[28,56]、下调TLR表达[33,53],但以上调节作用都仅有少量研究证实,尚不能得到准确结论。
单株菌和混合菌株的效果比较仍未能定论。现有研究认为,B. lactisLMG P-28149和L. rhamnosusLMG S-28148无论单独使用还是混合使用,对减少附睾脂肪巨噬细胞多个标志物表达的效果一致[50],而单株菌L. rhamnosusGG和天然乳酸菌的混合菌株比较,混合菌株提高附睾脂肪Treg细胞的效果更好[49]。
益生菌的补充方式存在矛盾之处,菌溶液或发酵乳各有优缺点。现有研究发现,只有菌溶液形式才能减少肝CD4+T细胞数量[29],只有发酵乳形式才能增加肝NKT细胞或小肠固有层IgA+细胞数量[32],无论是菌溶液还是发酵乳都能增加肝巨噬细胞数量[29],而对于注射OVA后巨噬细胞吞噬功能,菌溶液能使腹膜和脾脏处细胞功能均提高,发酵乳仅能提高腹膜处细胞功能[32]。目前研究数量较少,尚不能得出准确结论,需要进一步探讨补充方式的影响。
4 结 语
近年研究证实肥胖会导致免疫功能损伤。益生菌具有免疫调节作用,在肥胖人群中也是颇受欢迎的保健食品,应用益生菌可能提高肥胖人群免疫力。但益生菌产品种类繁多,针对肥胖机体的免疫调节效果一直不够明确。
综上所述,现有的研究表明益生菌对肥胖机体具有免疫调节作用,对于固有免疫或适应性免疫均具有影响,且有效益生菌菌株能改善肥胖机体的慢性低水平炎症。益生菌对肥胖机体免疫调节可能因益生菌菌株、补充剂量、补充时长、补充方式、宿主状态不同,所取得的调节效果不尽相同。目前相关人群实验仅有一项,研究数量不足。一些菌株免疫调节效果的动物实验未能涵盖适应性免疫和固有免疫,许多研究多停留在免疫细胞数量分布层面,不够深入,对免疫系统功能和特异性免疫反应的研究不足,益生菌对肥胖机体免疫调节的机制也有待探讨。进一步系统全面地研究常用益生菌对肥胖机体的免疫调节特性,可以为科学高效地使用益生菌提高肥胖者免疫功能提供理论依据,对提升肥胖群体生活质量和减轻社会公共卫生负担具有现实意义。
