益生菌和粪菌移植调节炎症性肠病的研究进展
2021-10-31田亚针张晨曦代晓斐刘维鹏满朝新姜毓君
田亚针,张晨曦,杨 涛,代晓斐,刘维鹏,满朝新,张 微,姜毓君
(东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
炎症性肠病是一种尚不明原因的反复性的慢性胃肠道疾病,临床症状表现为持续性的腹泻、腹痛、发热和呕吐等,粪便中通常伴有血液和黏液。根据发病位置和特征不同,主要分为溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD)[1]。UC和CD的临床症状和病理学也不完全相同(表1)。UC是弥散性分布的炎症,往往局限于直肠、结肠区域的黏膜层,其组织学特征是中性粒细胞浸润,隐窝形成微脓肿,同时伴随着杯状细胞的耗竭[2]。而CD是以节段性炎症为特征,节段间的界限明显,病理学表现为透壁炎症,且病变可能影响胃肠道的任何部位,但最常病变位置是回肠末端[3]。流行病学研究发现,从1990年以来,欧洲及北美洲等地一直是IBD高发病率的地区,近年来随着工业化和城市化的不断发展,IBD在亚洲地区的发病率呈上升趋势。根据报道,香港地区的发病率已从1985年的百万分之一上升至2014年的百万分之三十,预计到2025年我国会有超过150万的IBD患者,是亚洲IBD高发病率的国家之一[4-6]。近年来的研究表明肠道微生物与IBD的关系密不可分,基于调节肠道微生物群的方法可能成为调节或治疗IBD的新型靶点[7]。因此,本文对IBD的发病因素以及基于肠道微生物调节IBD的研究进展展开综述。

表1 UC与CD的临床及病理学特点Table1 Clinical and pathological characteristics of UC and CD
1 IBD发病因素概述
IBD的发病率和流行范围日益增加,已然成为全球性的健康问题,而且IBD难以治愈、反复发作,会对患者的生活造成极大不便,所以应对其给予高度重视。目前IBD的发病机制仍未完全阐明[8],但许多研究表明是由肠道微生物群失调、机体免疫系统异常以及遗传易感性和环境等多因素的结合破坏了肠道内环境的平衡,最终引起疾病的产生[9]。
1.1 遗传易感性
IBD的产生已经被证实是由多因素综合作用的结果,但在不同地区、种族间的流行特点差异十分显著,这表明遗传因素在IBD的发病中起着重要作用[10]。有研究发现,约5.5%~22.5%的IBD患者具有IBD家族史[11]。2001年,Hampe等[12]利用全基因组关联分析(genome-wide association study,GWAS)发现位于16号染色体的含核苷酸结合寡聚化域2(nucleotide-binding oligomerization domain-containing 2,NOD2)基因的突变位点与CD的发病相关,同年这种相关性也被Hugot[13]和Ogura[14]等证实,目前该基因被公认为是第一个被发现与CD相关的易感基因。随后GWAS被广泛应用在IBD的遗传学研究中,目前已经确定了超过200 个与IBD相关的风险位点,其中约有68%的基因与CD和UC共同相关[15-17]。据研究发现,东、西方人种IBD基因也具有显著差异。Cheon[18]对亚洲地区的IBD遗传学研究现状进行总结并与西方国家进行比较,结果表明亚洲地区人群具有很多与西方国家不同的易感基因。欧洲地区人群目前除了已知的NOD2、自噬相关16样蛋白1基因(ATG16L1)、白介素(interleukin,IL)-23R、IL-10R、IL-10等,越来越多的参与细胞自噬、免疫调节、肠黏膜屏障等功能的IBD相关位点被发现[19]。在亚洲人群的相关研究中,确定了肿瘤坏死因子超家族成员15(tumor necrosis factor superfamily 15,TNFSF15)、主要组织相容性复合体(major histocompatibility complex,MHC)以及IL23/Th17信号通路相关基因等为IBD的易感基因[20-21]。通过GWAS确定了许多与IBD发病相关的基因和基因位点,揭示了IBD发病相关的多种生物学途径,对肠道炎症的发展至关重要[22]。尽管目前的研究已经取得了较多进展,遗传研究只能解释IBD发病在遗传方面的可能性,仍有其他因素如环境因素等可能在促进遗传易感个体的肠道炎症中发挥了作用[17]。
1.2 环境因素
流行病学研究表明,环境因素如吸烟、药物、饮食和生活环境等同样也是导致IBD易感人群发病的重要原因。吸烟一直是IBD研究最多的环境因素之一,临床研究发现吸烟对CD患者有害,其原因可能是吸烟会影响细胞自噬,对肠道免疫细胞和黏液分泌细胞产生毒性,并诱导肠道微生物菌群的变化[23]。另外,药物的使用,尤其是抗生素,也与增加幼儿患IBD的风险有关[24]。这通常是由于儿童早期使用抗生素后导致肠道微生物群的变化,而微生物对免疫细胞的发育及发挥功能起着关键作用[25]。除此之外,饮食中过多摄入加工肉类,其中的脂肪和动物蛋白均会增加患IBD的风险,而摄入高纤维的食物会被肠道细菌分解为具有抗炎特性的短链脂肪酸,对肠道起到一定的保护作用[26]。显然,不同的饮食和生活方式对IBD的发病具有一定的影响。
1.3 上皮屏障功能受损
随着研究的不断深入,在IBD患者中发现了上皮屏障的破坏和肠道通透性的改变,提示上皮屏障在IBD的发生发展中起着重要作用。肠道上皮屏障是由肠上皮细胞(intestinal epithelial cells,IECs)和上皮细胞层以及细胞间的连接复合物共同构成的。IBD的异常免疫反应会逐步降解肠道上皮细胞,导致黏膜受损和肠道通透性增加,病原菌及抗原、毒素等进入黏膜下层,再进一步加剧肠黏膜损伤,损害屏障的完整性[27-29]。研究表明,结肠炎小鼠紧密连接中的闭锁小带蛋白1(zonula occludens 1,ZO-1)、闭合蛋白(Occludin)和密封蛋白(Claudin)-1的基因和蛋白表达量出现异常,促进腔内细菌和抗原穿过上皮屏障,触发炎症反应;CD患者肠道活检的分析结果显示,紧密连接中上皮钙黏素(E-cadherin的基因表达量下调,从而揭示了构成肠道屏障的重要组成部分——紧密连接在IBD炎症中的重要性[30]。此外,肠上皮细胞被杯状细胞分泌的黏蛋白形成的黏液所覆盖,可以形成保护性黏液屏障,避免细菌与肠上皮细胞的直接接触[31]。UC患者肠道中杯状细胞的功能异常,黏液分泌量大幅减少,导致结肠黏液层变薄或消失,使细菌侵袭上皮细胞,加剧机体炎症[32]。因此肠道屏障的恢复与重建可作为治疗IBD的新思路。
1.4 肠道微生物的变化
人体肠道中定植着细菌、真菌、病毒等众多微生物,数量达到1014个,这些微生物群在肠道中相互作用,构成了肠道的微生物屏障。宿主可为肠道微生物群提供营养和生存环境,而微生物群又能参与和调节宿主的一系列生理活动,这种互利的共生关系共同维持着机体的肠道稳态。在IBD患者中,由于受到内源性或外源性因素的刺激,肠道的稳态被打破,因此与健康个体相比,IBD患者中的肠道微生物群组成的种类和数量都大不相同[33]。IBD患者肠道内有益微生物群的丰度大幅下降,例如厚壁菌门中的乳酸杆菌属(Lactobacillus)、梭菌属(Clostridium)等,而有害微生物,如变形菌门和放线菌门中的肠杆菌科包括大肠杆菌(Escherichia coli)和黏附侵袭性大肠杆菌以及活泼瘤胃球菌(Ruminococcus gnavus)的比例则显著增加(表2)[34]。Yilmaz等[35]对UC和CD患者进行了肠道活检,结果表明Blautia、Faecalibacterium和Ruminococcus是UC和CD患者肠道中的关键菌群。另外一项关于CD患者在手术后以及6 个月后的黏膜相关菌群组成的研究中发现,厚壁菌门中的有益菌普氏栖粪杆菌(Faecalibacterium prausnitii)可分泌抗炎代谢产物短链脂肪酸,该菌丰度的降低与节段性回肠炎术后复发的风险增加有关[36]。同样有研究对116 名UC患者在活动期和缓解期的粪便菌群进行测定,结果表明在UC患者的活动期中F. prausnitzii的定植同样存在缺陷[37]。因此,无论UC还是CD患者均存在着严重的菌群失调,肠道优势菌门的细菌数量减少和生物多样性降低对IBD的反复复发产生了一定影响。

表2 IBD患者或小鼠的肠道菌群变化Table2 Dysbiosis of the gut microbiome in patients and mice suffering from IBD
1.5 免疫调节功能紊乱
肠道固有免疫又称非特异性免疫,是机体长期进化形成的天然防御机制。固有免疫系统是由屏障结构、免疫细胞(包括树突细胞(dendritic cells,DC)、自然杀伤细胞(natural killer cells,NK)、巨噬细胞、中性粒细胞等)以及免疫分子组成,能够通过模式识别受体识别微生物,并促进肠道上皮细胞产生抗菌肽消灭致病微生物,此外还能通过信号传递刺激T细胞和B细胞分化,分泌抗炎细胞因子,抑制部分T细胞亚群如辅助性T细胞(T helper,Th)1和Th17的应答[17]。巨噬细胞和DCs作为肠道主要的吞噬细胞,与IBD发病密切相关。在炎症初期,肠道的中性粒细胞浸润,黏膜屏障损伤,并刺激巨噬细胞产生炎性细胞因子,增强炎症反应[48]。研究表明,CD患者的先天性免疫系统缺陷,中性粒细胞募集受损,从而促进抗原微生物穿透肠道黏膜,导致CD14+巨噬细胞不仅产生大量的炎性因子,如IL-6、IL-23和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),同时刺激单核细胞产生高水平的干扰素-γ(interferon-γ,IFN-γ)[49]。
抗原入侵后,抗原呈递细胞(antigen-presenting cells,APCs)便会对抗原进行加工呈递以供识别,启动一系列的炎性因子和抗炎因子的级联反应,刺激T细胞和B细胞的增殖分化并激活机体适应性免疫应答途径[50-52]。研究发现T细胞在IBD的发生发展过程中发挥着重要作用。受到抗原刺激后,初始CD4+T细胞在特定的细胞因子的诱导下分化为不同功能的T细胞亚群,如Th1、Th2、Th17、调节性T细胞(regulatory T cells,Tregs)等[53]。CD的透壁炎症是由Th1和Th17的过度反应引起的,而UC黏膜炎症的发病则与Th2有关[54-56]。UC患者中Th2相关的细胞因子IL-4、IL-5、IL-13的分泌量增加,例如IL-13可促进肠上皮细胞的凋亡,改变紧密连接功能,从而加重黏膜溃疡[57]。在CD患者体内,APCs和巨噬细胞产生的炎性因子IL-12、IL-18和IL-23等的分泌刺激了Th1和Th17的增殖分化,进而Th1和Th17分泌炎性因子IL-17、IFN-γ和TNF-α,形成一个自我增殖的循环,又进一步刺激巨噬细胞、内皮细胞等分泌IL-1、IL-6、IL-8、IL-12等炎症因子[58-60]。
值得注意的是,Tregs是一类具有免疫抑制功能的T细胞亚群,可以分泌IL-10、转化生长因子-β(transforming growth factor-β,TGF-β)并表达叉头框蛋白3(forkhead box protein 3,Foxp3)和CD25,抑制初始T细胞向Th1/Th17分化[62]。Treg具有与Th17细胞相反的生物活性,两者的比例对IBD的发病至关重要[63]。对IBD患者的外周血液检测的研究发现,Treg细胞的比例下降而Th17细胞的比例上升,该平衡紊乱会导致肠道黏膜损伤[64]。平衡Tregs/Th17的比例对于调节IBD的肠道微生态稳态也具有重要意义[65]。最早关于微生物群影响Th17细胞分化的研究来自Ivanov[66]等,与SPF小鼠共同喂养后,无菌小鼠小肠中Th17数目显著增加,因此共生菌群对Th17的分化起重要的作用,而且肠道菌群的组成可以调节小肠中Th17/Treg细胞的平衡,这可能影响肠道免疫和IBD。Furusawa等[67]研究发现,厚壁菌门中的柔嫩梭菌属(Clostridium leptum)通过产生丁酸盐促进Foxp3的表达,使初始CD4+T细胞向Treg细胞分化,进而减少炎症的发生。总之,肠道菌群和免疫系统的相互作用在IBD的发生和发展中具有重要意义。
IBD涉及的发病机制总结见图1。

图1 IBD涉及的发病机制[61]Fig. 1 Mechanisms involved in the pathogenesis of IBD[61]
2 益生菌靶向调节IBD的研究进展
炎症性肠病临床治疗主要以缓解炎症反应、减少疾病的恶化和并发症、提高患者生活质量为目标。目前临床上治疗IBD的药物主要有氨基水杨酸类药物,如5-氨基酸水杨酸、皮质类固醇类药物以及生物和免疫制剂类的药物,这些药物对IBD的治疗起到了一定的积极效果,但长期服用会给机体带来相当大的副作用。近年来多种研究表明肠道微生物在IBD的发生发展中具有重要意义,因此基于调节肠道微生物的方法如益生菌、益生元、合生元、粪菌移植(fecal microbiota transplantation,FMT)以及微生物代谢产物等受到了广泛关注[68-70]。基于目前的治疗现状,通过微生态制剂来改变宿主肠道微生物是一种有潜力的治疗策略,具有重要的研究价值。
2.1 益生菌对IBD的影响
益生菌是一类摄入足够剂量后会对机体产生有益影响的活微生物[71]。目前大量的研究表明,益生菌制剂可以通过抗氧化、增强肠道屏障功能、调节机体免疫反应和改善肠道菌群的组成等在不同程度上缓解临床IBD患者或动物模型的炎症反应。最常见的益生菌有双歧杆菌、乳酸杆菌等(表3),但是不同的益生菌制剂在成分、剂量和与宿主的相互作用方面均存在显著差异,因此在使用前必须充分考虑这些因素。由于UC和CD的临床症状及病理学特征不完全相同,益生菌对二者的改善情况也不尽相同。目前大多数的研究多集中在益生菌对UC的改善作用,使用益生菌缓解CD的研究十分有限,同时结果显示益生菌对CD没有明显的缓解和治疗[72],这可能是由于CD的发病机制更加复杂[73]。

表3 益生菌在临床和动物实验中的应用Table3 Application of probiotics on IBD in clinical and animal experiments
2.2 益生菌调节IBD的机制
2.2.1 缓解氧化应激反应
研究表明,IBD的发病与活性氧(reactive oxygen species,ROS)的过量产生和抗氧化系统的破坏有关[82]。ROS是机体内重要的信号分子,中性粒细胞和巨噬细胞的激活可促使ROS的过量产生,进而引发一系列的链式反应[83]。过量ROS会导致细胞的氧化损伤,并激活肠道的炎症因子引发炎症反应[84],影响多条炎症信号通路及相关作用蛋白的表达,进而加重IBD的组织损伤,加速IBD的发展进程[85]。IBD的严重程度也与超氧化物歧化酶(superoxide dismutase,SOD)的水平有关。SOD是机体重要的抗氧化酶,是清除氧化自由基的首要物质,其歧化作用是细胞防御氧化应激最主要的作用。研究表明,可以产生SOD和过氧化氢酶(catalase,CAT)的干酪乳杆菌BL23可以显著增加2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid,TNBS)诱导的CD模型小鼠的肠道酶活性,降低炎症反应[86]。用短乳杆菌处理的结肠炎小鼠的血清代谢物分析表明,短乳杆菌可提高与氧化应激相关的血清代谢物水平[87]。另一方面,益生菌也可以通过调节与氧化应激相关的信号通路来缓解氧化反应,目前的研究发现乳酸菌可参与调控NF-κB、磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)、核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)等通路,其中Nrf2/ARE通路主要刺激SOD、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px/GPx)基因的表达。植物乳杆菌与两歧双歧杆菌通过激活Nrf2通路上调UC小鼠的结肠组织的抗氧化酶相关因子(SOD1、SOD2、GPx2、CAT)的相对表达量,提高血清中抗氧化酶(SOD、GSH-Px、CAT)的活性[88]。
2.2.2 修复肠道屏障
根据肠道黏膜的组成和功能,可将肠道屏障分为机械屏障、化学屏障、免疫屏障和微生物屏障。不同的屏障发挥不同的生理功能并受到不同分子机制的调控,同时又通过不同的信号通路有机地结合在一起,共同防御外来抗原物质的侵袭(图2)[89]。IBD患者肠道炎症与肠道屏障功能受损相关已被研究者广泛接受并研究。多种研究表明不同的益生菌可以改善受损的肠道上皮屏障。结肠炎小鼠的肠黏膜屏障功能受到严重影响,在口服益生菌大肠杆菌Nissle 1917后,可显著提高紧密连接蛋白ZO-1的表达,并对结肠炎诱导的黏膜对管腔中物质的通透性增加提供保护[90]。鼠李糖乳杆菌CNCMI-3690能够通过抑制肠道通透性的增加,刺激杯状细胞分泌黏蛋白,增加小鼠黏液层的厚度,以及调节MUC2的表达来保护结肠炎小鼠的黏液屏障功能[27]。罗伊氏乳杆菌R2LC能够上调紧密连接蛋白Occludin和ZO-1的基因和蛋白表达,增加了口服乳酸菌组的结肠炎小鼠的黏液层厚度,从而改善屏障功能[81]。复合益生菌VSL#3是由8 种益生菌组合成的混合物,Mennigen等[91]研究了其对葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)诱导的小鼠结肠炎上皮屏障的影响。结果表明,VSL#3通过维持紧密连接蛋白Occludin、ZO-1、Claudin-1、Claudin-3、Claudin-4等的表达以及抑制肠上皮细胞的细胞凋亡来保护上皮屏障。

图2 肠道屏障Fig. 2 The intestinal barrier
2.2.3 调节免疫反应
IBD是一种非特异性的肠道炎症疾病,其发生主要与自身免疫系统紊乱有关[92],肠道免疫细胞因子和信号通路在IBD的发病机制中起着重要作用[93]。益生菌可以通过激活先天免疫诱导适应性免疫,并进一步调节免疫细胞如DCs、巨噬细胞、Tregs,以及多种信号通路如Toll样受体(toll-like receptor,TLR)、NF-κB等途径来调节免疫应答,降低炎性因子的产生,促进抗炎因子的分泌,从而达到减轻炎症的目的(图3)[94-96]。罗伊氏乳杆菌ATCC55730治疗40 例的活动期UC患儿的临床研究表明,与美拉沙嗪组相比,罗伊氏乳杆菌与美拉沙嗪联合使用的UC患儿肠道的抗炎因子IL-10水平显著增加,炎性因子IL-1β、TNF-α和IL-8的水平降低,提示益生菌可作为辅助药物改善UC患者的肠道炎症[97]。对短双歧杆菌缓解结肠炎的动物实验表明,短双歧杆菌CCFM683可以显著降低DSS诱导的结肠炎小鼠的DAI,并通过下调炎症标志物MPO的活性和炎性因子(TNF-α、IL-1β、IL-6)表达,上调结肠抗炎细胞因子IL-10及核受体PPAR-γ的表达来保护结肠黏膜层完整性,维护肠道黏膜屏障[45]。植物乳杆菌A、嗜酸乳杆菌ATCC 4356和鼠李糖乳杆菌ATCC 53103可增加结肠炎小鼠CD11c+、DCs和Tregs的表达量,同时下调炎性因子IL-17、IFN-γ和TNF-α,改善结肠炎[98]。
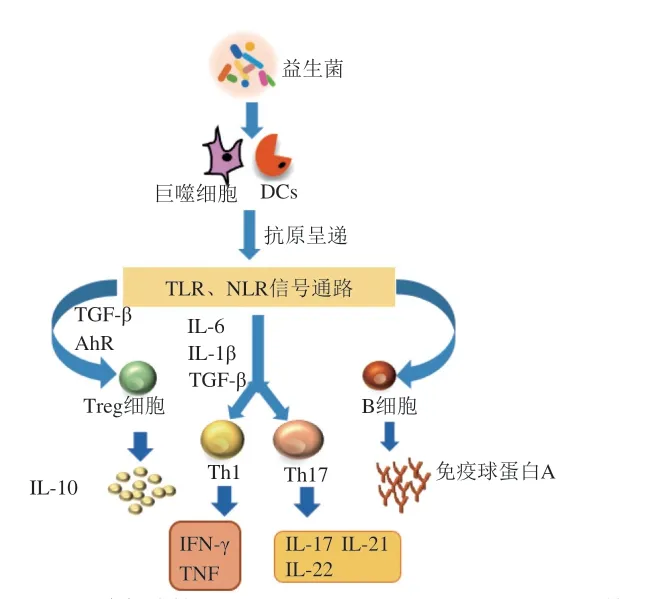
图3 益生菌激活机体免疫Fig. 3 Probiotics activates the immune system
2.2.4 调节肠道菌群的平衡
益生菌在调节体内肠道菌群和保持肠道微生物平衡中发挥着重要的作用。益生菌定植于肠道黏膜后可形成微生物屏障,并通过空间位阻效应阻止病原菌对肠道的黏附与入侵,使机体免受感染[99]。临床试验已证明益生菌可有效改善IBD患者的肠道菌群紊乱,Dinca等[78]利用干酪乳杆菌对轻度UC患者采用直肠给药的方式进行为期8 周的干预,结果显示直肠给药组患者的肠道乳杆菌数量上升而肠杆菌的数量下降,表明干酪乳杆菌DG改善了UC患者的肠道微生物组成,从而发挥缓解炎症的作用。益生菌能通过调节微生物的组成缓解IBD模型动物的肠道炎症也已经得到验证。例如Jang等[100]的研究表明DSS诱导的结肠炎小鼠的肠道菌群发生了改变,而在灌胃发酵乳杆菌KBL374和KBL375后,乳杆菌属和Akkermansia属的丰度显著升高,改变了肠道的菌落结构并提高了肠道微生物多样性。同时还有研究表明结肠炎小鼠肠道中的变形菌门的丰度增加、厚壁菌门的丰度降低,而短双歧杆菌CCFM683在属水平上可以显著抑制由菌群失调导致的拟杆菌属、臭杆菌属、双歧杆菌属和脱硫弧菌属的增加,并增加有益菌Peptostreptococcaceae的丰度,从而重新平衡IBD模型小鼠的肠道微生物组成[45]。因此适当补充益生菌,在肠道内形成非致病性细菌的优势菌群,维持肠道微生态平衡,可以有效预防IBD的发生发展[101]。
大量研究都表明益生菌可以调节或辅助治疗IBD,但目前对于益生菌严格的临床实验很少,且效果不尽如人意,因此益生菌并未大范围应用。针对这一问题,一方面需要建立更多严格的随机、双盲、安慰实验来验证益生菌的临床价值;另一方面则对益生菌缓解IBD的机制进一步深入研究,以便对处于不同阶段、不同症状的IBD患者采用适合的益生菌制剂进行治疗,最后开发新型、功能强大的益生菌制剂,开启治疗或辅助治疗IBD的新局面。
3 粪菌移植在IBD中的研究进展
3.1 粪菌移植对IBD的影响
FMT是将健康供体的粪便悬浊液输入到患病人群的肠道中来治疗某些难愈疾病。健康人群的粪便通过稀释、匀浆再过滤,并与生理盐水和甘油混合制得粪便悬浊液,再导入到患者的肠道内达到治疗的目的,其最佳利用时间为6 h以内,且不应超过24 h[102]。1983年首次有临床研究通过FMT治疗复发性艰难梭菌感染,结果显示治疗效果非常显著,但在当时的作用机制并不清楚[103]。近些年FMT在治疗复发性艰难梭菌感染取得的成就,使FMT作为新型方法对其他疾病的影响的研究也受到了关注。1989年,Bennet等[104]首次利用FMT法治疗IBD,证实了FMT对UC患者的临床症状具有缓解作用。此后,FMT治疗IBD的疗效及安全性的研究越来越多(表4)。Burrello等[105]研究了FMT对结肠炎小鼠肠道黏膜固有和适应性免疫反应的功能影响,结果表明FMT可以改变肠道微生物群的组成,同时通过激活不同的免疫途径产生抗炎因子IL-10降低炎症反应,最后揭示FMT可作为有价值的治疗方案从而应用在免疫相关疾病中。Paramsothy等[106]采用FMT对UC患者进行了一项随机双盲的临床实验,结果表明41 名FMT治疗的患者中有27%的患者临床症状得到改善,而且肠道微生物多样性也随着粪菌移植次数的增加而增加,但仍有一部分患者产生了不良反应,提示FMT可作为治疗UC的新选择,但要精确定义治疗的最佳强度以及寻找更匹配的捐助者和接受者。尽管FMT对IBD患者具有一定的缓解作用,但其作用机制仍不清楚。研究表明FMT可以通过重建IBD患者的肠道优势菌群、增加肠道有益菌和微生物群的比例、恢复微生物群的生态失调、调节黏膜免疫系统来缓解炎症反应。

表4 FMT在临床和动物实验中的应用Table4 Application of FMT on IBD in clinical and animal experiments
3.2 粪菌移植的安全性
FMT在IBD治疗中已经表现出良好的应用前景,但目前仍未形成统一的治疗方案,移植途径、供体的筛选、受体的选择、FMT的最佳剂量和频率、术后不良反应的评估等未完全解决的问题仍在进一步的探讨中[113]。例如,FMT术后出现的轻微自限性不良反应,包括腹部不适、腹痛、腹泻、恶心和大便频率改变,部分患者出现短暂发热和血液CRP水平升高[114]。另外,由于新鲜粪便中除细菌外还含有真菌、病毒和寄生虫等多种微生物,供体粪便中致病菌可能会对患者造成潜在传播感染的风险,因此粪便的制备方法、保存方式也是较为关注的问题[115]。同时不同的移植途径可能会给患者带来不适反应,上消化道途径(口服、胃镜等)的不良反应多且疗效低于下消化道途径(结肠镜、灌肠等)[110]。鉴于以上问题,应该对粪便供体进行“多维标准”的严格筛选,避免感染不良事件的发生,并针对不同患者个性化地选择移植方式以及采用严格的实验室方法确保粪菌液的质量。总之,纵观目前的研究,FMT作为治疗IBD的新兴策略虽然存在结果不一的问题,但不可否认其总体上是一种相对安全的调节菌群失调的方法,未来还需要更多高质量、安全性高、样本数据大的临床和实验研究作为支撑。
4 结 语
近年来IBD在我国的发病率有上升趋势,由于IBD难以治愈而且会产生很多并发症,必须对其加以重视。IBD的发病因素主要涉及到遗传易感因素、环境因素、肠黏膜屏障的损坏、肠道微生物群的失调和免疫紊乱等。随着对肠道菌群与宿主相互作用的研究逐渐深入,基于调节肠道微生物治疗IBD可能是一个新型靶点。利用益生菌和FMT来重建肠道微生态进而缓解IBD的治疗策略在临床和动物实验中取得了良好的改善效果。但由于数据的不足,益生菌和FMT对UC和CD的疗效以及其不良反应存在一定的争议。在未来的研究中,应开展更多严格的随机、双盲、安慰临床实验进行进一步的探究,同时对益生菌的最佳浓度、不同菌株间的差异性和安全性以及FMT的最佳灌注量、理想干预方式、供体的筛选等进行探究,为基于微生物法调节IBD提供合理有力的依据。
