氯吡苯脲浸泡处理延缓采后芒果成熟和软化的生理机制
2021-10-31张业歆刘家粮潘永贵高兆银胡美姣张正科
张业歆,刘家粮,潘永贵,高兆银,胡美姣,张正科,
(1.海南大学食品科学与工程学院,海南 海口 570228;2.中国热带农业科学院环境与植物保护研究所,海南 海口 571101)
芒果(Mangifera indicaL.)属漆树科常绿乔木果树,因其果实风味独特且富含膳食纤维、有机酸、胡萝卜素、维生素、矿物质、多酚等多种营养物质而具有较高的经济价值,被誉为“热带水果之王”[1]。然而,芒果属呼吸跃变型果实,采后在常温条件下可快速成熟,之后启动衰老并引发品质劣变,严重制约芒果产业的发展[2]。因此,开发安全、高效的保鲜技术用以延缓采后芒果的成熟和衰老,对于延长果实货架寿命至关重要。众所周知,乙烯对果实成熟过程起关键调控作用。芒果果实在响应乙烯的过程中,涉及到叶绿素分解、类胡萝卜素合成、淀粉水解和细胞壁修饰等代谢的一系列编码基因协同表达,导致果实色泽由绿转黄、质地变软以及形成风味和香气[3]。长期以来,人们通过各种采后处理技术抑制果实乙烯生物合成来降低乙烯释放量,从而实现延缓果实成熟衰老的目的。Razzaq等[4]报道,1-甲基环丙烯(1-methylcyclopropene,1-MCP)熏蒸处理可降低‘Kensingtong Pride’芒果果实的乙烯释放量和呼吸速率,同时抑制多聚半乳糖醛酸酶(polygalacturonase,PG)和内切葡聚糖酶(endo-1,4-β-D-glucanase,EGase)活性升高,使果实的成熟和软化得到有效延缓。另据报道,外源一氧化氮(nitric oxide,NO)熏蒸处理可通过抑制‘Kensington Pride’芒果1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylic acid,ACC)合成酶(ACC synthase,ACS)和ACC氧化酶(ACC oxidase,ACO)的活性来降低ACC累积和乙烯生成水平,同时抑制了PG、果胶甲酯酶(pectin methylesterase,PME)、EGase对细胞壁多糖的水解作用,从而延缓了果实的成熟过程[5]。然而,上述气体熏蒸处理存在耗时长、成本高、药剂浓度控制不精确等缺点,因此在芒果采后生产中仍需开发简便易行的处理措施。
氯吡苯脲(forchlorfenuron,CPPU)是一种具有细胞分裂素功能的植物生长调节剂,能够与玉米素竞争性结合细胞分裂素氧化酶,在维持内源细胞分裂素水平中发挥重要作用[6]。CPPU作为一种国家批准使用的植物生长调节剂,其安全性已得到考证,且生理活性高于一般嘌呤型细胞分裂素,具有促进植物细胞分裂与增大、抑制衰老等生物学功效[7-8]。已有研究证据表明,CPPU在改善园艺作物品质方面发挥着重要作用。例如,采前应用CPPU可增加葡萄产量,维持浆果采后品质,延长贮藏期[9];Retamales等[10]报道,采前CPPU喷施处理能够提高蓝莓产量,并显著降低果实采后质量损失与腐烂率。此外,采后CPPU处理对抑制花椰菜叶绿素降解所导致的菜体黄化也表现出较好的作用[11]。张鲁斌等[12]研究发现,采后CPPU处理可延缓‘红芒6号’芒果的成熟并可维持较高的果实品质,表明CPPU在芒果采后保鲜上具有潜在的应用价值。然而,目前仍然缺乏关于CPPU抑制芒果果实成熟和软化的生理生化机制研究。为此,本研究分析了CPPU对芒果果实在采后贮藏过程中成熟和软化的影响及其相关的乙烯生物合成与果胶多糖代谢变化,以期为CPPU用于芒果采后保鲜提供理论依据。
1 材料与方法
1.1 材料与试剂
供试‘贵妃’芒果(绿熟期)采自海南省三亚崖城某商业果园,当日运抵海南大学食品科学与工程学院采后实验室,选择大小、形状、色泽、无机械伤的果实作为实验用果。
CPPU(分析纯) 生工生物工程(上海)有限公司。
1.2 仪器与设备
FT-327型手持硬度计(探头直径6 mm) 意大利Effegi公司;MASTER-M手持折光仪 日本Atago公司;CR-400色差仪 日本柯尼卡-美能达公司;GXH-3010E便携式红外气体分析器 北京华云分析仪器研究所有限公司;T18高速匀浆机、RV10旋转蒸发仪 艾卡(德国)仪器设备有限公司;DBS-160F电脑自动部份收集器上海精科实业有限公司;6890N气相色谱分析仪(配备二苯基甲基硅氧烷色谱柱、氢火焰离子化检测器) 美国安捷伦科技公司;UV-5500PC紫外-可见分光光度计上海元析仪器有限公司。
1.3 方法
1.3.1 原料采后处理
将芒果果实浸泡于质量分数0.5%次氯酸钠溶液(有效氯质量分数≥10%)中消毒处理3 min,然后用清水冲洗干净。将晾干后的芒果果实随机分成2 组,分别置于清水(对照)和10 mg/L CPPU溶液中浸泡10 min[11],自然晾干。所使用CPPU溶液质量浓度通过预实验结果确定。将晾干后的对照组与CPPU处理组果实置于保鲜盒(0.32 m×0.22 m×0.1 m,盒侧面有12 个直径8 mm的孔以避免果实无氧呼吸,盒内底部垫有软纸避免果实擦伤),于常温((25±1)℃)下贮藏8 d。每日每组处理设3 次重复,每重复用6 个果实。果实的硬度、色泽、乙烯释放量、可溶性固形物质量分数(soluble solids content,SSC)和可滴定酸质量分数(titratable acidity content,TAC)每2 d测定一次,呼吸速率每日进行测定。同时,每2 d取果肉样品1 次,液氮冷冻后于-80 ℃保存待测。
1.3.2 果实硬度、色度、SSC和TAC测定
硬度:将果实赤道轴中心处果皮削去,使用手持式硬度计测定果实正反两面削皮处的硬度。单位为N。
色度:选择黄度(b*)值作为本研究中芒果果肉色泽的特征参数,使用色差仪在果实切片切面中心测定b*值,每果设2 个对称测量点。b*值由低到高代表颜色由蓝变黄,正值越大表示黄色越深。
SSC:取1 g果肉匀浆,匀浆液在8 000×g条件下离心10 min,取一滴上清液用手持折光仪测定。结果以可溶性固形物在果肉中的质量分数表示。
TAC:参考周志强等[13]的滴定方法测定,以柠檬酸计,单位为%。
1.3.3 果实呼吸速率测定
呼吸速率:使用便携式红外气体分析器测定呼吸速率。将每组处理的18 个果实(6 个果实/重复)分别置于2.25 L塑料容器中,密封,室温下放置20 min,然后将探头插入容器内,记录CO2浓度。以每秒每千克鲜样生成的CO2质量表示呼吸速率,即为μg/(kg·s)。
1.3.4 乙烯释放量、ACC含量及ACS和ACO活力测定
乙烯释放量:采用气相色谱法进行测定。将每组处理的18 个果实(6 个果实/重复)分别置于2.25 L塑料容器中密闭1 h,然后用注射器抽取容器内1 mL气体注入气相色谱仪中,进样温度、柱温和检测器温度分别设置为120、60 ℃和250 ℃,N2(载气)、H2和空气流速分别为0.023、0.67 mL/s和6.67 mL/s。以每秒每千克鲜样生成乙烯的质量表示乙烯释放量,即为ng/(kg·s)。
ACC含量:参考Li Li等[14]的方法,通过ACC标准品确定理论ACC转化率,然后根据反应液容器内乙烯气体释放量和理论ACC转化率计算每千克鲜样中ACC物质的量,单位表示为nmol/kg。
ACS和ACO活力:分别参照Amornputti[15]和Zaharah[5]等的方法进行,ACS和ACO活力均以每秒每千克鲜样的乙烯释放量表示,即为nmol/(kg·s)。
1.3.5 水溶性果胶和螯合剂溶性果胶含量测定
参考Jeong等[16]的方法,取10 g芒果果肉制备乙醇不溶性固形物(ethanol insoluble solids,EIS),取30 mg EIS分别溶解于蒸馏水和50 mmol/L环己烷二胺四乙酸(1,2-cyclohexylenedinitrilotetraacetic acid,CDTA)溶液中,通过间羟基联苯法测定两种溶液中的糖醛酸(uronic acid,UA)含量,其分别代表水溶性果胶(water-soluble pectin,WSP)和CDTA溶性果胶(CDTAsoluble pectin,CSP)含量,以每千克EIS所含UA质量表示,单位均为g/kg。
1.3.6 WSP和CSP分子质量分布分析
参照Zhang Zhengke等[17]的方法将WSP与CSP浓缩至质量浓度约为500 mg/L(以UA当量计),将2 mL浓缩液注入填充琼脂糖凝胶CL-2B-300的分离柱(300 mm×16 mm)进行凝胶层析,以0.2 mol/L醋酸铵作为洗脱缓冲液,流速40 mL/h,使用部分收集器收集层析洗脱液,每管收集2 mL,共45 管。每管取0.2 mL洗脱液测定其中UA含量。柱空体积(V0)和总体积(Vt)分别由蓝色葡聚糖2000和葡萄糖的洗脱体积确定。各洗脱馏分中的果胶相对含量以其UA绝对含量占样品总UA含量的比例表示。UA含量较高表明在该洗脱体积下果胶分子聚集较多,根据其洗脱体积大小确定洗脱顺序,从而确定分子质量分布。
1.3.7 果胶水解酶活力测定
PG活力:按照Ren Yuanyuan等[18]的方法,取2 g果肉进行粗酶液提取,采用氧化还原法测定。PG活力表示为每秒每千克果蔬组织催化果胶生成半乳糖醛酸的物质的量,单位为μmol/(kg·s)。
β-半乳糖苷酶(β-galactosidase,β-Gal)活力:参照周晓辉[19]的方法,取2 g果肉通过邻硝基苯半乳糖苷(o-nitrophenyl-β-D-galactopyranosides,ONPG)水解法测定β-Gal活力。β-Gal活力表示为每秒每千克鲜样在37 ℃催化ONPG水解生成邻硝基苯酚的物质的量,单位为μmol/(kg·s)。
PME活力:参照Garciabetanzos等[20]的方法,取2 g果肉用于粗酶液提取,以柑橘果胶作为底物,记录反应溶液在620 nm波长处的吸光度变化情况。PME活力表示为每秒每千克样品在620 nm处吸光度的变化值,即为ΔA620nm/(kg·s)。
1.4 数据统计分析
采用SPSS 19.0软件对数据进行分析,结果以平均值±标准差表示。采用独立样本t检验比较均值并进行显著性分析(以P<0.05表示差异显著);用Origin 9.1软件绘图。
2 结果与分析
2.1 CPPU处理对采后芒果果实外观、果肉色泽、硬度的影响
由图1A可知,对照与CPPU处理的芒果果实在贮藏过程中,其外观色泽逐渐由红绿色转变为红黄色,但CPPU处理果实的转色进程明显迟于对照果实。由图1B可知,对照组果肉色度b*值持续升高,表明果肉颜色不断转黄;CPPU处理果实的b*值在贮藏2~6 d内极显著低于对照果实(P<0.01),表明CPPU处理可有效抑制芒果果实在成熟过程中果肉色泽变化。如图1C所示,对照与CPPU处理果实的硬度在贮藏前2 d轻微下降,随后对照果实快速软化,至贮藏8 d时降低至(4.16±0.19)N;CPPU处理有效抑制了果实软化,其处理果实的硬度在贮藏4 d和6 d时分别较对照果实高158.9%和129.6%(P<0.05)。
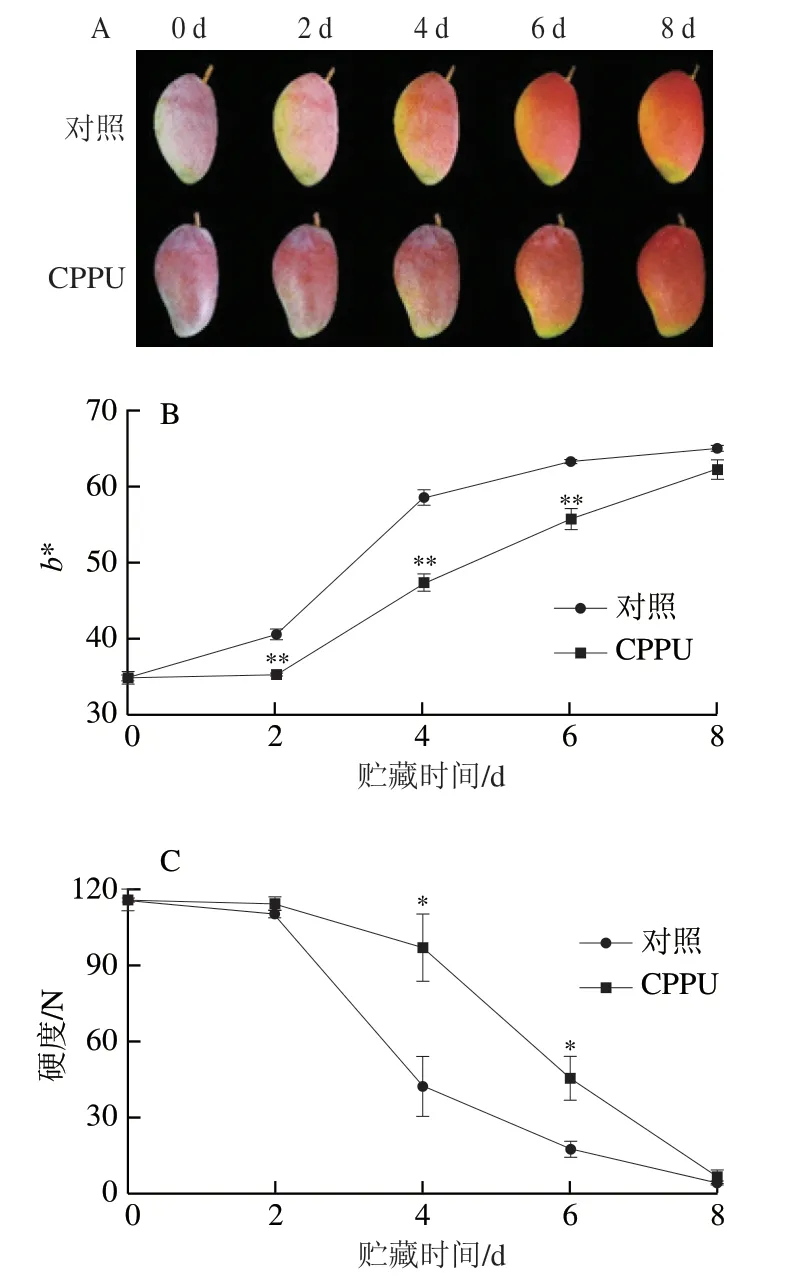
图1 CPPU浸泡处理对采后芒果果实外观(A)、果肉色度b*值(B)、硬度(C)的影响Fig. 1 Effect of CPPU treatment on appearance (A), pulp b* value (B)and firmness (C) in postharvest mango fruit
2.2 CPPU处理对采后芒果果实SSC和TAC的影响
如图2A所示,芒果果实SSC初始值为(8.18±0.30)%,对照果实SSC在整个贮藏过程中不断升高,在贮藏8 d时达到(14.71±0.11)%;CPPU处理可抑制果实SSC升高,CPPU处理组果实的SSC在贮藏4 d和6 d时分别较对照果实低13.6%和5.0%,差异显著(P<0.05),表明CPPU处理可有效抑制采后芒果果实淀粉向可溶性糖的转化。
如图2B所示,对照芒果果实TAC初始值为(1.19±0.11)%,经8 d贮藏后下降至(0.23±0.03)%;与对照相比,CPPU处理果实TAC下降速率较慢,其中在贮藏4、6 d和8 d时分别较对照高89.7%、126.8%和64.5%,差异极显著(P<0.01),结果表明CPPU处理能够有效减少芒果果实有机酸的呼吸消耗和氧化。
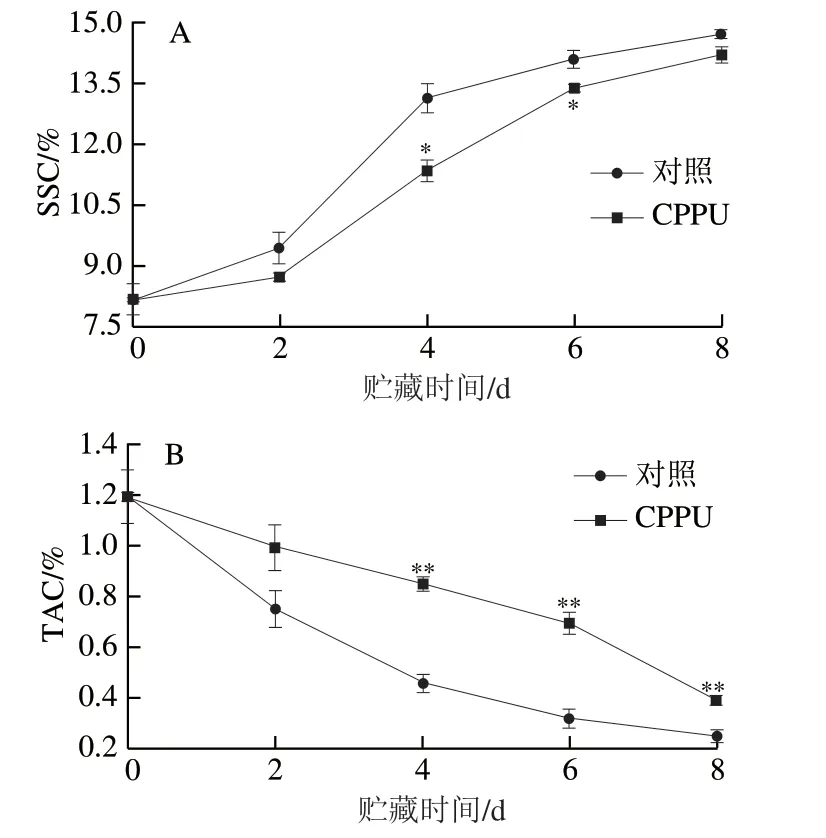
图2 CPPU处理对采后芒果果实SSC(A)和TAC(B)的影响Fig. 2 Effect of CPPU treatment on SSC (A) and TAC (B) in postharvest mango fruit
2.3 CPPU处理对采后芒果果实呼吸速率的影响
由图3可知,对照果实呼吸速率在贮藏开始后持续升高,在贮藏5 d时达到峰值,为(44.72±0.72)μg/(kg·s),之后呈迅速下降趋势。CPPU处理果实的呼吸峰值推迟至贮藏第6天出现,但峰值与对照相比无明显差异,表明CPPU处理可有效推迟芒果果实的呼吸跃变。
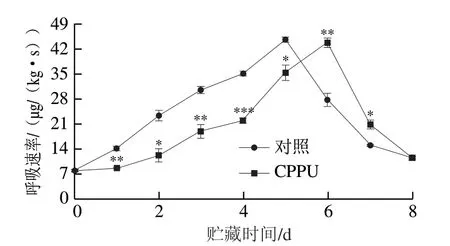
图3 CPPU处理对采后芒果果实呼吸速率的影响Fig. 3 Effect of CPPU treatment on respiration rate in postharvest mango fruit
2.4 CPPU处理对采后芒果果实乙烯释放量和ACC含量的影响
由图4A可知,对照果实的乙烯释放量在贮藏开始后迅速增加,在贮藏6 d时达到最大,其值为(24.91±0.72)ng/(kg·s),之后随果实衰老而快速下降;CPPU处理果实的乙烯释放量变化趋势与对照果实相似,但其在贮藏4 d和6 d时极显著低于对照果实(P<0.01)。芒果果实ACC含量初始值为(1.21±0.07)nmol/kg,贮藏6 d后上升至(4.88±0.24)nmol/kg,随后迅速下降(图4B);与对照果实相比,CPPU处理果实在整个贮藏期间ACC水平均显著低于对照果实(P<0.05、P<0.01)。上述结果表明CPPU处理有效抑制了ACC累积与乙烯生成。
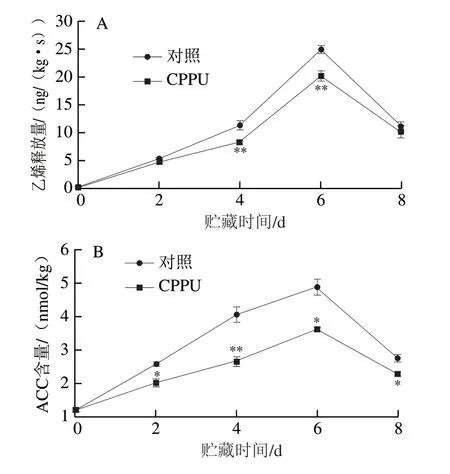
图4 CCPU处理对采后芒果果实乙烯释放量(A)和ACC含量(B)的影响Fig. 4 Effect of CPPU treatment on ethylene production (A) and ACC content (B) in postharvest mango fruit
2.5 CPPU处理对采后芒果果实ACS和ACO活力的影响
由图5可知,对照果实ACS和ACO活力在贮藏过程中均呈现先上升后下降的趋势,在贮藏6 d时达到最大,活力峰值分别为(2.40±0.13)nmol/(kg·s)和(3.90±0.22)nmol/(kg·s);CPPU处理果实的ACS和ACO活力在贮藏6 d时仅分别达到(1.70±0.06)nmol/(kg·s)和(2.79±0.23)nmol/(kg·s),分别较对照果实降低了29.2%(P<0.01)和28.5%(P<0.05),表明CPPU处理可有效抑制芒果果实成熟中乙烯生物合成关键酶活力的变化。
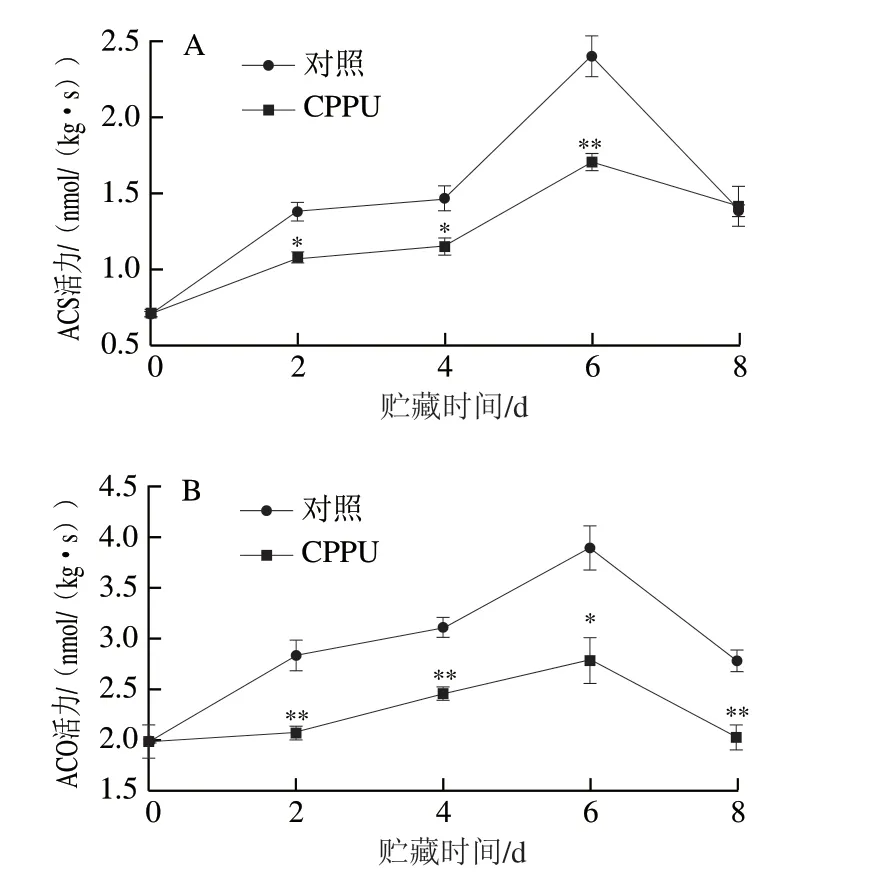
图5 CPPU处理对采后芒果果实ACS(A)和ACO(B)活力的影响Fig. 5 Effect of CPPU treatment on ACS (A) and ACO (B) activity in postharvest mango fruit
2.6 CPPU处理对采后芒果果实WSP与CSP含量的影响
如图6所示,芒果果实在贮藏初始时的WSP和CSP含量分别为(9.33±2.02)g/kg和(8.69±1.07)g/kg;对照果实的WSP和CSP含量在贮藏过程中持续上升,在贮藏8 d时分别达到(133.53±11.88)g/kg和(98.55±9.71)g/kg,分别增长了12.31 倍和9.34 倍;CPPU处理果实的WSP和CSP含量在贮藏2~6 d中均显著低于对照果实(P<0.05、P<0.01),结果表明CPPU处理可有效推迟芒果果实成熟过程中果胶的增溶过程。
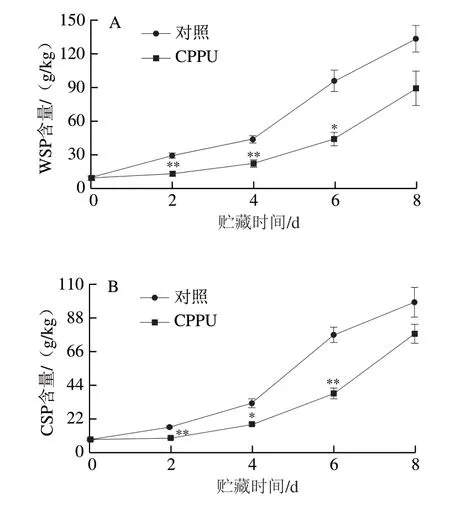
图6 CPPU处理对采后芒果果实WSP(A)与CSP(B)含量的影响Fig. 6 Effect of CPPU treatment on water-soluble pectin (A) and CDTA-soluble pectin (B) contents in postharvest mango fruit
2.7 CPPU处理对采后芒果果实WSP和CSP分子质量分布的影响
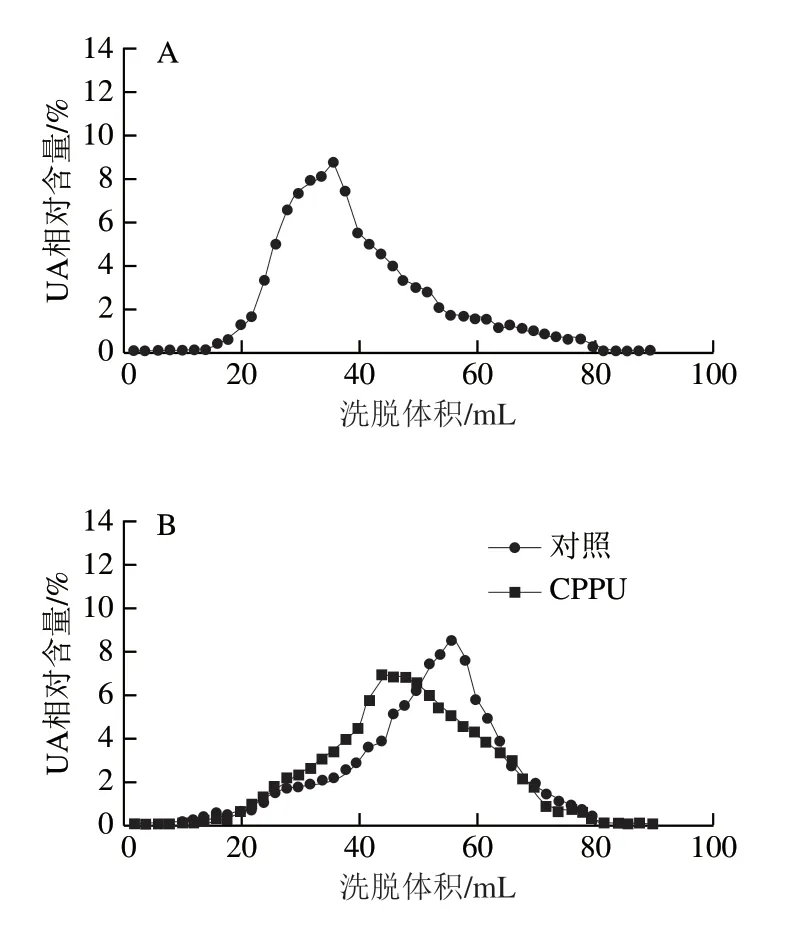
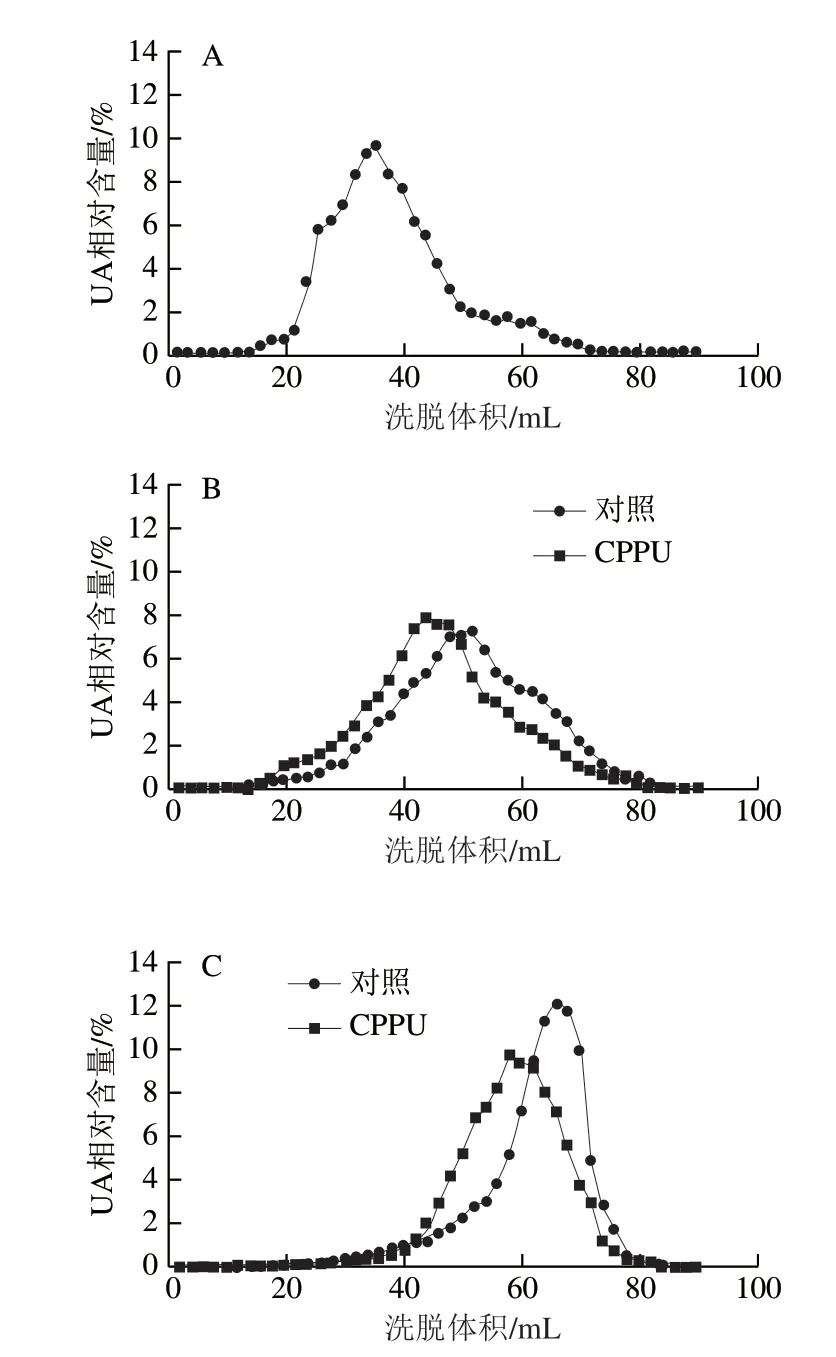
图8 CPPU处理对采后芒果果实CSP分子质量分布的影响Fig. 8 Effect of CPPU treatment on molecular mass distribution of CDTA-soluble pectins in postharvest mango fruit
如图7、8所示,芒果果实在贮藏第0天时尚未开始软化,两种果胶主要以高分子质量聚合物形式分布,对照果实开始软化后,两种果胶主要以中间分子质量聚合物形式聚集;在贮藏8 d时,对照果实WSP和CSP洗脱体积已接近总洗脱体积(Vt=74 mL),即两种果胶已解聚为低分子质量UA片段,表明果实已完全软化;与对照果实相比,CPPU处理果实在贮藏4 d和8 d时有较多的高分子质量果胶聚合物存在,表明CPPU处理有效延缓了WSP和CSP的解聚。
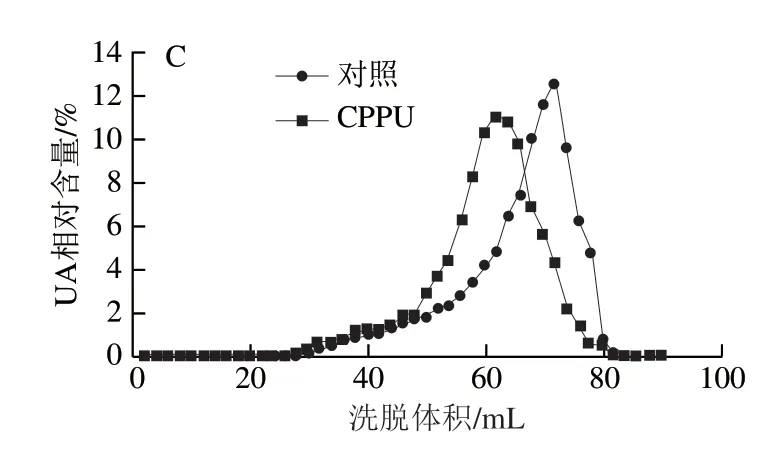
图7 CPPU处理对采后芒果果实WSP分子质量分布的影响Fig. 7 Effect of CPPU treatment on molecular mass distribution of water-soluble pectins in postharvest mango fruit
2.8 CPPU处理对采后芒果果实果胶水解酶活性的影响
如图9A所示,对照果实PG活力在贮藏前6 d呈逐步上升趋势,在贮藏6 d时PG活力达到最大,为(3.90±0.18)μmol/(kg·s),随后下降;CPPU处理抑制了芒果果实PG活力的增加,在贮藏4 d和6 d时分别较对照低32.0%和23.4%(P<0.05)。
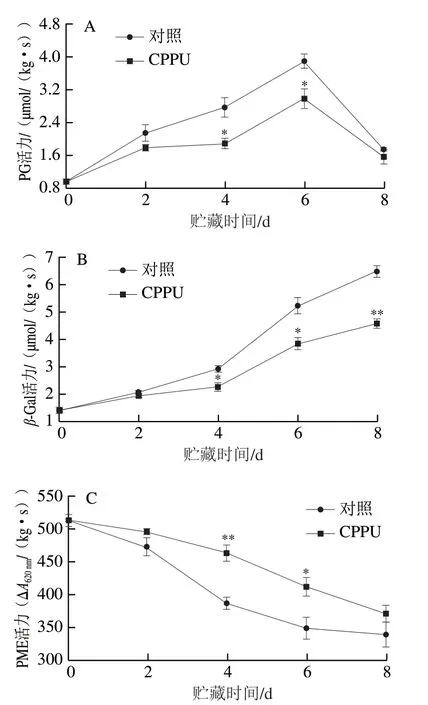
图9 CPPU处理对采后芒果果实PG(A)、β-Gal(B)、PME(C)活力的影响Fig. 9 Effect of CPPU treatment on activities of PG (A), β-Gal (B) and PME (C) in postharvest mango fruit
如图9B所示,对照果实β-Gal活力在贮藏过程中呈不断上升趋势,在贮藏8 d时达到(6.49±0.21)μmol/(kg·s);CPPU处理果实的β-Gal活力在贮藏前2 d与对照果实无显著差异,但贮藏4 d之后,CPPU处理果实的β-Gal活力显著低于对照果实,在贮藏8 d时仅为(4.57±0.16)μmol/(kg·s),较对照果实低29.7%(P<0.01)。
如图9C所示,对照果实的PME活力在贮藏过程中稳步下降,在贮藏8 d时降低至(338.33±19.22)ΔA620nm/(kg·s),较第0天低34.09%;CPPU处理果实有效抑制了PME活力的下降,在贮藏4 d和6 d时分别较对照果实高19.8%(P<0.01)和18.2%(P<0.05)。上述结果表明CPPU有效抑制了芒果果实成熟过程中3 种果胶水解酶活力的变化,进而延缓了果胶的降解。
3 讨 论
芒果果实在采收后易快速成熟和软化,导致其货架期相对较短,并使产品供应链及物流受到严重限制[21]。因此,开发芒果果实成熟软化调控技术成为生产中亟待解决的重要问题。目前已有报道显示,气体熏蒸(如臭氧、1-MCP、NO)、可食性涂膜和化学药剂浸泡(如水杨酸、硝普钠、褪黑素)等多种处理技术可有效控制芒果采后成熟[22-28]。然而,大多技术仍处于实验室研究阶段,工业化应用尚有距离。
本研究发现,10 mg/L CPPU浸泡处理不仅明显推迟‘贵妃’芒果果实在常温贮藏过程中的色泽转黄、硬度下降及SSC和TAC变化,还可推迟芒果果实的呼吸跃变和抑制乙烯生成,表明CPPU处理能够有效延缓芒果果实的成熟和软化进程,这对于改善果实贮藏品质具有显著作用。本实验结果与张鲁斌等[12]在‘红芒6号’芒果及Huang Hua等[29]在香蕉中的报道一致。
芒果作为一种典型的呼吸跃变型水果,其在成熟过程中的生理生化变化可通过乙烯的自我催化反应及信号感知来引发和调控[3]。在高等植物乙烯生物合成途径中,首先通过ACS作用将S-腺苷蛋氨酸(S-adenosylmethionine,SAM)转化为乙烯合成前体ACC,其在ACO催化下进一步合成乙烯。一般而言,植物体ACS和ACO的活性可决定乙烯的生物合成速率。在本研究中,尽管CPPU处理并未推迟芒果果实贮藏过程中ACC与乙烯释放量峰值出现时间,但显著降低了二者的生成水平,这可能与果实ACS和ACO活性受到CPPU抑制有关。与此不同,苏苗等[30]研究发现,采前喷施CPPU对采后猕猴桃果实的乙烯生物合成具有明显促进作用,使果实成熟软化加快,故对果实的贮藏带来不利影响。上述研究结果表明,CPPU与果实体内乙烯的相互作用较为复杂,其可能受到果实种类与品种、CPPU剂量、处理时期、处理方式及贮藏条件等多种因素影响。
果实在采后成熟过程中,细胞壁中的果胶与半纤维素分子通过酶促反应不断解聚并增溶,使细胞壁结构变得松弛而导致果实软化[31]。在本研究中,WSP和CSP含量在芒果果实软化过程中不断升高;与此同时,WSP与CSP分子质量呈现由高到低的分布变化趋势,这与鳄梨果实成熟过程中果胶分子解聚的模式[32]相似。相比较发现,CPPU处理的芒果果实果胶分子解聚和增溶的过程迟于对照果实,从而显著延缓果实软化。在莲子中也发现CPPU处理抑制果胶的增溶作用[33]。
大量研究表明,果实细胞壁果胶的解聚与增溶作用受果胶酶的催化而实现,其中PG、PME和β-Gal是最常见的果胶酶[31]。PG可水解多聚半乳糖醛酸的α-(1,4)-糖苷键,从而参与果胶的降解,导致果实软化[34]。本研究中,对照果实的PG活力在贮藏6 d时达到峰值,之后呈现快速下降的趋势,这与乙烯释放量变化趋势相近,其相关系数r=0.85,故推测采后芒果PG活性变化可能受内源乙烯调控。CPPU处理延缓PG介导的芒果果实软化可能与乙烯生物合成受到抑制有关。Razzaq等[4]发现,‘Kensington Pride’芒果果实在成熟过程中PG活性被外源乙烯诱导,但被1-MCP处理所抑制,继而影响了果实软化,该结果证明了本研究的观点。
PME能够催化果胶分子去甲氧基化,其产物果胶酸可作为底物参与PG的解聚反应,使果实逐步软化[35]。本研究中,对照芒果果实PME活力在贮藏过程中持续下降,而CPPU处理明显减缓了PME活力的下降速率。CPPU处理果实具有较高的PME活力意味着其果胶链上有更多的甲氧基被移除,去甲酯化后的果胶酸可与游离钙离子结合而形成凝胶,故有助于维持果实硬度。β-Gal作为修饰果胶的关键酶之一,能够通过催化果胶分子半乳聚糖侧链的水解而参与果胶的溶解过程,使果实软化。本研究中,β-Gal活力在‘贵妃’芒果果实贮藏过程中呈现持续升高的趋势,表明β-Gal在芒果后熟软化中发挥重要作用,这与在‘Harumanis’‘Nam Dokmai’‘台农1号’等芒果品种中获得的结果[36-38]一致。CPPU处理较大程度地抑制了β-Gal活性上升,因此能较好地维持果胶稳定性并抑制芒果果实软化。
综上所述,采后CPPU处理可有效延缓‘贵妃’芒果果实在贮藏过程中成熟相关生理指标变化,这与CPPU对果实乙烯生物合成及果胶降解的抑制作用密切相关。因此,适当质量浓度的CPPU处理有助于延长采后芒果果实贮藏期,这为芒果采后保鲜提供了新的思路。
