益生菌契达干酪抗氧化肽的结构及其体内代谢稳定性
2021-10-31李晓东张更旭王宇鑫郝欣悦赵铭琪倪晨宇
李晓东,张更旭,王宇鑫,郝欣悦,刘 璐,赵铭琪,倪晨宇,姜 欣
(东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
干酪不仅营养丰富,成熟期间还会生成抗氧化肽等生物活性肽[1-4]。Giacomo等从干酪中提取了EAMAPK和AVPYPQ两种抗氧化肽[5]。Gupta等从契达干酪中提取了5 种分子质量小于3 kDa的短肽,其中序列为VKEAMAPK的短肽与天然抗氧化剂丁基羟基茴香醚、特丁基对苯二酚的抗氧化性接近,1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率达到74.76%[6]。酪蛋白,尤其β-酪蛋白是生物活性肽的重要来源,目前很多关于酪蛋白源活性肽的研究是利用胃蛋白酶、胰蛋白酶、木瓜蛋白酶等对酪蛋白进行酶解,已知的这些酶有固定的酶切位点,得到的活性肽种类比较单一。而干酪由于其特殊加工工艺,几乎含有乳中全部酪蛋白,并含有大量乳酸菌,在干酪特有的成熟期间对酪蛋白进行多样化水解,能够产生丰富多样的活性肽,是制备生物活性肽的良好基质[7-10]。为了进一步促进干酪生物活性肽的生成,也需要向其中添加高水解活性的益生菌等附属发酵剂。一些益生菌如瑞士乳杆菌、鼠李糖乳杆菌等,除具有一定的生理功能外,还具有不同的底物特异性和高蛋白水解和分解肽的活性,在较长的成熟过程中,它们的蛋白水解系统会分泌胞外蛋白酶和肽酶,对干酪中的酪蛋白进行不同程度的水解,生成丰富的生物活性肽[11-14]。
干酪成熟期间产生的活性肽在摄入体内后是否仍具有活性还受消化道、吸收和血液转运环境的影响[15-16],如Basiricò等针对帕马森干酪血管紧张素转换酶(angiotensin-converting enzyme,ACE)抑制肽LHLPLP的小肠转运机制进行研究,发现该肽段被肠肽酶水解成HLPLP,再以细胞旁路途径转运出细胞[17]。但也有一些肽段可抵抗胃肠道消化酶以及小肠上皮刷状缘膜酶的降解,被小肠上皮细胞完整吸收[18-19]。因此,本研究以契达干酪为研究对象,向其中添加益生菌,分析益生菌干酪的体内抗氧化活性,并对高抗氧化活性契达干酪的抗氧化肽进行分离纯化和结构鉴定,对鉴定出的高活性肽段进行合成和FITC荧光标记,喂养小鼠,通过检测荧光标记跟踪该肽段进入体内后各脏器及血液中的变化趋势,分析活性肽在小鼠肠道内的代谢稳定性,以期为功能性干酪的开发提供理论基础。
1 材料与方法
1.1 小鼠、菌株与试剂
雄性KM小鼠购买于吉林大学动物科学实验中心,生产许可证号:SCXK(吉)2018-0007,使用许可证号:SYXK(吉)2018-0001,体质量为20~25 g。
商业发酵剂乳酸乳球菌乳酸亚种(Lactococcus lactissubsp.lactis)和乳酸乳球菌乳脂亚种(Lactococcus lactissubsp.cremoris)混合菌种、凝乳酶Stamix 1150北京科汉森公司;鼠李糖乳杆菌Lactobacillus rhamnosus1.0911、瑞士乳杆菌Lactobacillus helveticus1.0612东北农业大学乳品科学重点实验室菌种库。
过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、总超氧化物歧化酶(total superoxide dismutase,T-SOD)试剂盒、过氧化氢酶(catalase,CAT)试剂盒 南京建成生物科技有限公司。
1.2 仪器与设备
LGJ-1冷冻干燥机 北京医用分析仪器厂;AKTA Explore蛋白质纯化系统 德国GE公司;Q Exactive Plus液相色谱四极杆高分辨质谱联用仪 美国赛默飞世尔科技有限公司。
1.3 方法
1.3.1 益生菌契达干酪的制备
将益生菌菌株以体积分数1%接种量接种到10 mL 12%(质量分数)复原脱脂乳中,37 ℃培养24 h,培养两代。再以体积分数2%接种量接种到60 mL 12%(质量分数)复原脱脂乳中,培养24 h,活菌数约为10(lg(CFU/mL))。
契达干酪的制备在Liu Lu等[20]方法的基础上略作调整。原料乳→过滤、巴氏杀菌(63 ℃,30 min)→冷却(32 ℃)→添加发酵剂和益生菌→发酵(32 ℃,60 min)→调整酸度→加氯化钙→添加凝乳酶→凝乳(32 ℃,90 min)→切割(1 cm3)→搅拌升温至42 ℃(每3~5 min升高1 ℃)→保温搅拌(30 min)→静置→排乳清→凝乳堆砌(每15 min反转堆积一次,反转7 次)→加盐→成型压榨→包装→成熟(6 个月)。
发酵剂和益生菌的添加量:B-0组:发酵剂添加量为0.01%(质量分数);B-1组:发酵剂添加量为0.01%(质量分数)、鼠李糖乳杆菌的添加量为12%(体积分数);B-2组:发酵剂添加量为0.01%(质量分数)、瑞士乳杆菌的添加量为12%(体积分数)。
1.3.2 益生菌契达干酪提取液的制备
干酪提取液的制备参考文献[21]并略作调整。在干酪成熟过程中,每30 d进行一次蛋白质的提取,即分别取干酪样品10 g溶于100 mL去离子水中,用匀浆机匀浆2 min。过滤、离心(4 000×g、20 min、4 ℃),取上清液即水溶性提取物,再对其进行冷冻干燥,冻干后的样品在-20℃下保存备用。
1.3.3 益生菌契达干酪体内抗氧化活性的测定
选取雄性KM小鼠48 只,干预前将各组小鼠进行适应性喂养一周。将小鼠随机分成6 组(正常对照组、衰老模型组、VC组以及3 个实验组),每组8 只。喂养时给小鼠相同的饲料,自由饮水、进食,并控制相同的相对湿度及温度。正常对照组每天按照0.1 mL/10 gmb的剂量注射生理盐水,其他组每天注射相同体积且质量浓度为50 mg/mL的D-半乳糖溶液。实验共进行28 d,每7 d记录一次小鼠的体质量。具体的注射及灌胃方式如表1所示,其中灌胃的干酪提取液及VC溶液的质量浓度均为1.0 mg/mL。

表1 各组小鼠的处理方式Table1 Grouping of experimental animals
将各组小鼠干预28 d后,对小鼠进行眼球取血(0.5 mL),并以脱颈法处死。取出的血液样本静置30 min后,6 000 r/min离心10 min,收集上清液获得血清,将血清置于液氮中速冻,在放入-80 ℃冰箱中待测。参照试剂盒说明书测定血清中SOD、CAT、GSH-Px和MDA的水平。
1.3.4 益生菌干酪抗氧化肽的结构特征鉴定
1.3.4.1 超滤分离
根据1.3.3节结果确定抗氧化活性最高的益生菌干酪提取液,将其冻干样品溶于蒸馏水中,使质量浓度达到5 mg/mL,选用截留分子质量为3、5、8、10 kDa的超滤膜对益生菌干酪提取液进行分离,得到4 个不同的多肽组分:ULTR-1:分子质量<3 kDa;ULTR-2:分子质量3~5 kDa;ULTR-3:分子质量5~8 kDa;ULTR-4:8~10 kDa;ULTR-5:分子质量>10 kDa。收集各组分后,冷冻干燥备用,以DPPH自由基清除率、羟自由基清除能力以及还原能力为考察指标,参考文献[22]测定各组分的抗氧化活性,选择抗氧化活性最高的组分进行后续的多肽纯化。
1.3.4.2 多肽纯化
利用AKTA Explore蛋白质纯化系统及凝胶色谱柱(分子质量1~20 kDa)对1.3.4.1节超滤分离后抗氧化活性最高的多肽组分进行进一步纯化。具体参照马穗[23]的方法进一步修改。平衡系统:清洗进样口和上样环,设定流速为0.5 mL/min,压力上限为1.8 MPa,所用溶剂为超纯水。当流量达到48 mL时(约2 倍柱体积)准备进样;进样:将排净气泡的1 mL 20 mg/mL样品吸入1 mL注射器中,缓慢匀速推动注射器,将样品注入上样环中;切换系统管路:运行系统,将样品倒入凝胶色谱柱中,观察系统压强;样品收集:通过观察的峰型图,对分离后不同峰对应的组分进行收集,而后将样品置于4 ℃保存。
参考文献[22]测定各个色谱峰组分的DPPH自由基清除率、羟自由基清除能力以及还原能力,确定抗氧化活性最强的色谱峰组分以进行后续结构鉴定。
1.3.4.3 利用液相色谱-质谱进行抗氧化肽的结构鉴定
选取1.3.4.2节纯化出的活性最高的组分,利用Q Exactive Plus-Orbitrap液相色谱(配备Acclaim PepMap 100A C18色谱柱)四极杆高分辨质谱联用仪分析其多肽的序列。流动相A为体积分数0.1%甲酸水溶液,流动相B为体积分数0.1%乙腈水溶液。进样量为2 μL,柱温为35 ℃,梯度洗脱程序见表2。质谱条件中离子扫描模式为正离子模式,扫描方式为全扫描,质量扫描范围:35~1 800m/z,离子源温度:280 ℃,数据利用Proteome Discoverer 2.1软件进行分析。

表2 梯度洗脱程序Table2 Gradient elution procedure
确定肽段序列后委托南京源肽生物科技有限公司进行多肽的合成,参考文献[22]测定不同合成肽的抗氧化活性。选取抗氧化活性最高的肽段进行后续实验。
1.3.5 抗氧化肽在小鼠体内代谢途径的测定
1.3.5.1 荧光标记肽的合成
选取1.3.4.3节中抗氧化活性最高的肽段进行荧光标记肽的合成(委托南京源肽生物科技有限公司完成)。主要流程为:树脂溶胀→接第一个氨基酸→脱保护→检测(变深蓝色为阳性反应)→洗(分别用二甲基甲酰胺(dimethylformamide,DMF)、甲醇和DMF洗涤两次)→缩合→洗(DMF一次、甲醇两次、DMF两次)→脱保护→检测(变深蓝色为阳性反应)→洗(分别用DMF、甲醇和DMF洗涤两次)→缩合→洗(DMF一次、甲醇两次、DMF两次)→检测(茚三酮检测阴性)→洗(用甲醇洗涤3 次)→从树脂上切割多肽→吹干洗涤→用高效液相色谱(high performance liquid chromatography,HPLC)纯化多肽。最后将纯化后的溶液冻干,既得到成品。将粉末状的多肽,密封包装,-20 ℃保存。经过HPLC鉴定,根据峰面积计算纯度为95.8%,色谱图如图1所示。
图1 荧光标记肽的HPLC图Fig. 1 HPLC chromatogram of fluorescently labeled peptide
1.3.5.2 血清中荧光标记肽质量浓度的测定
具体操作参考文献[24]的方法略作修改。
血液样本的制备:雄性KM鼠给药前禁食12 h,自由饮水,单次灌胃给药0.1 mL(质量浓度为0.5 mg/mL),剂量为2 mg/kgmb,分别在给药后每隔1 h,选择一组小鼠(3 只)取眼球血0.5 mL,并以脱颈法处死。取出的样本静置30 min后,于6 000 r/min离心10 min,取出血清后,置于液氮中速冻,在放入-80 ℃冰箱中待测。
血清样品的标准曲线:取小鼠的血液样本,用荧光标记肽标准液分别配制成质量浓度为0、0.5、1.0、2.0、3.0 μg/L的血清样品,并且用相同体积的生理盐水代替荧光标记肽标准液的血清样品作为对照。并分别加入生理盐水至1.4 mL,磁力搅拌1 min,静置10 min,并于12 000 r/min的条件下离心10 min后,取出上清液于荧光激发波长480 nm、发射波长515 nm处检测出荧光强度。绘制出血清中荧光标记肽的质量浓度与荧光强度间的标准曲线:y=18.379 6x+12.164 8,R2=0.998 9。
样品中荧光标记肽质量浓度的测定:取血清样品0.1 mL,置于2 mL生理盐水中,混匀后静置10 min,于12 000 r/min条件下离心10 min,取上清液在相同荧光条件下,测定血清样品的荧光强度。并根据绘制的标准曲线,计算出样品中荧光标记肽的质量浓度。
1.3.5.3 荧光标记肽在小鼠组织中分布情况测定
组织样品的制备:与血液样本的制备略有不同,给药后每隔1 h以脱颈法将其处死一组小鼠,迅速取出小鼠的内脏及脑组织,用生理盐水反复冲洗后,并用滤纸吸干称质量。用锡箔纸将样品包裹后,置于液氮中迅速冷冻并转置于-80 ℃冰箱中待测。
组织样品标准曲线测定:取正常对照组小鼠的组织样本匀浆,离心后取上清液,用荧光标记肽的标准液配制成不同质量浓度的组织样品中,并其用相同体积的生理盐水代替荧光标记肽标准液的样品作为对照。分别取不同质量浓度的组织样品和对照样品0.2 mL,按照1.3.5.2节方法绘制出组织样本中荧光标记肽的质量浓度与荧光强度间的标准曲线。
各组织中荧光标记肽质量浓度的测定:将组织样品中加入生理盐水后,于高速匀浆机下匀浆,并将匀浆液离心后取上清液,加入生理盐水,并于12 000 r/min的条件下离心10 min后,取出上清液于上述的相同荧光条件下,记录其荧光强度。并根据绘制的标准曲线,计算出样品中荧光标记肽的质量浓度。荧光标记肽在各组织中的标准曲线方程及决定系数如表3所示。

表3 荧光标记肽在各组织中的标准曲线方程Table3 Calibration curve equations for determination of fluorescently labeled peptide in various tissues
1.3.5.4 干酪抗氧化肽的体内抗氧化活性
体内实验方法同1.3.3节,处理方式为注射D-半乳糖+灌胃荧光标记肽,灌胃剂量为0.1 mL/10 gmb。参照试剂盒提供的方法测定血清中SOD、CAT、GSH-Px和MDA的水平。
1.4 数据处理与统计分析
本研究中各组实验独立重复3 次,数据结果用平均值±标准差表示;通过Origin 2018软件进行作图;数据统计分析采用Statistix 8.1中Linear Models程序进行,使用Tukey HSD进行差异显著性分析,其中P<0.05表示差异显著。
2 结果与分析
2.1 益生菌契达干酪体内抗氧化活性研究
2.1.1 干预期间小鼠体质量变化小鼠的体质量变化如表4所示,各组中小鼠体质量均随着时间的延长而逐渐增加,只有衰老模型组小鼠在21 d后开始略显消瘦,毛色光泽度较差并出现退毛现象。但5 组小鼠之间体质量变化差异不显著(P>0.05),对后续干酪抗氧化肽的体内稳定性研究结果无影响。

表4 干预期间小鼠的体质量变化Table4 Changes in mouse body mass during the intervention period
2.1.2 益生菌契达干酪的体内抗氧化活性
由表5可知,与正常对照组小鼠相比,衰老模型组小鼠血清中的SD、CAT、GSH-Px活力均显著下降,而MDA浓度显著上升(P<0.05),说明小鼠衰老模型的建立成功。与衰老模型组相比,B-0、B-1和B-2组中小鼠血清中的SOD、CAT、GSH-Px活力呈现不同程度的显著上升,MDA浓度均显著下降(P<0.05),说明灌胃空白干酪以及益生菌干酪均可提高小鼠体内的抗氧化水平。与衰老模型组相比,B-0和B-1组小鼠抗氧化能力虽有所改善,但变化幅度较小,B-2组小鼠血清中的SOD、CAT、GSH-Px活力分别为(281.82±7.89)、(21.22±2.25)U/mL和(99.74±5.03)U/mL,与衰老模型组相比分别提升了45.98%、35.33%和37.93%,且与正常对照及VC组间的差异不显著(P>0.05);其MDA的浓度下降最多,与衰老模型组相比下降了19.79%。以上结果说明利用L.helveticus作为非发酵剂乳杆菌制备的干酪,对衰老模型组小鼠抗氧化水平的改善效果最好。这可能由于该菌株蛋白水解能力强,可将酪蛋白中高抗氧化活性的肽段释放,进而更有效地抑制衰老小鼠氧化应激反应的发生。

表5 益生菌契达干酪的体内抗氧化能力Table5 Effect of probiotic Cheddar cheeses on antioxidant capacity in mice
2.2 超滤分离益生菌契达干酪提取液结果
鉴于B-2组体内抗氧化活性最高,因此对B-2组干酪提取液进行超滤分离,并测定抗氧化活性。结果如表6所示。

表6 超滤分离契达干酪提取液所得组分及其抗氧化活性Table6 Ultrafiltration fractions of water-soluble extracts from Cheddar cheeses and their antioxidant activity
由表6可知,共得到分子质量小于3、3~5、5~8、8~10 kD和大于10 kDa共5 个组分,其中分子质量小于3kDa的ULTR-1组分抗氧化活性最高,其DPPH自由基清除率、还原能力、羟自由基清除率可分别达到(82.63±0.27)%、0.91±0.06和(87.28±0.33)%,且所占的比例最高,达到(42.63±0.32)%。这与Zhang Chi等[25]的研究结果相似。分子质量越小的肽段,其抗氧化活性最高,这可能是由于分子质量大的肽段,空间位阻大,使得一些具有抗氧化活性的氨基酸无法暴露出来,进而无法发挥其抗氧化的作用[4]。
2.3 蛋白质纯化系统纯化ULTR-1组分的结果
由图2可知,利用蛋白质纯化系统纯化ULTR-1组分时,共得到了5 个色谱峰,并且5 个色谱峰均完全分离,并分别收集5 个色谱峰所对应的组分,对收集后的组分进行抗氧化活性测定,结果如表7所示。

图2 ULTR-1组分的蛋白质纯化色谱图Fig. 2 Separation chromatogram of ULTRA-1
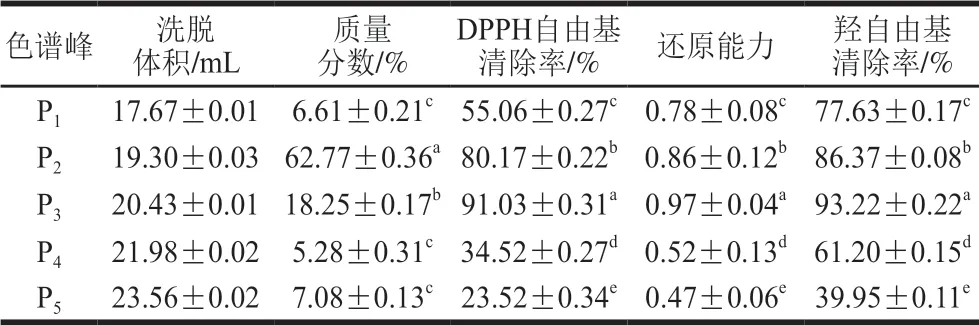
表7 ULTR-1组分纯化所得5 个组分的抗氧化活性Table7 Antioxidant activity of five subfractions purified from ULTR-1
由表7可知,色谱峰P2对应组分质量分数最高,为(62.77±0.36)%;色谱峰P3对应组分的抗氧化活性最高,DPPH自由基清除率为(91.03±0.31)%、还原能力为0.97±0.04、羟自由基清除率为(93.22±0.22)%。根据色谱柱分离原理,当混合物随流动相经凝胶柱时,分子质量较大肽段的分子不能进入凝胶网孔而受到排阻,它们将与流动相一起首先流出,而根据所选择的凝胶色谱柱的规格,ULTR-1组分理论上应全部进入凝胶网孔,这部分肽段中较大的先流出凝胶网孔,较小的分子后流出。因此,其后流出的P4、P5组分抗氧化活性较低的原因可能是由于肽段在酶的作用下水解成一些不具抗氧化活性的氨基酸。
2.4 干酪抗氧化肽结构鉴定结果
利用液相四极杆高分辨质谱联用仪对蛋白质纯化系统分离的到的P3组分进行肽段结构的鉴定。经过液相色谱仪时将样品进行分离,通过质谱仪将分离的成分逐个打碎成离子碎片,并根据离子碎片鉴定出氨基酸序列,通过与已知的数据库进行比对后,确定了酪蛋白源的抗氧化肽共6 种,具体结果如表8所示。由表8可知,P3组分中具有抗氧化活性的肽段为5~17肽不等。与前人研究的干酪中的生物活性肽结果[4,26]相比,添加了瑞士乳杆菌的干酪水溶性提取物所获得的肽段更短。在所得的6 个肽段中,分子质量相对较大的,其抗氧化活性相对较低,这可能是因为肽链较长,空间位阻较大,影响生物活性[4]。从所获得的肽段来看,大部分来自于β-酪蛋白,只有一条肽链来自于αs1-酪蛋白。本研究所获得的6 种肽段中,有4 种都含有Pro(P),且均处于N末端的第二位。除此之外,所获得的肽链中,疏水性氨基酸Leu(L)、Phe(F)和芳香族氨基酸Tyr(Y)含量较高,这是因为酪氨酸酚羟基上的氢是优良的氢供体,可清除原有的自由基[27-29]。其抗氧化活性最高的肽段QPHQP来自于β-酪蛋白(146~150),同时也是分子质量最小的一个,并且N末端倒数第二位为Pro(P),且肽链中含有一个组氨酸His(H),内部含有咪唑基,可通过鳌合金属离子来增加肽链的抗氧化活性,Saito等[30]得到了同样的结论。本研究中喂养肽段QPHQP小鼠血清中的SOD、CAT、GSH-Px活力分别为(301.12±6.12)、(23.42±1.56)、(112.93±3.29)U/mL,MDA浓度为(236.73±4.32)nmol/mL。

表8 P3组分的肽段序列及其抗氧化活性Table8 Peptide sequences and antioxidant activity of antioxidant peptides identified in P3
2.5 益生菌契达干酪抗氧化肽体内代谢稳定性研究结果
2.5.1 荧光标记肽在血清中的分布情况
由图3可知,随着时间的延长,小鼠血清中的荧光标记肽的质量浓度逐渐上升,在2 h后达到峰值(2.56±0.06)μg/mL。随后开始下降,在8 h后开始逐渐趋于稳定,此时质量浓度仅为(0.89±0.05)μg/mL,与质量浓度峰值(2 h时)相比下降了65.23%,这是由于荧光标记肽在这段时间内,随血液循环逐渐转移至靶器官而发挥其抗氧化的作用。在8 h后逐渐趋于平稳,在12 h后仍有部分残留,是因为部分抗氧化肽留在了血液中,可能与血清中的某一成分相结合或发挥了作用,这与尹天旸[24]的结果相似,均在2 h达到了峰值,而后随时间的延长逐渐下降。

图3 小鼠血清中荧光标记肽质量浓度Fig. 3 Concentration of fluorescently labeled peptide in mouse serum
2.5.2 荧光标记肽在小鼠体内的分布情况
由图4可知,相同时间段内,胃部荧光标记肽含量均高于其他组织,且随着时间的延长,其含量快速下降。然而其他组织中,荧光标记肽的含量均随着时间延长先逐渐上升,在2 h后,肠、肾、肝、肺中均达到了最大值,分别为(86.42±1.56)、(5.58±0.09)、(15.47±0.44)、(10.88±0.59)μg/kg;而在4 h后荧光标记肽含量在心脏和脾脏达到最大值,分别为(7.16±0.29)、(4.32±0.13)μg/kg;在8 h后,脑中的抗氧化肽含量达到了最大值,为(4.23±0.11)μg/kg。

图4 小鼠各组织中荧光标记肽含量随时间变化Fig. 4 Changes in fluorescently labeled peptide contents in mouse tissues over time
灌胃1 h后,胃内荧光标记肽含量含量最高,为(138.52±1.84)μg/kg。在灌胃2 h后,主要集中在胃肠道内,同时在肠、肾、肝、肺中也逐渐达到了最大值,并且除胃肠道外,在肝脏中的含量最高。这说明在前2 h,荧光标记肽大部分随血液流向了肝脏,并且肝脏对这一抗氧化肽的利用度最高。4 h后,消化道内的荧光标记肽含量仍然高于其他组织,并且随着血液的循环心脏和脾达到的峰值。8 h后,在脑组织中的荧光标记肽含量达到的最大值,且在脑组织中的含量始终低于其他组织,这说明该抗氧化肽只有一小部分可通过脑组织屏障。大部分肽在8 h内均随血液循环到达了靶器官,且消化道内的抗氧化肽含量下降至不到灌胃1 h时的30%,且所有器官内的荧光强度均开始逐渐下降。而后,随着时间的延长,所有组织器官中肽的含量均逐渐下降。在整个代谢过程中,除消化道外,肝脏中的抗氧化肽含量始终高于其他组织,这说明抗氧化肽主要在蓄积在肝脏中,并参与其中的氧化代谢反应,进而发挥其抗氧化作用。
3 结 论
益生菌契达干酪提取液可显著提高衰老小鼠血清中抗氧化酶的活性,显著降低氧化产物丙二醛的浓度,与相同质量浓度VC的抗氧化能力相当。从添加了瑞士乳杆菌的契达干酪提取液中共鉴定出6 种抗氧化肽,分别为MPFPKYPVEPFTESQSL、YPFPGPIPN、QPHQP、QTEDELQDK、YFYPEL、MPIQAFLLY,其中QPHQP抗氧化活性最高。干酪抗氧化肽可随血液循环遍布动物各个器官,但主要蓄积在肝脏并参与其中的氧化代谢反应,进而起到抗氧化的作用,提高机体的抗氧化能力。
