山茱萸籽多糖分离纯化、结构表征及抗氧化活性
2021-10-31何坤明王国锭白新鹏刘亚文时振振姜宗伯
何坤明,王国锭,白新鹏,刘亚文,时振振,姜宗伯
(海南大学食品科学与工程学院,热带多糖资源利用教育部工程研究中心,海南省食品营养与功能食品重点实验室,海南省南海水产资源高效利用工程研究中心,海南 海口 570228)
山茱萸(Cornus officinalis)是我国著名的传统药用植物,分布在中国中部,如山西、河南、湖南等省份。其果肉传统上被用作滋补消炎食品,可改善肝肾功能[1],在中医中被用于治疗糖尿病、癌症和休克[2]。山茱萸籽是山茱萸果实留下的果仁,富含多糖、蛋白质和油脂等成分。目前为止,山茱萸籽利用率极低,且对山茱萸籽多糖的研究报道较少。
多糖是10 个或10 个以上单糖通过糖苷键缩聚而成的聚合物[3],主要存在于动植物的体内和微生物的细胞壁中。它们分为植物多糖、动物多糖和微生物多糖[4]。随着工业的发展,多糖被广泛应用于食品[5]、医药[6]、材料领域[7]。几十年来,多糖以其生物调节和生物活性吸引了生物学家,包括免疫[8]、抗氧化[9]、抗肿瘤[10]和降低血糖活性[11]。一般认为,与化学合成的抗氧化剂相比,大量的天然多糖一般具有良好的生物相容性、生物降解性和无毒性等优点[12]。研究表明,过量活性氧引起的氧化应激可引起多种严重威胁人类健康的疾病,如糖尿病、癌症、动脉粥样硬化、阿尔茨海默症和帕金森氏症[13]。据报道,天然多糖通过减少活性氧的产生而有利于抗氧化应激[14]。因此,从食品工业的自然资源中发现和开发具有抗氧化能力的多糖具有重要意义[15]。
多糖的提取、分离和纯化是研究多糖结构和活性的基础,只有得到相对纯度较高的多糖组分,才能更好地分析其结构,从而探究其重要的生理功能。多糖结构是其生物活性的基础,多糖的结构分析在多糖的研究中具有非常重要的地位,是糖化学的核心所在。本实验采用亚临界水萃取技术对山茱萸籽多糖进行提取,亚临界水是指温度介于沸点和临界温度之间,维持适当压力使水保持为液体状态的水[16],作为一种新型绿色提取技术,与传统水提取法[17]、超声波辅助提取法[18]、酸碱提取法相比,亚临界水提取法具有绿色环保、得率高、省时、产物结构稳定等优点,目前在多糖、多酚、黄酮和花青素等天然产物提取方面得到广泛应用[19]。通过对山茱萸籽多糖进行分离纯化、结构特征及抗氧化性活性进行研究,旨在为山茱萸籽多糖的开发和应用提供理论依据。为进一步对山茱萸籽多糖开发为功能性食品及解析多糖构效关系提供理论参考。
1 材料与方法
1.1 材料与试剂
山茱萸籽购于河南南阳宛西制药厂。
无水乙醇、质量分数30% H2O2、葡萄糖、氢氧化钠、氯化钠 西陇科学股份有限公司;没食子酸、质量分数98%浓硫酸、苯酚 广州化学试剂厂;福林-酚试剂 北京索莱宝科技有限公司;以上试剂均为分析纯。单糖标准品(甘露糖(mannose,Man)、果糖(fructose,Fuc)、鼠李糖(rhamnose,Rha)、葡萄糖醛酸(glucuronic acid,GlcA)、半乳糖醛酸(galacturonic acid,GalA)、葡萄糖(glucose,Glc)、半乳糖(galactose,Gal)和木糖(xylose,Xyl))(色谱纯) 上海源叶生物科技有限公司。
1.2 仪器与设备
HT-500FC型亚临界水设备 上海霍桐实验仪器有限公司;GL-20G-II型高速冷冻离心机 上海安亭科学仪器厂;752N型紫外-可见分光光度计 上海仪电分析仪器有限公司;T27型傅里叶变换红外光谱仪、500 MHz超导核磁共振光谱仪 德国布鲁克公司;NW10VF型超纯水系统 上海力康生物科技有限公司;FDU-2100型冷冻干燥机 上海埃朗科技国际贸易有限公司;1100高效液相色谱仪 美国安捷伦公司;Verios G4扫描电子显微镜 美国赛默飞世尔科技公司;液相色谱-质谱联用仪(liquid chromatograph-mass spectrometer,LC-MS)上海沃特世科技有限公司。
1.3 方法
1.3.1 山茱萸籽多糖的萃取
山茱萸籽经80 ℃干燥24 h后,研磨机研磨,过60 目筛,备用。称取10 g山茱萸籽粉,采用亚临界水设备萃取,萃取条件为:萃取温度160 ℃;萃取时间20 min;料液比为1∶40(m/V)[20]。萃取完成后,用冷水快速冷却萃取液。萃取液浓缩,8 000 r/min离心10 min,去除沉淀。上清液中加入4 倍体积的无水乙醇,4 ℃放置12 h后,8 000 r/min离心10 min,收集沉淀,冷冻干燥,得山茱萸籽粗多糖,多糖得率(山茱萸籽多糖质量/山茱萸籽质量)可达(17.25±0.15)%。
1.3.2 山茱萸籽多糖脱色、脱蛋白
称取500 mg山茱萸籽粗多糖,溶于蒸馏水中配制成5 mg/mL山茱萸籽多糖溶液,加入5 mL 30% H2O2[21],用1 mol/L NaOH溶液调节pH值至9,在40 ℃下水浴1 h进行脱色,6 000 r/min离心5 min得澄清透明粗多糖溶液。
脱色后的多糖溶液加入1/2体积的Sevag试剂(氯仿与正丁醇体积比为4∶1)脱除蛋白质[22],剧烈振荡20 min,移入分液漏斗中静置20 min,弃去中间蛋白层与下层物质,多次重复上述步骤至观察到无明显的中间蛋白层,100 ℃旋转蒸发浓缩多糖溶液至50 mL左右,装入透析袋透析48 h,透析袋外液为500 mL蒸馏水,每隔12 h更换一次蒸馏水,从而除去多糖溶液中的盐类及小分子杂质。透析后将多糖溶液冷冻干燥,即可获得山茱萸籽多糖,多糖回收率(纯化后山茱萸籽多糖质量/粗山茱萸籽多糖质量)为(72.14±0.41)%。
1.3.3 阴离子交换柱层析分离纯化山茱萸籽多糖
采用DEAE-52纤维素柱对山茱萸籽多糖进行分离纯化[23]。称取500 mg山茱萸籽多糖样品,溶于50 mL蒸馏水中,配制成质量浓度为10 mg/mL的多糖溶液,0.45 μm过滤膜过滤,每次上样体积5 mL,上样至DEAE-52纤维素柱,用蒸馏水和0.1、0.2、0.3、0.4、0.5 mol/L NaCl溶液以1.0 mL/min的流速逐步洗脱。采用自动馏分收集器每管收集5 mL馏分。以葡萄糖为标准品,用苯酚-硫酸法[24]测定多糖馏分490 nm处的吸光度A490nm。合并同一吸收峰洗脱液,共得到5 个多糖组分(COSP-1、COSP-2、COSP-3、COSP-4和COSP-5),100 ℃旋转蒸发浓缩溶液至50 mL左右,装入透析袋透析48 h,具体方法同1.3.2节。将透析后的溶液冷冻干燥到5 个多糖组分。
1.3.4 葡聚糖凝胶柱层析纯化山茱萸籽多糖组分
采用Sephadex G-100对主要馏分COSP-4进一步分离纯化:层析柱规格为1.6 cm×50 cm;上样质量浓度10 mg/mL;上样体积4 mL;蒸馏水洗脱,流速为0.4 mL/min;采用自动馏分收集器每管收集2 mL馏分。采用苯酚-硫酸法于490 nm波长处测定每管洗脱液的吸光度,绘制洗脱曲线,根据出峰位置收集主要馏分COSP-4,100 ℃旋转蒸发浓缩溶液至50 mL左右,装入透析袋透析48 h,具体方法同1.3.2节。将透析后的溶液冻干得到多糖纯化组分COSP-4。
1.3.5 多糖组分的纯度鉴定
采用紫外光谱分析多糖组分纯度,将山茱萸籽粗多糖及纯化组分COSP-4分别配制成质量浓度为0.5 mg/mL的多糖溶液,以水作为空白对照,在200~400 nm波长范围内进行紫外光谱扫描,确定山茱萸籽多糖样品特征吸收峰,同时检测多糖组分中是否有蛋白质及核酸残留。
1.3.6 多糖分子质量的测定
多糖的均一性和分子质量测定采用高效凝胶渗透色谱(high performance gel permeation chromatography,HPGPC)法[25],高效液相色谱(high performance liquid chromatography,HPLC)系统配备折射率检测器和超水凝胶线性凝胶过滤色谱柱。
1.3.7 傅里叶变换红外光谱分析
将山茱萸籽多糖纯化组分COSP-4和KBr按质量比1∶40混合研磨,压片机压片。样品测试前进行背景扫描去除干扰,在4 000~500 cm-1的条件下,测定多糖的有机官能团。
1.3.8 单糖组成的测定
采用1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-menthy-5-pyrazolone,PMP)柱前衍生化和LC-MS检测分析单糖组成[26]。取10 mg样品,用5 mL 2 mol/L三氟乙酸(trifluoroacetic acid,TFA)在100 ℃下水解2 h,冷却后打开盖,取1 mL水解后样品溶液加入1 mL无水甲醇,70 ℃水浴下用N2吹干,如此重复加无水甲醇并用N2吹干2 次,以去除TFA;分别取400 μL的混合单糖标准溶液或多糖水解液于5 mL的具塞试管中,加400 μL 0.5mol/L的PMP-无水甲醇溶液,漩涡混匀,于70 ℃水浴中反应2 h;取出放置冷却至室温,加400 μL 0.3 mol/L HCl中和(pH 6~7);加1 200 μL去离子水,再加等体积的氯仿,漩涡混匀振摇,静置,弃去氯仿相,如此萃取2 次。将水相用0.45 μm微孔滤膜(水系)过滤后待进样分析。色谱条件:色谱柱:EC-C18柱(2.1 mm×50 mm,2.7 μm);流动相A:20 mmol/L乙酸铵缓冲溶液(pH 7.0);流动相B:乙腈;流速0.4 mL/min;进样量:20 μL。MS扫描条件:特征离子扫描模式;正离子模式电喷雾离子源电压2.0 kV;锥孔电压30 V;离子源温度150 ℃;脱溶剂温度500 ℃;脱溶剂气(N2)流速1 000 L/h;特征离子m/z:481.09、495.1、510.1、511.08、525.06。通过比较样品与单糖标准品色谱图的保留时间,确定单糖组成。
1.3.9 扫描电子显微镜观察
用扫描电子显微镜对多糖的微观结构进行观察。取适当的样品并黏附在扫描电子显微镜样品盘上。用粉尘球吹走多余的样品,并喷金,观察样品的表面结构。
1.3.10 甲基化反应及气相色谱-质谱分析单糖残基连接方式
样品衍生化:称取10 mg山茱萸籽多糖COSP-4样品,加入1 mL蒸馏水溶解,加入1 mL 100 mg/mL碳二亚胺,反应2 h。加入1 mL 2 mol/L的咪唑,将样品平均分为2 份,分别加入1 mL 30 mg/mL的NaBH4和1 mL 30 mg/mL的NaBD4,反应3 h,加入100 μL冰醋酸终止反应。透析样品48 h,透析完成后冷冻干燥样品,进行甲基化处理。冻干样品中加入500 μL 二甲基亚砜溶解,加入1 mg NaOH,孵育30 min,加入50 μL碘甲烷溶液反应1 h,加入1 mL去离子水和2 mL二氯甲烷,漩涡混匀,6 000 r/min离心10 min,弃去上层水相,重复水洗3 次,吸取下层二氯甲烷相并蒸干。加入100 μL 2 mol/L TFA,121 ℃反应90 min,30 ℃蒸干,加入50 μL 2 mol/L氨水和50 μL 1 mol/L NaBD4,混匀后室温反应2.5 h。加入20 μL乙酸终止反应,氮气吹干,250 μL无水甲醇洗两次,氮气吹干。加入250 μL乙酸酐,漩涡混匀,100 ℃反应2.5 h。加入1 mL超纯水静置10 min,加入500 μL二氯甲烷,涡旋混匀,6 000 r/min离心10 min,弃水相,重复水洗3 次,取下层二氯甲烷相,上机检测。
气相色谱-质谱分析(gas chromatography-mass spectrometry,GC-MS):GC条件:进样量为1 μL,分流比10∶1,载气为高纯氦气;柱温箱的初始温度为140 ℃保持2.0 min,以3 ℃/min程序升温至230 ℃,保持3 min;MS条件:质谱系统采用的是美国Aiglent公司的四极杆质谱检测系统,配有电子轰击离子源和MassHunter工作站。采用电子轰击离子源全扫描模式进行检测,质量扫描范围(m/z):30~600。
1.3.11 核磁共振波谱分析多糖糖苷键的构型
称取50 mg样品溶解在D2O中。使用500 MHz超导核磁共振光谱仪,在25 ℃记录核磁共振(nuclear magnetic resonance,NMR)的1H-NMR谱图和13C-NMR谱图。
1.3.12 DPPH自由基清除率的测定
根据文献报道[27]稍作修改,对COSP-4的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除活性进行实验分析。将溶解于乙醇中的3 mL 0.1 mmol/L DPPH溶液加入至2 mL不同质量浓度(1.0~5.0 mg/mL)的COSP-4溶液中,避光反应30 min,于517 nm波长处测定吸光度。无DPPH的反应混合物作为对照,VC作为阳性对照。按式(1)计算DPPH自由基清除率。
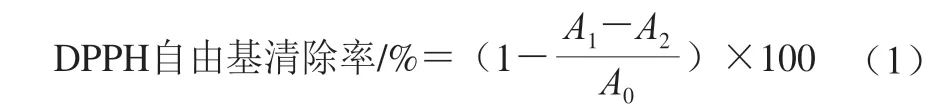
式中:A0为无样品的反应混合物溶液吸光度;A1为样品与DPPH溶液的吸光度;A2为无DPPH的反应混合物溶液吸光度。
1.3.13 羟自由基清除率的测定
取0.2 mL不同质量浓度的COSP-4(1.0~5.0 mg/mL)与1 mL 6 mmol/L FeSO4、1 mL 6 mmol/L水杨酸-乙醇溶液和1 mL 6 mmol/L H2O2溶液混合。混合溶液在37 ℃水浴中反应1 h,510 nm波长处测定吸光度[28]。以无H2O2溶液的反应混合物作为对照,VC作为阳性对照。按式(2)计算羟自由基清除率。
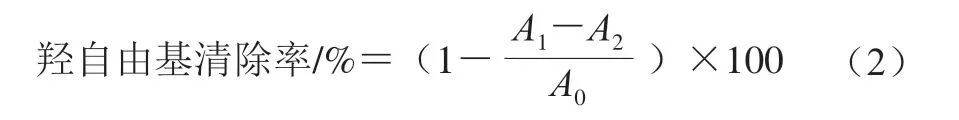
式中:A0为无样品的反应混合物溶液的吸光度,A1为样品组混合溶液吸光度,A2为无H2O2溶液的反应混合物溶液的吸光度。
1.3.14 ABTS阳离子自由基清除率的测定
根据文献[29]稍作修改,测定COSP-4的2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除率。0.384 g ABTS和0.066 g过硫酸钾溶解在100 mL蒸馏水中,室温下避光反应12 h,得到ABTS溶液。将10 mL ABTS溶液用pH 7.4 0.01 mol/L磷酸缓冲液稀释50 倍,使734 nm波长处吸光度约为0.7。将1 mL COSP-4溶液(1.0~5.0 mg/mL)与1 mL蒸馏水和2 mL ABTS工作液混合,充分混匀后室温避光10 min,在734 nm处测定吸光度。未加入ABTS的反应混合物作为对照,VC作为阳性对照按公式(3)计算ABTS阳离子自由基清除率。
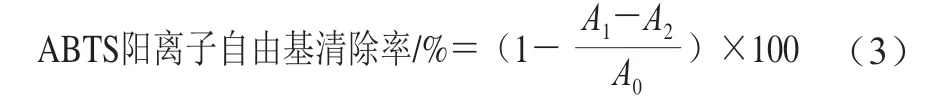
式中:A0为无样品的反应混合物溶液吸光度;A1为样品组吸光度;A2为无ABTS的反应混合物溶液吸光度。
1.4 数据处理与分析
采用Excel 2010软件进行数据处理,所有数据为3 次重复,以平均值±标准差表示。采用Origin 8.6软件、MestReNova软件进行绘图。
2 结果与分析
2.1 阴离子交换柱层析分离纯化山茱萸籽多糖的结果
DEAE-52纤维素柱为阴离子交换层析柱,能根据样品所带电荷的强弱将其分成不同的组分。由图1可知,经过蒸馏水和0.1、0.2、0.3、0.4 mol/L NaCl溶液进行洗脱,得到5 个多糖组分(COSP-1、COSP-2、COSP-3、COSP-4和COSP-5)。收集含量最高的多糖组分COSP-4,浓缩后透析,冻干得白色粉末,为山茱萸籽多糖初步分离纯化组分COSP-4,回收率为20%左右。
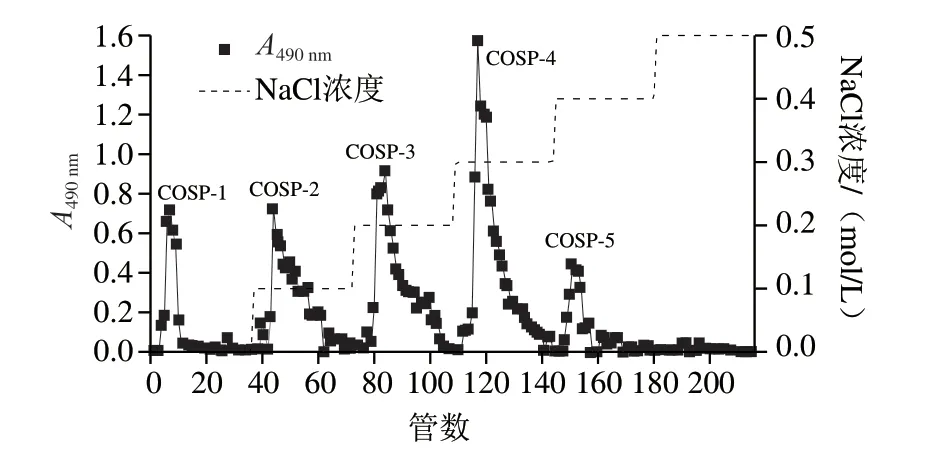
图1 山茱萸籽多糖的DEAE-52柱层析洗脱图Fig. 1 DEAE-52 anion-exchange column chromatography elution curve of Cornus officinalis seed polysaccharides
2.2 葡聚糖凝胶柱层析结果
凝胶色谱柱是根据分子质量大小对样品进行分离纯化,分子质量大的分子先流出色谱柱,分子质量小的后流出,从而达到分离效果[30]。利用Sephadex G-100对经过离子交换柱初步分离的山茱萸籽多糖COSP-4组分进行进一步的纯化。
如图2所示,用Sephadex G-100纯化后的COSP-4为单峰,表明多糖样品纯度较高,为均一组分。主要馏分收集、浓缩、透析,冻干得精制的山茱萸籽多糖组分COSP-4呈白色粉末状,回收率为70%。
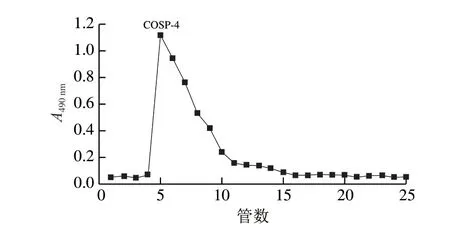
图2 COSP-4组分的Sephadex G-100柱层析洗脱图Fig. 2 Sephadex G-100 column chromatography elution curve of COSP-4
2.3 多糖组分COSP-4的纯度鉴定结果
在紫外吸收光谱图中,溶液在200 nm~300 nm范围内的吸收峰可以验证多糖中是否含大量的蛋白质及核酸[31],从图3可以看出,山茱萸籽粗多糖在280 nm处有明显的吸收峰;而COSP-4在260 nm和280 nm处无明显的吸收峰,初步表明纯化多糖COSP-4几乎不含蛋白质与核酸,多糖纯度较高。
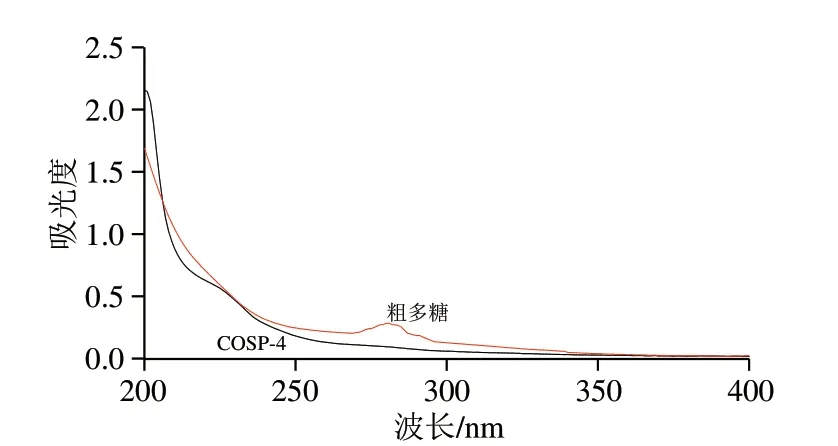
图3 COSP-4组分的紫外吸收光谱图Fig. 3 UV absorption spectra of the crude polysaccharide and COSP-4
2.4 多糖分子质量测定结果
分子质量是多糖的重要结构指标,影响多糖的理化和生物活性等性质。采用HPGPC法测定COSP-4的平位均分子质量。COSP-4的分子质量约为2.03×104Da。峰位分子质量(mp)为20 279 Da,重均分子质量(mw)为17 359 Da,数均分子质量(mn)为14 566 Da。多分散性指数(mw/mn)为1.191,接近1,说明COSP-4的平均分子质量分布较集中,结合葡聚糖凝胶柱层析结果分析表明COSP-4纯度较高。
2.5 COSP-4红外光谱分析结果
如图4所示,COSP-4的红外光谱图在3 442 cm-1附近出现了宽而强烈的吸收峰,表明氢键中存在羟基伸长[32]。在2 927 cm-1附近的吸收峰是—CH3或—CH2—的弱C-H键的伸缩振动所致[33]。1 637 cm-1和1 440 cm-1处的两个峰分别是羧酸基的不对称和对称伸缩振动引起[34]。这证实了在COSP-4中存在糖醛酸,与单糖组成分析结果一致。同时,在1 730 cm-1附近没有明显的吸收峰,说明COSP-4中的葡萄糖醛酸没有酯化[35]。1 382 cm-1处的弱吸收峰为烷基的C-H变角振动吸收峰。在1 103 cm-1附近的弱吸收峰是吡喃环骨架的C-O变角振动吸收峰,表明分子中存在C-O-H和C-O-C结构[36]。在777 cm-1处存在弱吸收峰,推测含有吡喃环结构,其他结构有待进一步研究证实。
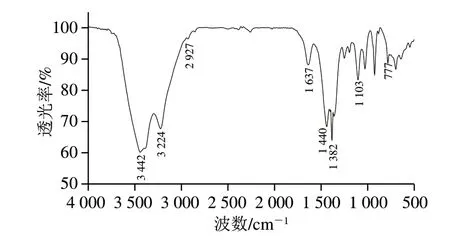
图4 COSP-4的傅里叶变换红外吸收光谱图Fig. 4 Fourier transform infrared spectrum of COSP-4
2.6 单糖组成分析结果
单糖组成分析在植物多糖的结构与功效、中药材的检测与鉴定等方面有着十分重要的作用[37]。实验采用LC-MS分析COSP-4的单糖组成。
如图5所示,Man、Rha、GlcA、GalA、Glc、Gal、Xyl、Fuc出峰时间依次为5.18、6.37、7.53、7.85、8.59、9.14、9.56、10.50 min,出峰分离度较好,无干扰现象,可作为多糖单糖组成进一步分析的依据。通过比较标准品与COSP-4保留时间确定单糖种类,根据各峰面积比计算单糖的物质的量之比。COSP-4是一种由6 种单糖组成的酸性多糖。由Rha、GlcA、GalA、Glc、Gal和Xyl组成,物质的量比为0.96∶0.18∶5.48∶0.28∶1∶10.70,其中Xyl含量最高。
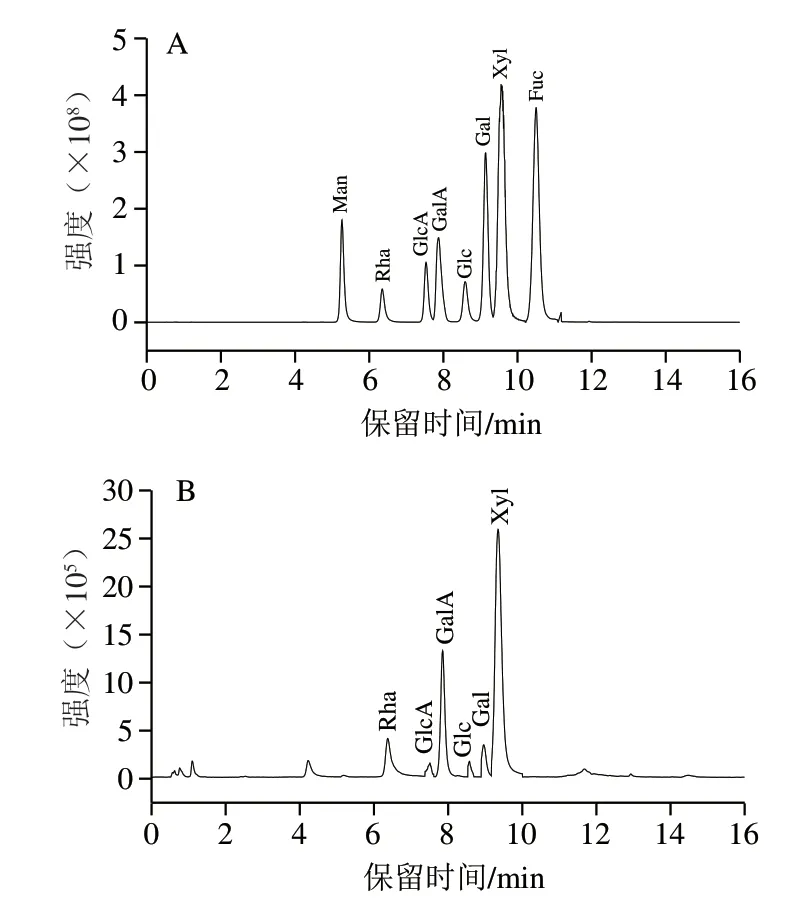
图5 混合标准品(A)和COSP-4样品(B)的单糖组成LC-MS图Fig. 5 Liquid chromatograph-mass spectrometry chromatograms of mixed monosaccharide standard (A) and monosaccharide composition of COSP-4 (B)
2.7 COSP-4的微观结构
如图6A所示,在5 000 倍下山茱萸籽多糖纯化组分COSP-4主要是由不规则和支离破碎的结构组成,并穿插带有一些小的不规则颗粒,表面有碎片,为粗糙片状。如图6B所示,在30 000 倍下观察到COSP-4疏松多孔,类似于海绵结构,多糖结构表面粗糙,结构松散。其结构与山茱萸果肉多糖结构[38]较为相似,均呈不规则形状。

图6 COSP-4的扫描电子显微镜图Fig. 6 SEM images of COSP-4
2.8 COSP-4单糖残基连接方式分析结果
甲基化分析是测定多糖糖链中各种单糖残基连接方式的重要手段之一。甲基化反应是用甲基取代多糖上连接的羟基,然后完全酸水解取代后的产物,最后将水解产物进行GC-MS检测分析,获得不同甲基化的单糖及其比例关系。如表1所示,在COSP-4中检测到14 种甲基化糖,结果表明山茱萸籽多糖纯化组分COSP-4中含量最高单糖结构为1,4,5-三乙酰基-2,3-二甲基木糖,物质的量分数为37.98%,其次为1,5-二乙酰基-2,3,4-三甲基木糖,物质的量分数为18.30%。实验对山茱萸籽多糖纯化组分COSP-4链状结构主要成分进行了初步确定,为山茱萸籽多糖主链、侧链的确定及三维空间结构探索奠定一定的基础。
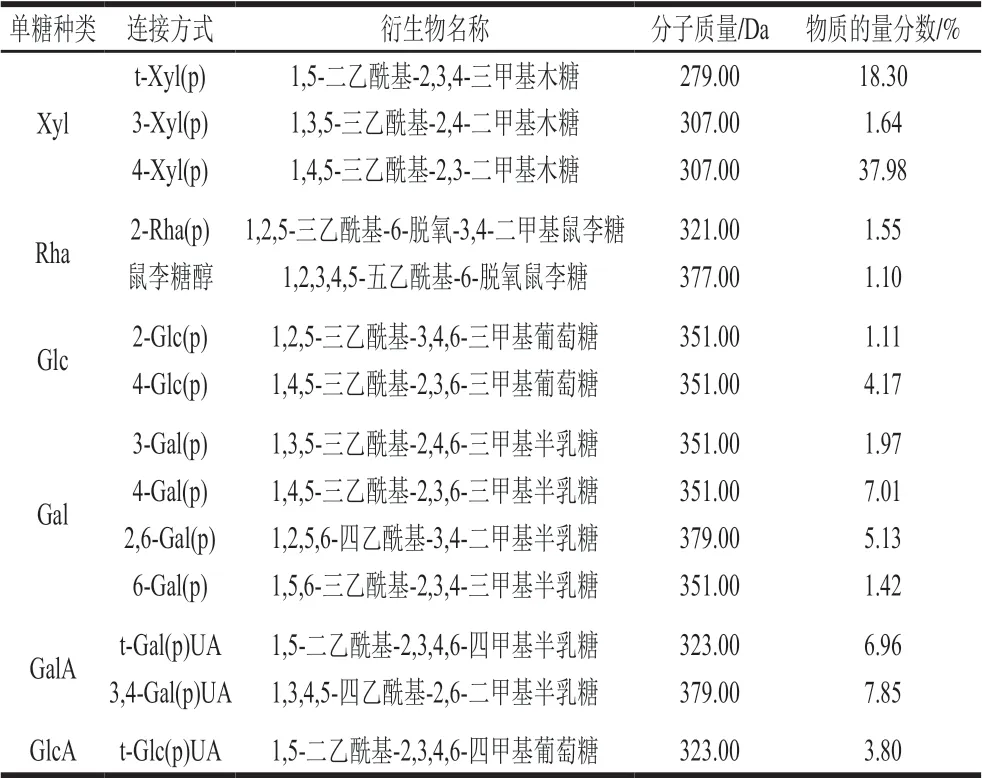
表1 COSP-4的甲基化反应及GC-MS分析数据Table1 Methylation reaction and gas chromatography-mass spectrometry analysis of COSP-4
2.9 COSP-4核磁共振波谱分析结果
糖苷键的构型和异头碳在多糖结构中的构型可用一维核磁共振(1H-NMR和13C-NMR)技术分析。1H-NMR主要用于解决多糖结构中糖苷键的构型问题。一般来说,不规则质子残留在δ5.00以上的质子在α构型中有化学置换,而低于δ5.00的质子在β构型中有化学置换。因此,这两种糖可以通过δ值来区分。COSP-4的一维核磁(1H和13C)光谱如图7所示。如图7A所示,在COSP-4的1H-NMR谱中分别出现6 个1H信号,分别为δ5.75、5.24、5.12、5.06、4.89、4.45,表明COSP-4中的残基同时包含了α构型糖基和β构型糖基[39],同时表明,COSP-4中有6 种糖残基,与单糖组成及甲基化反应对应的GC-MS分析结果一致。
与1H-NMR相比,13C-NMR化学位移范围宽广,分辨率高,可以解析异头碳的构型,多糖残基中取代位点和分支点。在13C-NMR波谱中,在区域内的共振被指定为异头碳原子。在邻域δ101.69处有1 个异头碳信号,属于1 个异头碳残基的C1。一般来说,与α构型连接的C1化学位移比β构型低δ1.5~3.0,α构型的化学位移是δ97~101,β构型是δ103~105。从图7B中可以看出,在COSP-4中主要存在有α构型糖基。C2~C5信号的δ值均集中在δ70~77之间,说明其中大部分尚未被取代。在δ60~70之间都有化学位移,说明C6位置羟基一部分发生取代,一部分未发生取代。此外,δ16.57处的化学位移是由于鼠李糖的C6。
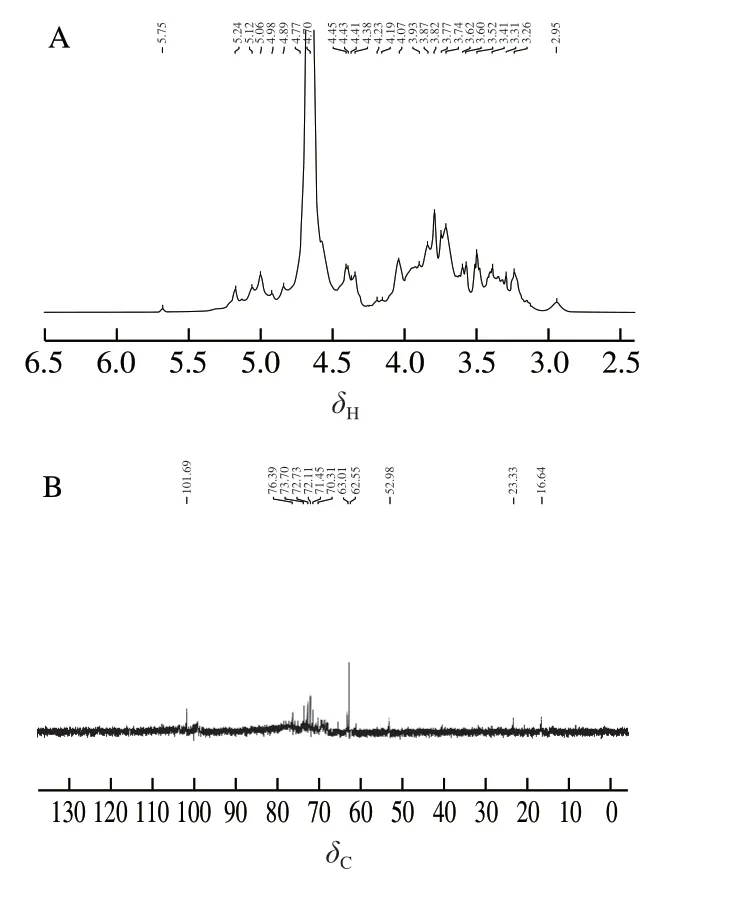
图7 COSP-4的1H-NMR谱图(A)和13C-NMR谱图(B)Fig. 7 1H-NMR spectrum (A) and 13C-NMR spectrum (B) of COSP-4
2.10 COSP-4的抗氧化活性
如图8A所示,当COSP-4质量浓度从0增加到3.0 mg/mL时,COSP-4对DDPH自由基的清除能力逐渐增强,当COSP-4质量浓度从3.0 mg/mL提高到5.0 mg/mL时,DDPH自由基的清除能力增长较为缓慢。质量浓度为5.0 mg/mL时,COSP-4的DPPH自由基的清除率达到68.61%,5.0 mg/mL VC的DPPH自由基清除率高达99.60%。COSP-4和VC的半抑制质量浓度(half maximal inhibitory concentration,IC50)分别为(1.72±0.14)mg/mL和(0.49±0.04)mg/mL。
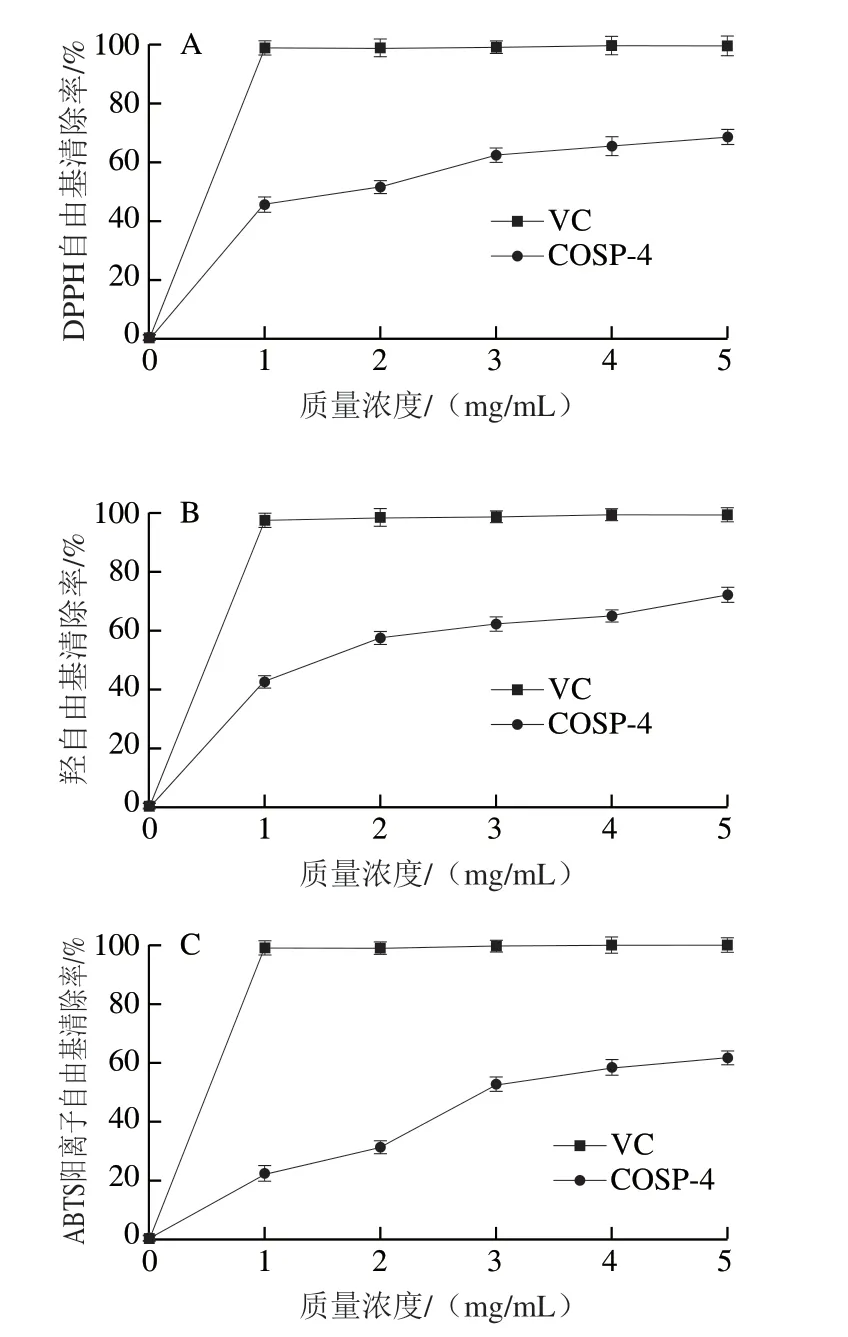
图8 COSP-4的抗氧化活性Fig. 8 Antioxidant activity of COSP-4
如图8B所示,COSP-4对羟自由基具有一定的清除能力。随着质量浓度的增加,COSP-4清除羟自由基的能力也逐渐增强。当质量浓度达到1 mg/mL后,羟自由基清除率增长趋势相对平缓。COSP-4和VC的IC50分别为(1.48±0.17)mg/mL和(0.50±0.02)mg/mL。5.0 mg/mL VC的羟自由基清除能率可达99.8%,相同质量浓度的COSP-4羟自由基清除率为72.24%。在之前的研究报道中,在质量浓度为21.1 mg/mL的槐根多糖中羟自由基清除率74.02%[40],在0.3 mg/mL苦瓜多糖中,羟自由基清除率为63.92%[41]。本实验结果表明山茱萸籽多糖COSP-4具有相对较好的清除羟自由基活性。
如图8C所示,在质量浓度0~5.0 mg/mL范围内,COSP-4对ABTS阳离子自由基的清除能力逐渐增强。COSP-4和VC的IC50分别为(2.87±0.27)mg/mL和(0.50±0.06)mg/mL。在质量浓度为5.0 mg/mL时,COSP-4、VC的ABTS阳离子自由基清除率分别为61.68%、99.80%。
3 结 论
本研究成功地从山茱萸籽中分离纯化了一种主要的多糖组分COSP-4,并对其结构、抗氧化活性进行了研究分析。结果表明,山茱萸籽多糖组分COSP-4是分子质量约为2.03×104Da的酸性多糖,由Rha、GlcA、GalA、Glc、Gal和Xyl组成,物质的量比为0.96∶0.18∶5.48∶0.28∶1∶10.70。包含14 种甲基化糖,含量最高的单糖结构为1,4,5-三乙酰基-2,3-二甲基木糖,具有良好的羟自由基、DPPH自由基和ABTS阳离子自由基清除能力,有望在天然抗氧化剂开发等方面得到应用,同时在医药和功能食品中具有广阔的应用前景。
