贵州三穗特色黄皮蛋加工过程中凝胶形成及颜色变化分析
2021-10-31王修俊刘林新杨丽平陈颜红聂黔丽杨万云姚碧琼
于 沛,王修俊,,徐 雯,刘林新,杨丽平,陈颜红,聂黔丽,杨万云,姚碧琼
(1.贵州大学酿酒与食品工程学院,贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025;2.三穗县农业农村局,贵州 三穗 556500)
皮蛋是在强碱溶液中腌制而成的风味蛋制品,民间俗称松花蛋、变蛋。传统皮蛋腌制工艺中常采用氧化铅作为腌制剂,其易引发重金属含量超标、碱味过重等食品安全问题[1-2]。与此同时,传统皮蛋多为暗黑色或墨绿色,在视觉上易使消费者产生排斥感。目前主要通过改善传统工艺提高皮蛋品质及安全性。前期本课题组通过预实验探究了以硫酸铜与硫酸锌复配液代替氧化铅作为腌制液的可行性,在15 ℃条件下,利用铜-锌复配质量比1∶2、铜-锌复配液质量分数0.4%的无铅腌制配方,腌制18 d可得到色泽金黄、品质优良的皮蛋。皮蛋蛋清的凝胶质构及色泽是判断其品质的重要指标,为更好地改进皮蛋腌制技术,提高产品品质,有必要研究皮蛋加工过程中的独特的凝胶质构及颜色变化机理。Ji Ling等[3]对皮蛋化清期的化学力及蛋白结构变化进行分析发现,皮蛋化清期蛋清蛋白质结构变化明显,说明皮蛋腌制凝胶前期蛋内发生了极为复杂的物理、化学变化。涂勇刚等[4]对皮蛋加工过程中的蛋白与蛋黄进行流变性及质构特性测定,结果表明加工过程中蛋黄凝胶的硬度呈先增大后基本保持不变的趋势。在色泽形成机理方面,赵燕等[5]分析认为皮蛋蛋白颜色的变化主要由羰氨反应造成。目前有关研究主要针对传统方法腌制的皮蛋,而对于无铅腌制工艺条件下的黄皮蛋蛋清凝胶形成及颜色变化机制方面的研究少有涉及。
为使无铅腌制工艺更好地应用于生产健康、品质优良的黄皮蛋,促进皮蛋产业发展,本研究以三穗麻鸭蛋为原料,以预实验得到的黄皮蛋最佳无铅腌制工艺为基础,对黄皮蛋腌制和后熟过程中的质构特性、微观结构和分子间作用力等凝胶特性及颜色变化进行分析,探究黄皮蛋无铅加工过程中蛋清凝胶及颜色形成机理及关键控制点,以期为黄皮蛋无铅腌制技术实际应用提供更全面的理论指导。
1 材料与方法
1.1 材料与试剂
三穗鲜麻鸭蛋 三穗县翼羽鸭业公司;红茶沫贵州大学吉林村农贸市场。
氢氧化钠、硫酸铜、硫酸锌、磺基水杨酸、酒石酸钾钠、乙酸锌、亚铁氰化钾、盐酸、尿素 天津市瑞金特化学品有限公司;氯化钠(食品级) 贵州省贵阳市花溪区合力超市;Tris-HCl 北京Solarbio科技有限公司;溴化钾(光谱级)、乙醇、冰乙酸、戊二醛、磷酸二氢钠、磷酸氢二钠(均为分析纯) 中国医药(集团)上海化学试剂公司;β-巯基乙醇、考马斯亮蓝G-250、考马斯亮蓝R-250 美国Sigma公司。
1.2 仪器与设备
PHS-3C pH计 上海鸿盖仪器有限公司;XHF-D高速匀浆机 宁波新芝生物科技股份有限公司;TMS Pro质构仪 北京盈盛恒泰科技责任有限公司;16K高速离心机 德国西格玛公司;LGJ-10真空冷冻干燥机 北京松源华兴科技发展有限公司;S-3400N扫描电子显微镜、L-8800氨基酸分析仪 日本日立公司;Varioskan Falsh多功能酶标仪 美国Thermo Scientific公司;HP-2136色差仪上海临嘉科教仪器有限公司;Nexus470型傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪美国Thermo Nicolet公司。
1.3 方法
1.3.1 皮蛋样品制备
鲜鸭蛋(质量约70 g)→洗净晾干→配制腌制液→15 ℃恒温腌制→取样
黄皮蛋腌制体系为m(腌制液)∶m(鲜蛋)=1∶1。按所配制腌制液总质量计,分别称取NaOH 4.0%、硫酸铜0.13%、硫酸锌0.27%、红茶3%、食盐4%。
腌制与取样:皮蛋置于腌制液中15 ℃恒温腌制18 d,腌制结束后取出洗净蛋体表面腌制剂,继续置于常温条件下放置。期间每6 d取样一次进行相关指标测定,以对皮蛋加工过程进行分析研究,实验共进行30 d。
1.3.2 皮蛋蛋清游离碱度的测定
参考GB/T 5009.47—2003《蛋与蛋制品卫生标准的分析方法》[6]的方法测定黄皮蛋蛋清游离碱度(以NaOH计)。
1.3.3 皮蛋蛋清凝胶微观结构观察
参考Handa等[7]的方法进行,将加工过程中皮蛋蛋清凝胶部分切成0.5 cm×0.5 cm薄片,用体积分数2.5%戊二醛溶液固定12 h,再用体积分数60%、80%、90%、100%乙醇梯度脱水,每次10 min,脱水完成后采用冷冻干燥法将样品完全干燥,最后利用扫描电子显微镜观察蛋清凝胶微观结构。
1.3.4 皮蛋蛋清凝胶分子间作用力的测定
根据Zhao Yan等[8]的方法并作适当修改,根据凝胶样品在不同组合变性剂中的溶解度来确定各种化学键的作用力。分别称取4 份0.3 g皮蛋蛋清粉碎样品并与10 mL A、B、C、D 4 种溶液混合(A溶液为0.6 mol/L NaCl,B溶液为0.6 mol/L NaCl+1.5 mol/L尿素、C溶液为0.6 mol/L NaCl+8 mol/L尿素、D溶液为0.6 mol/L NaCl+8 mol/L尿素+0.5 mol/Lβ-巯基乙醇)。摇匀后用分散器10 000 r/min均质1 min,然后在4 000 r/min下离心20 min。采用考马斯亮蓝法测定上清液中蛋白质的质量浓度。其中,以溶解于A溶液中蛋白质量浓度表示离子键作用力;以溶解于A、B溶液中蛋白质量浓度之差表示氢键作用力;以溶解于B、C溶液中蛋白质量浓度之差表示疏水作用;以溶解于C、D溶液中蛋白质量浓度之差表示二硫键作用力。
1.3.5 皮蛋蛋清凝胶傅里叶变换红外光谱分析
取加工0~30 d的皮蛋,分开蛋黄和蛋清,将蛋清冻干后粉碎成粉末状备用。取蛋清样品1 mg,加150 mg溴化钾混合后,研磨压制成薄圆片,进行FTIR扫描,每个样品扫描前均进行溴化钾背景扣除。波数范围为4 000~400 cm-1、扫描次数为16 次、分辨率为4 cm-1。每个样品重复测定3 次,选取效果较好的谱图进行后续处理。测试完成的图谱利用Omnic 8.0软件进行自动基线校正,进行傅里叶去卷积和二阶导数处理,然后利用Origin 8.0软件中高斯函数多次拟合二阶导数谱和傅里叶去卷积谱至残差值最小,选定各子峰的峰位,使重叠的不同谱带完全分开。确定各子峰强度和不同蛋白质二级结构的对应关系后,根据其峰面积计算各种二级结构的相对含量。
1.3.6 皮蛋蛋清凝胶质构特性测定
取皮蛋蛋清头部凝胶(1 cm×1 cm×1 cm),置于TMS Pro质构仪基台中心,采用TPA测定模式,测定参数:测试速率60 mm/min,触发点负载0.15 N,循环次数2,形变量70%。硬度、内聚性、弹性、胶黏性、咀嚼性由仪器配套软件分析得到。每组样品平行测定6 次。
1.3.7 皮蛋蛋清凝胶色差测定
将皮蛋切成1 cm×1 cm×1 cm的立方体,室温下用色差仪测定样品色度。其中L值为亮度,其值0~100表示从全黑至全白;a值(红绿度)由负到正表示绿色至红色;b值(黄蓝度)由负到正表示蓝色至黄色。白度W值按下式计算。
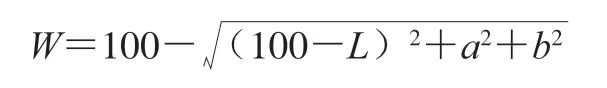
1.3.8 皮蛋蛋清凝胶还原糖含量的测定
参考GB 5009.7—2016《食品安全国家标准 食品中还原糖的测定》[9]的方法测定皮蛋蛋清凝胶还原糖含量。
1.3.9 皮蛋蛋清凝胶游离氨基酸含量的测定
采用氨基酸自动分析仪法测定皮蛋蛋清凝胶游离氨基酸含量,准确称取1.00 g皮蛋蛋清粉碎样品,用50 mL 0.01 mol/L盐酸溶液浸提30 min;摇匀后过滤,准确吸取滤清液2 mL于离心试管中,加入质量分数8%磺基水杨酸溶液2 mL,混匀,静置15 min;3 000 r/min离心20 min;取上清液,过0.22 μm有机膜后上机。检测条件:脯氨酸含量在440 nm波长处测定,其余氨基酸含量在570 nm波长处测定。
1.4 数据处理与分析
采用Excel 2019软件处理数据,结果以平均值±标准差表示;采用SPSS 24.0软件中方差分析法对数据进行差异显著性分析(以P<0.05表示差异显著);采用Origin 2019软件作图。
2 结果与分析
2.1 皮蛋加工过程中蛋清游离碱度的变化
如图1所示,腌制过程中(0~18 d),随着加工时间延长,蛋清游离碱度逐渐增加,增长速率呈先快后慢的趋势,从初始的47.59 mg/100 g增加至466.59 mg/100 g,腌制结束(18 d)后,蛋体离开腌制液强碱环境,蛋清游离碱度逐渐下降至24 d时的323.53 mg/100 g,在24~30 d,皮蛋蛋清游离碱度变化不明显。

图1 皮蛋加工过程中蛋清游离碱度变化Fig. 1 Change in free alkalinity of egg white during the processing of preserved eggs
游离碱度是影响皮蛋加工形成的重要因素[10],皮蛋腌制初期,腌制碱液破坏蛋壳及壳膜,逐渐向蛋内渗透,使蛋体内游离碱度不断增加。随着腌制时间延长,蛋清与腌制液的碱度逐渐平衡,蛋内碱度上升速率减缓。18 d后皮蛋腌制完成取出,由于蛋清与蛋黄的游离碱度存在浓度差,蛋清内游离碱继续向蛋黄内渗透,同时蛋清中部分蛋白质降解并结合蛋清中游离碱,使蛋清游离碱度逐渐下降。24 d后,蛋清与蛋黄的游离碱度差逐渐减小,蛋清游离碱度趋于稳定。
2.2 皮蛋加工过程中蛋清凝胶微观结构变化
扫描电子显微镜能利用二次电子信号成像来观察样品的表面形态,结果如图2所示。0~18 d皮蛋腌制过程中,蛋清蛋白逐渐从粗毛孔无序状态变为有序的三维网状纤维结构,且规则地分布有疏松网孔。从图2A、B可观察到,0~6 d时,皮蛋处于流动态液体,蛋白质无序排列;如图2C所示,12 d时,皮蛋蛋清凝胶化,形成三维网状结构,网孔紧密、结构牢固,与文献[11]观察到的结果相似;18 d时,蛋清凝胶部分被碱破坏,网孔变大(图2D);24~30 d时,皮蛋离开腌制碱液环境,蛋清凝胶自我修复,网孔变得紧密、结构变得牢固,弹性、硬度增大,形成较好的抗外力特性(图2E、F)。分析造成上述结果的原因可能是,皮蛋腌制液中强碱环境使皮蛋蛋白pH值远离蛋白质等电点,促使皮蛋蛋白逐渐形成线性纤维状的网络结构[12]。同时腌制液的强碱作用使蛋内分子间作用力发生变化,蛋白间通过共价键相互作用,可自由连接组合,聚集形成纤维状的蛋白聚集体或超分子结构[13]。为进一步探究皮蛋加工过程中蛋清凝胶变化过程,下面对皮蛋加工过程中分子间作用力及凝胶质构特性进行检测分析。

图2 皮蛋加工过程中蛋清微观结构变化Fig. 2 Microstructure changes of egg white during the processing of preserved eggs
2.3 皮蛋加工过程中蛋清凝胶分子间作用力变化
维持蛋清凝胶结构的分子间相互作用力能够在特定变性溶剂下被打开[14],故能够以不同变性剂中蛋白质的溶解度反映相应分子间作用力,从而分析皮蛋加工过程中分子间不同作用力的变化情况[15]。皮蛋加工过程中分子间作用力变化结果如表1所示。

表1 皮蛋加工过程中蛋清分子间作用力变化Table1 Changes in intermolecular forces in egg white during the processing of preserved eggs
如表1所示,蛋清凝胶分子间作用力有明显差异,且随着皮蛋的腌制时间延长而发生相应变化。腌制0~6 d过程中,离子键作用力、疏水作用、二硫键作用力显著增加,且在12~30 d凝胶形成后,蛋清中离子键作用力均大于23 mg/100 g,二硫键作用力均大于20 mg/100 g,氢键作用力均小于4 mg/100 g,疏水作用均小于15 mg/100 g;离子键与二硫键作用力占总作用力的70%以上,离子键作用力占总作用力的36%以上,二硫键作用力占总作用力的33%以上,疏水作用占总作用力的25%以下,氢键作用占总作用力的6%以下。结果表明,氢键在维持皮蛋凝胶结构中作用较小,离子键和二硫键对维持皮蛋凝胶结构作用较大,同时疏水作用也对皮蛋凝胶结构有一定影响。
结合表1和蛋清的微观结构变化结果可知,皮蛋凝胶含有大量的离子键和一定数量的二硫键。离子键种类一般包括两性离子静电吸引力、盐桥和水-离子键[16]。离子键主要受负电荷影响,过多的离子键不利于皮蛋凝胶的形成[17]。在高碱度环境中,蛋白质分子表面会有净负电荷,导致基团之间产生静电斥力,降低了蛋白质分子的可聚集性,但是腌制液中添加的铜离子在一定程度上减弱了表面负电荷对蛋白质分子的排斥力[18],有利于蛋白质分子的聚集。
皮蛋腌制初期,腌制碱液快速向蛋内渗透,蛋白质表面负电荷数量迅速增加,使离子键含量增加,第6天之后,腌制碱液渗透速率降低,且伴随着腌制液中氯化钠的逐渐渗入,蛋白质表面负电荷相互作用减小,离子键含量降低,与文献[19]的研究结果一致。离子键对维持皮蛋凝胶结构具有重要作用。二硫键是维持蛋白质空间结构的重要次级键,在一定条件下,二硫键与巯基能相互转换[20],在皮蛋加工过程中,腌制碱液的强碱作用使皮蛋蛋白变性,多肽链中的巯基逐渐转化为二硫键,促进了蛋白质凝胶的形成。氢键和疏水作用也对维持蛋白质结构具有一定的作用[21],皮蛋加工过程中,蛋内氢键、疏水作用、二硫键等作用力总体逐渐增强,与离子键共同作用于皮蛋蛋清凝胶,使蛋白结构更为紧密。
2.4 皮蛋加工过程中蛋清凝胶质构特性变化
结合黄皮蛋加工过程中的化学键作用力可知,在加工前6 d,离子键与二硫键作用力迅速增加,蛋清处于化清状态,黏度明显下降。分析原因为皮蛋腌制初期处于高浓度碱液中,蛋清游离碱度迅速升高,蛋白质空间结构被破坏,且高pH值条件下蛋白质分子表面会产生大量净负电荷,从而导致蛋白质聚集体间产生静电斥力,静电斥力抑制蛋白质相互作用[22],从而阻止凝胶的形成。在加工第6天时,皮蛋蛋清处于化清态,未形成皮蛋凝胶,故未对其进行质构测定。
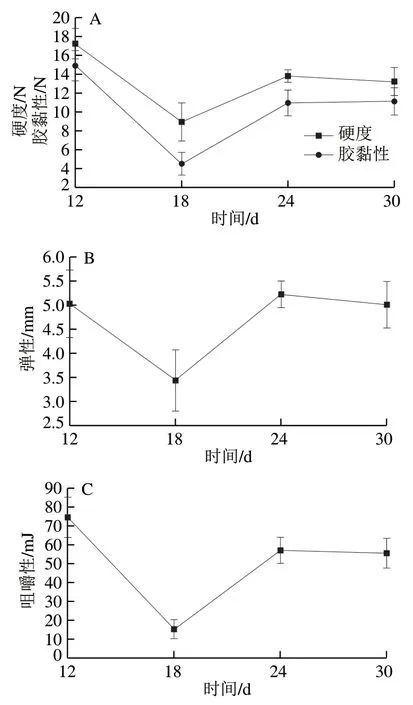
第12~30天皮蛋蛋清质构变化如图3所示,皮蛋加工过程中,蛋清凝胶质构特性指标水平不断变化,第12天时,皮蛋蛋清硬度、弹性、胶黏性、咀嚼性、内聚性等质构特性水平均较高,蛋清硬度为17.24 N、内聚性为0.86、弹性为5.03 mm、胶黏性为14.9 N、咀嚼性为74.58 mJ,蛋清呈现凝胶状态。分析原因可能是腌制液中氯化钠的渗入使蛋白质表面负电荷相互作用减小,有利于蛋白质分子的聚集,此时的二硫键作用力较高,二硫键可提高蛋白质抵抗外界因素的能力,蛋白质凝胶稳定性加强。12~18 d凝胶质构特性指标水平下降,分析原因为腌制液中的氯化钠浓度低于碱液浓度,蛋白质表面负电荷较多,使凝胶强度降低,此阶段离子键作用力持续下降,研究表明,二硫键是维持鸭蛋凝胶的主要作用力[23]。18 d后,黄皮蛋离开腌制液,凝胶质构特性指标水平均明显上升,此时蛋白质分子间静电吸引力起主导作用,蛋清碱度逐渐降低,使皮蛋凝胶在一定程度上自我修复,皮蛋网状结构愈发牢固,网孔结构愈发紧密,形成较好的抗外力特性,故表现较高的质构特性水平[24]。结合表1与图3可知,加工18~24 d,蛋白质分子间化学键作用力变化不明显,皮蛋凝胶各质构特性指标上升并逐渐趋于平衡状态,在24~30 d时,皮蛋蛋清质构特性无明显差异,此时蛋白质离子键与二硫键作用力约占总作用力的70%,以离子键与二硫键为主的凝胶结构为不可逆凝胶[25],促使黄皮蛋形成稳定的凝胶状态。

图3 皮蛋加工过程中蛋清凝胶质构特性变化Fig. 3 Changes in gel texture properties of egg while proteins during the processing of preserved eggs
综上,蛋清凝胶主要形成于6~12 d,质构特性变化主要集中于12~24 d,在加工24 d后,蛋清质构特性基本稳定,质构特性水平随时间延长无明显变化。即在实际生产中,皮蛋腌制完成后,可常温放置6 d,蛋清凝胶性质会略微提升,产品品质更佳。
2.5 皮蛋加工过程中蛋清蛋白质二级结构变化
如图4所示,蛋白质红外光谱酰胺I带的吸收峰主要是由蛋白质骨架中的羰基振动引起,能够直观、灵敏地反映蛋白质的构象及其变化,因此可以根据蛋白质二级结构含量的变化来确定蛋白质的变性情况[26]。蛋白质在酰胺I带(1 600~1 700 cm-1)的信号较强,主要是C=O肽链伸缩振动、N-H弯曲振动和C-N伸缩振动的耦合所引起[27],加工过程中的黄皮蛋均在1 640 cm-1左右有最大的吸光度,说明黄皮蛋凝胶结构中β-折叠结构的相对含量较高。对FTIR图傅里叶去卷积后进行高斯函数分峰拟合可得图5。
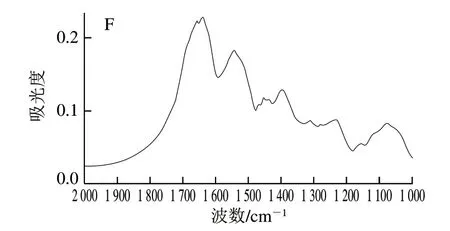
图4 黄皮蛋加工过程中蛋清的FTIR图Fig. 4 Changes in Fourier transform infrared spectra of egg white proteins during the processing of yellow preserved eggs

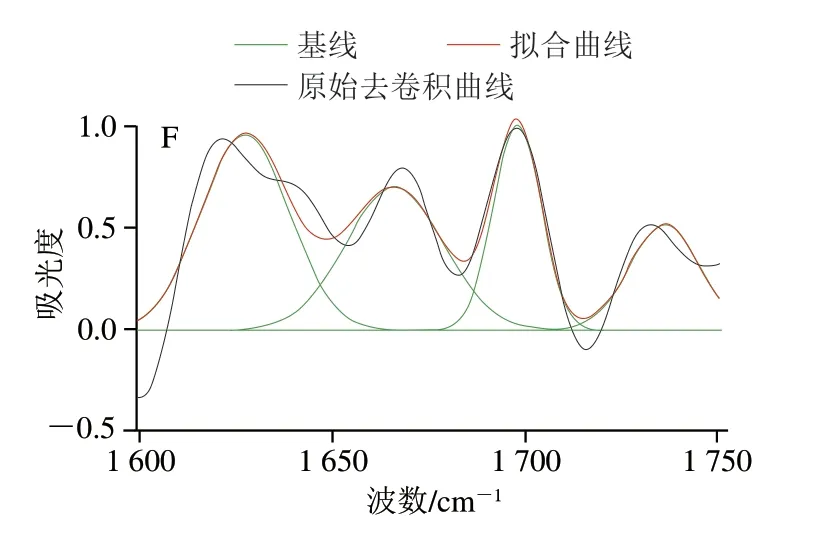
图5 黄皮蛋加工过程中蛋清的高斯曲线拟合图Fig. 5 Gauss curve fitting of Fourier transform infrared spectra of egg white proteins during the processing of yellow preserved eggs
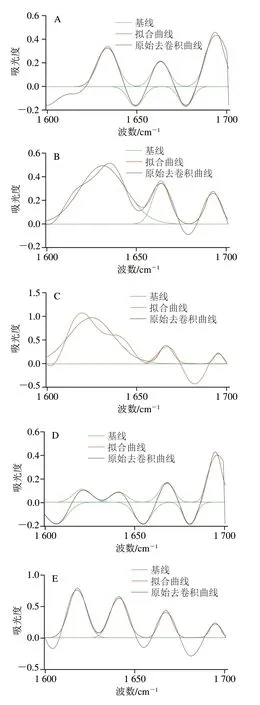
利用酰胺I带中各子峰的面积积分占比表示各个二级结构相对含量。酰胺I带的各子峰所对应的二级结构构象的波数范围:1 600~1 640 cm-1为β-折叠、1 640~1 650 cm-1为无规卷曲结构、1 650~1 658 cm-1为α-螺旋、1 660~1 700 cm-1为β-转角[28]。如表2所示,未开始腌制的新鲜鸭蛋蛋白二级结构中以α-螺旋和β-折叠为主,相对含量分别为34.59%、32.51%。腌制阶段的18 d内,α-螺旋相对含量逐渐降低,而β-折叠和β-转角相对含量明显增加,故可推断黄皮蛋在腌制过程中,蛋白质在强碱环境中发生变性,二级结构中的α-螺旋氢键断裂,向β-折叠、β-转角结构的转化。且α-螺旋和β-折叠含量在腌制的0~12 d过程中变化的速率较快,β-折叠和β-转角结构有助于蛋白质分子的聚集。腌制12~18 d,蛋白质二级结构变化相对不明显,但无规卷曲结构相对含量降低,这与凝胶结构在强碱腌制液中被破坏有关。黄皮蛋在18 d后离开腌制液,蛋白质二级结构逐渐趋于稳定,结合质构变化分析可知,24~30 d凝胶质构趋于稳定,30 d时β-折叠和β-转角相对含量分别为35.84%和29.12%,故黄皮蛋加工完成后维持凝胶的蛋白质二级结构主要为β-折叠和β-转角。
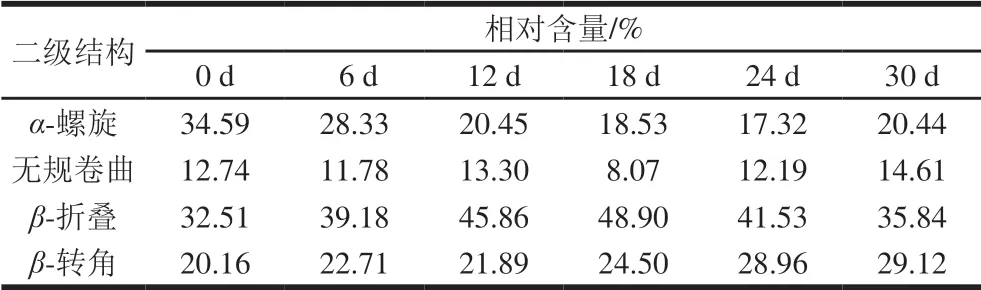
表2 黄皮蛋加工过程中蛋清蛋白质二级结构变化Table2 Changes in protein secondary structures of egg white during the processing of yellow preserved eggs
2.6 皮蛋加工过程中蛋清色泽变化
如图6所示,皮蛋加工过程中,皮蛋蛋清W值和L值呈下降趋势,a值和b值呈上升趋势,蛋清由白色逐渐变成金黄色。12~18 d时,蛋清色差变化幅度最大,随后色差变化幅度减小,24~30 d时,蛋清b、L、W值变化不明显。蛋清色泽变化是一个复杂的过程,目前较为认可的变色反应是羰氨反应。

图6 皮蛋加工过程中蛋清色差变化Fig. 6 Color changes of egg white during the processing of preserved eggs
2.7 皮蛋加工过程中蛋清内还原糖含量变化
由图7所示,皮蛋加工过程中,蛋清内还原糖含量总体呈下降趋势,下降趋势先急后缓,从最初的0.58 g/100 g逐渐降低到30 d时的0.19 g/100g,腌制12 d后还原糖含量趋于稳定。
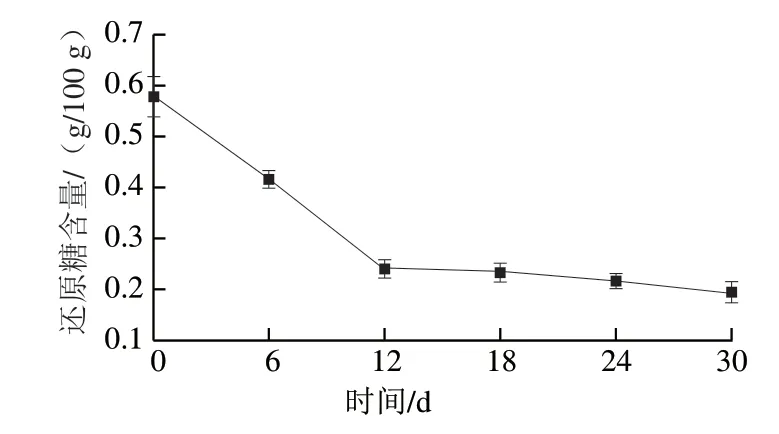
图7 皮蛋加工过程中蛋清还原糖含量变化Fig. 7 Changes in reducing sugar content of egg white during the processing of preserved eggs
羰氨反应本质上是羰氨间的缩合反应,能够生成大量类黑色色素前体物质,色素前体物质大量积累并发生褐变,最终生成类黑色色素[29]。鲜鸭蛋中丰富的还原糖为羰氨反应提供了羰基化合物。皮蛋加工过程中,羰氨反应不断进行,逐渐消耗蛋清中还原糖,羰基化合物浓度降低,羰氨反应速率逐渐降低,故还原糖含量下降趋势减缓。
结合皮蛋加工过程中蛋清颜色变化过程,0~12 d时,蛋清内还原糖含量快速降低,12~18 d时,蛋清W、L值逐渐下降,a和b值逐渐升高,蛋清颜色逐渐变黄变暗。上述结果证实羰氨反应与皮蛋色泽变化有关。在18~30 d时,皮蛋离开腌制碱液环境,蛋清颜色逐渐稳定,所以24~30 d时,蛋清b、L、W值均无明显差异。
2.8 皮蛋加工过程中蛋清内游离氨基酸含量的变化
游离氨基酸为羰氨反应提供氨基,促使皮蛋色泽发生改变。为探究游离氨基酸对皮蛋色泽形成的贡献,对皮蛋加工过程中蛋清内游离氨基酸含量进行检测分析,结果见表3。

表3 皮蛋加工过程中游离氨基酸含量变化Table3 Changes in the contents of free amino acids in egg white during the processing of preserved eggs
由表3可知,皮蛋加工过程中游离氨基酸种类逐渐增加,从最初的8 种增长到结束时的13 种;游离氨基酸总含量先减少后持续增加,从初始的31.67 mg/100 g降为6 d时的26.51 mg/100 g,随后一直上升至结束时的106.27 mg/100 g。随时间延长,皮蛋内不同游离氨基酸含量发生显著变化。
皮蛋加工过程中,蛋内游离氨基酸含量变化是一个较为复杂的过程,一方面蛋白质、多肽等在腌制碱液作用下分解为游离氨基酸[30];另一方面,游离氨基酸在碱作用下发生氧化、脱氨和羰氨反应,消耗蛋内游离氨基酸[31]。所以皮蛋加工过程中蛋内游离氨基酸变化是一个动态的过程。腌制初期,蛋内游离氨基和羰基化合物发生羰氨反应,故0~6 d时,羰氨反应快速进行,总游离氨基酸含量显著降低。随着反应进行,反应物浓度降低,羰氨反应速率减慢,同时腌制碱液持续作用使蛋白质分解为游离氨基酸,故第6天后,总游离氨基酸含量开始持续上升。
3 结 论
本研究结果表明,黄皮蛋蛋清凝胶结构及色泽形成主要在腌制阶段的6~12 d,此阶段是控制皮蛋品质的关键阶段。在第12天时,皮蛋蛋清硬度、弹性、胶黏性、咀嚼性、内聚性等质构特性均达到较大值,腌制12~18 d,离子键作用力及质构特性水平呈下降趋势,蛋清凝胶结构被破坏,α-螺旋结构与β-折叠、β-转角相对含量变化不大,无规卷曲结构相对含量下降至8.07%。18 d后为黄皮蛋的后熟阶段,蛋清凝胶结构、质构特性趋于稳定,加工24 d后,蛋清凝胶质构特性基本稳定,质构特性指标水平随时间延长无明显变化。维持蛋清蛋白质凝胶的分子间作用力从强到弱依次是是离子键、二硫键、疏水作用、氢键,蛋白质二级结构主要是β-折叠和β-转角。
蛋清颜色变化主要由羰氨反应调控,其与蛋清内还原糖及游离氨基酸含量变化有关。色泽形成阶段主要集中于腌制的0~12 d,此时蛋清内还原糖含量快速降低,游离氨基酸含量先降低后升高;随后,蛋清白度、亮度逐渐下降,红绿度和黄蓝度逐渐升高,蛋清颜色逐渐变黄变暗。综上,在实际生产中,皮蛋腌制完成后,可常温放置6 d,蛋清凝胶性质会略微提升,色泽稳定,产品品质更佳。
