光学相干断层扫描观察特发性黄斑裂孔患者手术前后黄斑区视网膜及脉络膜血流变化
2021-10-30王文娟王舒怡张纤朱宇东李青臧晶徐哲鲍炯琳
王文娟,王舒怡,张纤,朱宇东,李青,臧晶,徐哲,鲍炯琳
广东药科大学附属第一医院眼科(广东广州 510080)
特发性黄斑裂孔(idiopathic macular hole,IMH)是指致病原因不明的黄斑中心凹视网膜神经上皮全层缺失,临床上单眼发病为主,以50岁以上女性多见[1],发病隐匿,早期无症状易忽视,晚期视功能损害严重。IMH的发病机制:目前主流观点认为是玻璃体牵拉及视网膜内界膜收缩引起[2],可能有其他因素参与IMH的形成,如视网膜色素上皮、性激素、脉络膜等。近年来研究聚焦于脉络膜血液循环和视网膜血循环。目前IMH手术前后脉络膜和视网膜外层血循环量化比较的相关性研究较少。我们通过光学相干断层扫描血管成像(optical coherence tomography angiography,OCTA)技术深入量化并分析手术前后脉络膜毛细血管层血流面积和脉络膜厚度及视网膜外层血流面积变化,现报告如下。
1 资料与方法
1.1 一般资料 回顾性分析我院眼科2017年3月至2019年12 月就诊的42例单眼IMH患者,分为IMH组,对侧健眼为对照组。IMH根据 Gass的分期标准,均为Ⅱ、Ⅲ、Ⅳ期。研究对象纳入标准:单眼发病的IMH;OCT 检查成像清晰,配合良好。排除标准:内眼手术,中心性浆液性视网膜病变等视网膜病变,眼外伤/肿瘤,高度近视/远视,眼轴>25 mm,弱视,青光眼,术后裂孔闭合不全者,OCT成像质量欠佳者,控制欠佳的糖尿病及高血压等全身相关疾病。研究纳入单眼IMH患者:左眼21眼,右眼21眼,女29例29眼,男13例13眼,年龄50~72岁,平均(61.74±5.44)岁。IMH组和对照组性别(2=0.05,P=0.82)、眼别(2=0.19,P=0.66)、年龄(t=1.51,P=0.14)比较,差异无统计学意义(P>0.05)。
1.2 方法 所有受检对象均行眼科常规检查,包括眼前段和后段、眼轴测量及OCT检查,患眼行玻璃体切除和内界膜剥离术,术后4个月复查OCT。采用Optovue RTVue XR OCTA检查:选择6 mm*6 mm模式扫描黄斑区,自动获得黄斑中心1 mm半径范围内脉络膜毛细血管层血流面积(choriocapillary blood flow area,CBFA)及视网膜外层血流面积(outer retinal blood flow area,ORBFA),系统默认脉络膜毛细血管层为Bruch′s膜下9~31 μm,视网膜外层为外丛状层上9 μm至Bruch′s膜下9 μm。应用OCT EDI量化测量黄斑中心凹下脉络膜厚度(subfoveal choroidal thickness,SFCT)。由同一检查者熟练测量3次获得平均值。
2 结果
2.1 术前两组ORBFA、CBFA、SFCT比较 OCTA检查显示,IMH组黄斑中心区视网膜外层及脉络膜毛细血管层血管均稀疏,血流面积减少;对侧健眼组黄斑中心区视网膜及脉络膜毛细血管层血管及血流均匀(图1)。IMH组ORBFA为(0.30±0.18)mm2,CBFA为(1.54±0.22)mm2,SFCT为(221.00±67.99)μm;对侧健眼组为ORBFA为(0.90±0.45)mm2,CBFA为(1.96±0.21)mm2,SFCT为(250.44±57.53)μm。ORBFA和CBFA组间比较差异有统计学意义(t=4.154,P=0.001;t=6.245,P<0.001),IMH组较对侧健眼组明显减少;SFCT两组比较差异无统计学意义(t=1.246,P=0.235)。见表1。
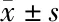
表1 两组术前ORBFA、CBFA、SFCT比较
2.2 ORBFA、CBFA及SFCT手术前后对比 黄斑裂孔行玻璃体切除和内界膜玻璃术后,黄斑区ORBFA、CBFA及SFCT均增加,且差异有统计学意义(P<0.05)。见表2。
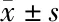
表2 IMH组手术后ORBFA、CBFA和SFCT对比
3 讨论
随着眼科诊疗设备的不断发展,OCTA技术是一种无创的血管成像技术,方便、直观,可以量化视网膜及脉络膜层血流密度,广泛应用于临床跟踪和复查。临床上OCT目前作为IMH的主要诊疗工具,主要应用于观察黄斑裂孔手术前后变化。有研究发现脉络膜血流与MH的发病有一定的关联性[3]。本研究通过OCT可直接测量ORBFA、CBFA、SFCT,对比分析IMH患者其手术前后变化,为了解IMH的发病机制提供了理论依据。
本研究应用Optovue OCTA 及OCT-EDI技术直接获取SFCT、ORBFA及CBFA数据,两者结合分析脉络膜血循环与IMH的关系。研究对象SFCT统计分析发现,患眼、对侧健眼、对照者逐渐增厚,且有统计学差异。本研究与国内中山大学中山眼科中心曾婧等[4]研究报道患眼及对侧健眼SFCT相近,患眼组214.82 μm,健眼组为243.53 μm,较正常人眼均变薄,且对比健眼与正常人眼间差异无统计学意义,认为脉络膜变薄是IMH的致病原因。研究认为IMH者的SFCT变薄早于裂孔形成,也可能是裂孔形成直接因素[5-6]。Zeng等[7]研究发现黄斑裂孔直径与SFCT有轻度负相关性,认为SFCT参与了黄斑裂孔的形成并影响其大小。脉络膜主要为血管组织构成,一旦SFCT变薄,脉络膜血流也降低。我们研究IMH的患眼脉络膜毛细血管面积分析发现,与对侧健眼相比较,患眼的ORBFA和CBFA明显减少,且差异有统计学意义(P<0.05)。以往研究发现脉络膜大中血管灌注压与SFCT呈正相关性[8],结果均表明脉络膜循环在IMH的发病过程中起一定作用。同样Bardak等[9]研究也认为脉络膜血流降低可能是IMH形成的诱因。本研究结果与Teng 等[10]研究结果一致。所以,临床上对SFCT明显变薄者,可能会发生IMH,应密切随访;对于单眼IMH对侧健眼也应密切随访,尽早发现,必要时给予及时治疗,减少严重视力下降的发生。Ahn等[11]研究观察56例IMH患眼在玻璃体切除术后,黄斑中心解剖结构基本恢复,SFCT增加。国内有另一研究[3]纳入56例56眼观察IMH患者手术前后SFCT变化,发现术后1个月是有一过性增加,术后3、6个月时下降并接近术前水平,认为术后早期在炎症因子作用导致SFCT增加,随着黄斑结构逐渐愈合SFCT呈逐渐下降趋势,从而证明先有脉络膜血流降低、厚度变薄在先,随后发生IMH。Teng 等[10]对25例单眼IMH患者研究也发现,CBFA和血管密度在术后1个月有改善。韩晓蕾等[6]30例IMH单眼患者,研究发现术前患眼组、对侧眼组CBFA分别为(2.84±0.35)、(3.19±0.23)mm2,血流密度分别为(20.74±8.26)、(35.18±5.20)%,患眼较对侧眼差异有统计学意义(P<0.05),术后3个月黄斑区CBFA、血流密度较手术前明显提高,差异有统计学意义(P<0.05),且与裂孔直径呈负相关性,推测IMH黄斑区脉络膜血循环随着黄斑结构改变呈可逆性变化,脉络膜血循环量下降,导致黄斑中心代谢功能下降,缺血、缺氧,严重的引起中心凹结构破坏,裂孔形成。
综上所述,OCT EDI和OCTA可以对ORBFA、CBFA和SFCT进行精确的定量分析,为IMH的研究拓宽了思路。IMH患者的患眼和对侧健眼存在不同程度的SFCT变薄,CBFA和ORBFA减少,手术后可部分恢复,推测供应血管脉络膜血循环可能异常,提示脉络膜血循环降低可能是IMH的形成原因,具体作用机制,有待进一步研究。本研究有不足,纳入的研究样本数量较少,观察脉络膜范围有限,术后研究节点少。
