血清miR-124、miR-155联合miR-23检测在超早期脑梗死诊断中的应用价值*
2021-10-30张立娜王海虹王适达
张立娜,王海虹,王适达
河北省保定市第二中心医院:1.老年病科;2神经内2科;3.功能科,河北保定 072750
脑血栓形成是最常见的梗死类型,以动脉粥样硬化所致的脑局灶性梗死及相应神经系统病变,属于临床急症,多发于50岁以上老年人群,且女性发病率高于男性[1]。相关调查显示,饮食不当、糖尿病、高血压、血脂疾病是导致脑梗死发生的主要危险因素,其具有较高的致死、致残风险;临床上将发病6 h以内的脑梗死情况称为超早期脑梗死[2-3]。临床资料显示,在发病后6 h内快速诊断及治疗,对患者预后及生存率提高具有重要作用。因此,早期诊断对患者治疗及预后具有重要意义[4]。相关研究指出,在脑血栓形成过程中,存在分子成分与血流流变学变化。微小RNA(miRNA)能够对基因表达起到调节作用,参与细胞生长、分化等过程,并在不同病理、生理过程中呈现不同的表达,对某些疾病的诊断及预测具有重要意义。同时,相关研究证实,miRNA能够调控血管内皮细胞功能,参与平滑肌细胞转化过程,与血管疾病的发生、发展具有密切联系[5-6]。为探讨miR-124、miR-155、miR-23在超早期脑梗死患者中表达的临床意义,本研究对血清miR-124、miR-155、miR-23水平进行了检测,分析了其对超早期脑梗死诊断和预后的意义。
1 资料与方法
1.1一般资料 选取2019年2 月至2020年2月在本院接受超早期脑梗死治疗的患者91例作为脑梗死组,同时选取同期在本院体检的91例体检健康者作为体检健康组。脑梗死组中男54例,女37例,年龄47~60岁,平均(53.5±5.5)岁,平均体质量指数(BMI)(25.16±1.27)kg/m2;其中小面积梗死40例、中面积梗死33例、大面积梗死18例(按照PullICino公式计算脑梗死面积,脑梗死面积=π/6×长×宽×CT扫描阳性层数层面;梗死面积<5 cm2为小梗死;梗死面积≥5 cm2且≤10 cm2为中梗死;大梗死面积为>10 cm2),根据动脉粥样硬化(CAS)斑块性质,分为易损斑块患者53例,稳定斑块患者38例。并根据Rankin量表(MRS)评分评估患者神经损伤程度并分为预后良好组(n=64)及预后不良组(n=27),MRS评分≤2分表示预后良好,MRS评分3~4分表示预后不良。体检健康组中男51例,女40例,年龄50~61岁,平均(55.5±4.6)岁,BMI(25.31±2.01)kg/m2。所有研究对象一般资料比较,差异均无统计学意义(P>0.05),具有可比性。对本研究的内容患者及家属均知情并同意,本研究获得本院伦理委员会批准。纳入标准:(1)所有患者均符合中华医学会脑梗死诊断标准[7];(2)均经过脑部CT、磁共振成像检查证实;(3)患者脑梗死发病时间为6 h以内,且脑梗死为初次发病。排除标准:(1)病历资料不全者;(2)恶性肿瘤患者;(3)合并心、肝、肾等严重系统性疾病;(4)短暂性脑缺血发作或合并脑出血等疾病;(5)患有血液疾病患者。(6)有脑梗死既往史者。
1.2观察指标 抽取所有研究对象住院次日或体检当日空腹静脉血液6 mL,以3 000 r/min离心10 min,静置分离上层血清,于-75 ℃环境下保存待检。实时荧光定量PCR检测miR-124、miR-155、miR-23表达量。提取细胞总RNA,检测RNA纯度、含量,逆转录处理后获得cDNA,使用Primer5.0软件设计引物,采用2-ΔΔCt方法计算,内参为U6。设置反转录反应条件:25 ℃ 10 min,40 ℃ 60 min,85 ℃ 5 min;设置扩增条件:94 ℃ 20 s、72 ℃ 30 s、60 ℃ 30 s,35个循环,采用2-ΔΔCt方法计算miR-124、miR-155、miR-23的相对表达水平。miR-124引物序列为上游引物:5′-GCT AAG GCA CGC GGT G-3′,下游引物:5′-GTG CAG GTC CGA GGT-3′。miR-155引物序列为上游引物:5′-CGT TAA TGC TAA TCG TGA TAG-3′,下游引物:5′-GCA GGG TCC GAG GT-3′。miR-23引物序列为上游引物:5′-TCA CAC TAT ATC ACA TTG CCA GG-3′,下游引物:5′-TAT GGT TGT TCT GCT CTC TGT CTC-3′。U6引物序列为上游引物:5′-CTC GCT TCG GCA GCA CA-3′,下游引物:5′-AAC GCT TCA CGA ATT TGC GT-3′。
1.3诊断效能分析 对各项检查的灵敏度、特异度和准确度进行统计。灵敏度=真阳性例数/(真阳性例数+假阴性例数)×100%。特异度=真阴性例数/(真阴性例数+假阳性例数)×100%。准确度=(真阳性例数+假阳性例数)/总例数×100%。
1.4统计学处理 采用SPSS21.0统计学软件进行分析。多组间计量资料的比较采用方差分析,组间两两比较采用SNK-q检验;组间比较采用独立样本t检验;以P<0.05为差异有统计学意义。
2 结 果
2.1miR-124、miR-155、miR-23在体检健康组、脑梗死组中的表达水平比较 与体检健康组相比,脑梗死组血清中miR-124表达水平较低,miR-155、miR-23表达水平较高,差异具有统计学意义(P<0.05)。见表1。

表1 miR-124、miR-155、miR-23在体检健康组、脑梗死组中的相对表达水平比较
2.2不同梗死面积、神经缺损程度、CAS斑块性质患者miR-124、miR-155、miR-23表达的水平比较 随梗死面积的增加,miR-124表达水平降低,miR-155、miR-23表达水平升高,差异有统计学意义(P<0.05);随神经缺损程度增加,miR-124水平降低,miR-155、miR-23水平升高,差异具有统计学意义(P<0.05);与易损斑块患者相比,稳定斑块患者miR-124水平较高,miR-155、miR-23水平较低,差异有统计学意义(P<0.05)。见表2。

表2 不同梗死面积、神经缺损程度、CAS斑块性质患者血清miR-124、miR-155、miR-23相对表达水平比较
2.3不同预后状态患者血清miR-124、miR-155、miR-23表达水平比较 与预后良好组相比,预后不良组miR-124表达水平较低、miR-155、miR-23表达水平较高,差异具有统计学意义(P<0.05)。见表3。

表3 不同预后状态患者血清miR-124、miR-155、miR-23相对表达水平比较
2.44种检测手段灵敏度、特异度及准确度比较 miR-124检测的灵敏度、特异度和准确度分别为71.43%、70.33%、70.87%,miR-155检测的灵敏度、特异度和准确度分别为69.23%、70.33%、69.78%,miR-23检测的灵敏度、特异度和准确度分别为74.72%、79.12%、76.92%,三者联合检测的灵敏度、特异度和准确度分别为95.60%、94.51%、95.05%。与miR-124检测相比,miR-155检测的灵敏度、特异度和准确度略低,miR-23的灵敏度、特异度和准确度略高,但差异无统计学意义(P>0.05);与miR-124、miR-155、miR-23单独检测相比,三者联合检测的灵敏度、特异度和准确度较高,差异具有统计学意义(P<0.05)。见表4。
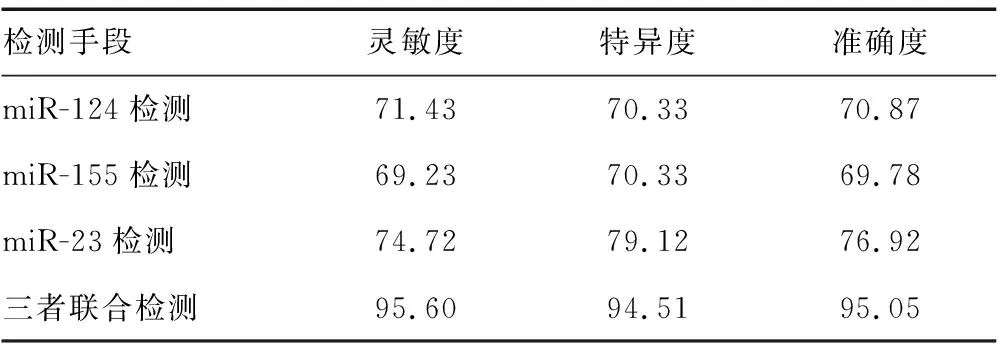
表4 4种检测手段灵敏度、特异度及准确度比较(%)
2.5单独检测与联合检测脑梗死多因素Logistic回归分析 单独检测与联合检测脑梗死多因素Logistic回归分析,结果显示血清miR-124异常表达与超早期脑梗死呈负相关关系,血清miR-155、miR-23呈正相关关系。见表5。
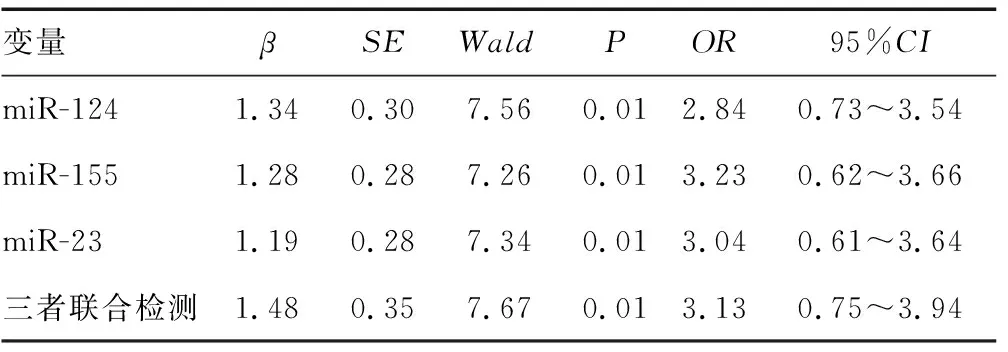
表5 单独检测与三者联合检测脑梗死多因素Logistic回归分析
3 讨 论
超早期脑梗死是指发病时间在6 h内的患者,快速确诊治疗,能有效降低并发症及后遗症的发生,是脑梗死治疗的关键,对生存率具有严重的影响[5]。相关研究显示,随着我国人口老龄化加重,脑梗死发病率呈逐年上升趋势,若未及时诊断及接受有效地治疗,导致炎性反应、氧化应激反应等缺血及联病理事件的发生,会严重威胁患者生命健康及生活质量。因此,及时得到有效诊断对患者的治疗及预后具有重要意义[7]。
目前,临床主要通过头颅CT、MRI等影像学手段对脑梗死患者进行诊断,但其诊断准确性欠佳[8]。随着近年来医学技术的发展,RNA诊断在临床众多疾病诊断中得到广泛应用。相关研究显示,miRNA具有组织特异性高、相对稳定性及体液丰度高等特点,能够通过抑制转录、降解miRNA,达到对靶基因转录水平调节作用,介导血管生成、凋亡及氧化应激的目的,可作为潜在性组织损伤生物标志物[9-10]。
作为脑部特异性的miRNA,miR-124在脑部神经发育及调控中枢神经功能中具有重要作用[11]。相关资料显示,miR-124在动物模型中作为缺血性脑损伤标志物。在建模8 h后,miR-124表达升高,脑损伤发生,24 h达到峰值,可在48 h后仍保持高表达水平,通过抑制细胞凋亡、降低炎性反应达到保护神经元及脑部组织目的[12]。说明miR-124可以作为脑梗死早期检测的生物标志物[13]。有研究通过观察缺血性脑卒中小鼠脑部梗死面积发现,miR-124基因与脑梗死体积之间存在密切联系[12]。本研究结果显示,miR-124表达水平的检测对超早期脑梗死患者预后及诊断具有重要意义。
动脉粥样硬化是脑梗死的重要病理基础。相关研究发现,miR-155在内皮细胞过表达与抑制内皮细胞增殖或迁移与再内皮化,导致血管通透性增加,诱发动脉粥样硬化。另外,还会通过扰乱巨噬细胞加剧早期动脉粥样硬化[14]。miR-155作为miRNA家族中的重要一员,不仅对动脉粥样硬化具有重要意义,同时在脑梗死发生后参与血运重建与神经元变性[15]。相关资料表明,miR-155属于多功能miRNA,参与细胞生长、代谢、炎症等多种生物过程,可多角度对脑梗死的发生发展进行调控。在健康人群中miR-155表达明显低于脑梗死患者,miR-155可能是新型脑梗死的生物标志物[16-17]。本研究结果显示,血清miR-155检测对超早期脑梗死诊断及预后判断有重要意义。
miR-23在基因层面参与机体各方面病理进程,成为新的研究热点,其对机体的调节体现在多方面、多组织。相关研究发现,少突胶质细胞发育、髓鞘形成与miR-23表达具有密切关系[18]。miR-23在心血管系统疾病中存在高表达,与心血管疾病的发生发展具有密切联系。本研究结果显示,对血清miR-23水平进行检测对超早期脑梗死预后判断有一定价值。
氧化应激、炎性反应、细胞凋亡导致缺血性脑卒中的病理损伤,造成神经细胞受损。miR-124、miR-155、miR-23通过参与调控过程,对疾病预后造成影响。三者联合检测灵敏度更高、特异度更强,诊断价值更高,3种因子表示不同时段的病理变化,对不同时段的脑梗死具有很好的诊断效能[19]。通过为期1年的随访发现,miR-124、miR-155、miR-23异常表达与患者生存率之间存在密切关联,联合检测结果为阳性患者,病死率明显高于阴性患者。局部微循环在脑梗死后持续恶化诱导神经细胞凋亡,是导致梗死面积变化及神经元损伤的重要病因,同时诱导炎症因子聚集,炎性反应发生,进一步造成脑损伤的加重。相关研究表示,miR-124、miR-155、miR-23可能共同参与整个疾病的生理过程,其表达对炎性反应及细胞凋亡可能造成影响,对患者预后产生重要影响[20]。本文研究结果显示,通过对血清miR-124、miR-155、miR-23进行联合检测,能够对患者预后情况做出有效评估。
综上所述,对血清miR-124、miR-155、miR-23进行联合检测,可有效评估患者的梗死面积、神经受损程度及CAS斑块进行定义,同时对超早期脑梗死诊断及预后提供重要参考价值。
