C3-差向异构体测定对评估未成年人体内维生素D贮存的重要性*
2021-10-30何益洋李园梦蒋文强俸家富
何益洋,李园梦,徐 鹏,冯 倩,蒋文强,俸家富△
1.四川省绵阳市中心医院检验科,四川绵阳 621000;2.四川省南充市中心医院检验科,四川南充 637000;3.成都中医药大学医学技术学院,四川成都 610075
维生素D(VitD)是一类脂溶性固醇类衍生物,25羟维生素D[25(OH)D]是主要储存形式,包括25(OH)D2和25(OH)D3(本文简称VitD2和VitD3)[1-2]。VitD2和VitD3分别来源于植物和动物。有研究认为应同时检测VitD2和VitD3以保证两种来源的VitD均能被检出[3]。C3-差向异构体(C3-epi)是VitD2和VitD3在酶作用下形成的同分异构体。因此,评价机体内VitD贮存,仅检测总25(OH)D水平,或仅分别检测VitD2和VitD3是不能准确评价的,尤其是对于未成年受试者,因其肝肾脏功能尚未成熟,导致VitD代谢途径向差向异构体分流[4]。本实验室引入超高效液相色谱-串联质谱法(UHPLC-MS/MS),尝试检测了部分受试者VitD2与VitD3水平,并分析了C3-epi对结果的影响,以期为临床评估未成年人(某些VitD相关性疾病)体内VitD贮存提供可靠的循证依据。
1 资料与方法
1.1一般资料 选择2019年6—8月来绵阳市中心医院就诊或健康体检的未成年人(<18岁)1 671例,年龄1个月至16岁,中位年龄12岁。分为健康组(n=1 204)和疾病组(n=467),疾病组为随机抽取的就诊患儿,包括矮小症134例、呼吸道感染215例、营养不良57例和抽动障碍61例。
1.2样本检测 受试者禁食过夜,于上午10点前,用一次性含分离胶/纤维蛋白酶促凝剂真空采血管(美国BD 公司)采集空腹静脉血约5 mL,轻轻颠倒混匀,静置0.5~1.0 h后,以3 000 r/min 离心10 min,分离血清,-80 ℃条件下保存备用。用JasperTMHPLC液相色谱仪与AB SCIEX Triple QuadTM4500MD型质谱仪串联,检测血清中VitD组分含量。实验所用标准及仪器参数设置:(1)校准品。25(OH)D2(同位素掺入≥98.0%,纯度≥95.0%)、25(OH)D3(≥99.0%,≥95.0%)和3-epi-25(OH)D3-[2H3](≥98.0%,≥98.0%)购自美国IsoSciences MPD化学公司;25(OH)D2-D6和25(OH)D3-D6购自美国Medical isotopes公司,二者丰度和化学纯度都分别为 > 98.0%(atom)D和>99.0%;3-epi-25-(OH)D3购自加拿大Toronto research chemical公司,纯度95.0%。(2)样本处理。向200 μL血清中加入10 μL内标溶液,充分混匀后加入1.0 mL叔丁基甲醚,以13 000 r/min高速离心5 min,吸取上清液800 μL于洁净的埃彭多夫管中,并吹干。然后向残余物中加入100 μL含0.1%甲酸的65.0%甲醇溶液,使之复溶,充分混匀后待测。(3)色谱条件。采用C18色谱柱(Phenomenex,美国)进行样本分离,柱温为40 ℃,流速为0.6 mL/min。流动相A为含0.1%甲酸的水溶液,流动相B为含0.1%甲酸的甲醇溶液,梯度洗脱。(4)质谱条件。采用APCI离子源进行质谱分析;驻留时间为40 ms;扫描模式采用正离子多反应监测模式(MRM);VitD2、D6-25(OH)D2、VitD3和D6-25(OH)D3的离子对(母离子/定量子离子)分别为395.3/269.2 m/z、419.3/229.3 m/z、383.3/365.3 m/z和389.3/363.3 m/z;监测VitD2、D6-25(OH)D2、VitD3和D6-25(OH)D3所使用的去簇电压分别为110 V、85 V、130 V和130 V,碰撞能量分别为24 eV、21 eV、16 eV和19 eV。(5)数据采集:色谱图输出用Analyst®MD软件(版本号:1.6.3),数据处理用MultiquantTMMD软件(版本号:3.0.2),二者均是AB SCIEX Triple QuadTM4500MD质谱仪(ABI,美国)配套操作系统。
1.3C3-epi分析 随机抽取87例样本,包括健康者24例,不同疾病患者63例。用同位素稀释超高效液相色谱串联质谱法进行3-epi-25(OH)D3,即C3-epi检测。
1.4VitD组分水平的计算 根据液质串联质谱测得的VitD2和VitD3结果,计算出25(OH)D=VitD2+VitD3;由于VitD3是VitD2活性的2~3倍,以最高活性3倍计算,将VitD2折算为VitD3,再加上VitD3的活性,合并为AVitD3。活性VitD3(AVitD3)=VitD2/VitD3+VitD3。
1.5VitD营养状态的评估 根据美国医学研究所(IOM)推荐[5],VitD营养状态判断标准为≤20 ng/mL为缺乏;20~<30 ng/mL为不足;≥30 ng/mL为充足。
1.6统计学处理 采用SPSS25.0统计学软件进行分析。因本研究的VitD组分水平不服从正态分布,所测结果以M(P25~P75)进行描述。比较健康组与疾病组指标的差异,选择Mann-WhitneyU检验;比较多组间指标的差异,选择Kruskal-WallisH检验,两两比较采用Bonferroni法(即调整α水准法)。以P<0.05为差异有统计学意义。
2 结 果
2.1受试者血清VitD组分水平 受试者VitD2、VitD3、25(OH)D和AVitD3水平见表1。因本组资料均不呈正态分布,用Mann-WhitneyU检验对健康组和疾病组两组差异进行分析,结果显示,疾病组的血清VitD2水平、血清VitD3水平、25(OH)D水平和AVitD3水平均明显低于健康组,差异有统计学意义(P<0.05)。
2.2受试者血清VitD2和VitD3水平 受试者中,VitD2水平从高至低依次为抽动障碍组、健康组、呼吸道感染组、矮小症组和营养不良组,中位值水平分别为1.96、1.91、1.61、1.44 ng/mL 和0.99 ng/mL,组间差异有统计学意义(P<0.05)。经Bonferroni法两两比较,营养不良组血清VitD2水平明显低于健康组和抽动障碍组,差异均有统计学意义(P<0.05)。受试者中,VitD3水平由高至低依次为健康组、呼吸道感染组、营养不良组、矮小症组、抽动障碍组,中值水平依次分别为:29.48、28.48、25.89、25.64、24.73 ng/mL,组间差异均有统计学意义(P<0.05)。经Bonferroni法两两比较,矮小症组和抽动障碍组血清VitD3水平均明显低于健康组和呼吸道感染组,差异均有统计学意义(P<0.05)。见表2。
2.3受试者血清25(OH)D和AVitD3水平 受试者中,25(OH)D水平由高至低依次为健康组、呼吸道感染组、抽动障碍组、矮小症组和营养不良组,见表2,中位值水平分别为34.29、33.21、30.04、28.14、27.51 ng/mL,组间差异有统计学意义(P<0.05)。经Bonferroni法两两比较,矮小症组、营养不良组和抽动障碍组血清25(OH)D水平均明显低于健康组,而且矮小症组血清25(OH)D水平还明显低于呼吸道感染组,差异有统计学意义(P<0.05)。
受试者中,AVitD3水平由高至低依次为健康组、呼吸道感染组、抽动障碍组、矮小症组和营养不良组,中值水平分别为30.91、30.19、26.56、26.47、26.07 ng/mL,组间差异有统计学意义(P<0.05)。经Bonferroni法两两比较,矮小症组和抽动障碍组血清AVitD3水平均明显低于健康组,而且矮小症组血清AVitD3水平还明显低于呼吸道感染组,差异有统计学意义(P<0.05)。见表2。
2.4C3-epi分析 本研究用同位素稀释质谱法评估了87个血清样本C3-epi水平,通过调整质谱条件和更换色谱柱,实现C3-epi和VitD3色谱峰的有效分离,见图1。结果显示,VitD3和C3-epi分别在3.39 min和3.47 min洗脱,洗脱时间非常接近;同时C3-epi的质谱峰与VitD3密切相关。然后,在引入C3-epi标准品和同位素内标之后,采用正离子条件下多反应监测模式(MRM),实现对C3-epi同位素内标法定量,见表3。因本组资料均不呈正态分布,用Mann-WhitneyU检验对健康组和疾病组两组差异进行分析,结果显示,随机抽样的血清样本中,疾病组的VitD2、VitD3和25(OH)D水平明显高于健康组,而疾病组的VitD2/VitD3与健康组比较差异无统计学意义(P>0.05),这些改变均与总体血清样本的改变一致;但是疾病组的血清C3-epi水平明显高于健康组,其与VitD3的比值(即C3-epi/VitD3)在疾病组和健康组间差异无统计学意义(P>0.05),而其与25(OH)D的比值[即C3-epi/25(OH)D]疾病组低于健康组,差异有统计学意义(P<0.05)。

注:C3-epi的质谱峰与VitD3密切相关,洗脱时间非常接近。VitD3和C3-epi分别在3.39 min和3.47 min洗脱。
2.5受试者体内VitD营养状态 用25(OH)D水平分析本组受试者机体VitD贮存状况,因为是夏季,再加上儿童可能有意识地补充了VitD,从图2可见,65.4%健康组和52.7%疾病组受试者VitD充足,疾病组中VitD充足者比例低于50%的是矮小症(41.8%)和营养不良患者(43.9%)。但是,由于VitD2活性仅是VitD3活性的1/3~1/2,因此将VitD2活性折算为AVitD3水平用于分析后发现,仅健康组(53.2%)和呼吸道感染组(51.2%)有刚过一半的受试者VitD贮存充足,而矮小症(30.6%)和抽动障碍患者(31.2%)中VitD贮存充足者不足1/3,其VitD缺乏或不足超过者分别占69.4%和68.8%。
将本研究受试者VitD营养状况绘成图,按25(OH)D判断,见图2A;按AVitD3判断,见图2B。
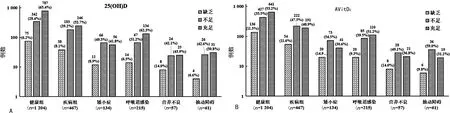
注:A为25(OH)D判断;B为AVitD3判断。
3 讨 论
VitD缺乏已成为全球的公共卫生健康问题,越来越多的研究者们对VitD水平的关注已不仅仅局限于营养学,而是对很多疾病的构成比,如心脏病、肾病、肺病、癌症、糖尿病、高血压、精神分裂症和自身免疫性疾病等的发生发展、疗效监测和预后评估的意义都在进行广泛的探索[2,6-11]。但是,鉴于早些年医学实验室VitD检测技术的局限,这些研究多集中在某种疾病与25(OH)D水平关系的层面,而对VitD组分的组成、测定及其与疾病发生发展的相关性,研究报道较少。
本研究用UHPLC-MS/MS技术分析了未成年人中健康受试者和某些种类疾病患者血清VitD组分。疾病组血清VitD2、VitD3和25(OH)D水平均较健康组降低。说明未成年人在疾病发生后可能导致体内VitD水平下降,当然也可能是机体VitD水平较低导致疾病发生。虽然还没能证明VitD是一种抗氧化剂,但VitD能调节多条合成抗氧化物质的细胞通路,对抗活性氧自由基和一氧化氮的氧化作用,防止组织细胞氧化损伤[12]。因此,如若机体内VitD长期维持在较低水平,个体对抗ROS的能力就将下降,组织细胞被氧化损伤的可能性增加,导致疾病发生和发展概率增加。另一方面,大多数疾病都与炎症相关,机体抗炎性反应必然消耗抗氧化剂,这可能就是发生疾病时体内VitD水平降低的原因之一。
由于人体血液中VitD2及其代谢产物与VitD结合蛋白相结合的能力比VitD3低,加之VitD2存在一个非生理代谢形式,且其半衰期较VitD3短,VitD2的生物效力明显低于VitD3,这些因素使得VitD3实际存储VitD的能力要比VitD2高2~3倍[1,13]。因此,生理状态下,机体内VitD3水平远高于VitD2水平,VitD2/VitD3比值极低。受试者因某些不明原因导致体内VitD2水平过高而VitD3却明显降低时,若仅检测血清25(OH)D水平,就可能导致VitD贮存充足的假象。对本组受试者的研究显示,经VitD2向AVitD3折算后,以AVitD3水平再进行体内VitD营养状况评估时,本组受试者中无论健康与否,其VitD中位数水平均有明显下降。这可能就是检测血清VitD浓度时,需检测其组分的真正理由所在,因为只有这样才能正确评价受试者体内VitD营养水平。然而,关于对机体内VitD贮存的评价,现在临床实验室几乎都是使用免疫标记技术(即化学发光法)来检测血清总25(OH)D水平,其结果不仅只是将VitD2与VitD3的生物活性等同,而且还忽视了样本中C3-epi的存在,显然这样的评价方式极为不当甚至是错误的认识,真正能正确评价受试者体内VitD贮存的指标是生物可利用VitD,即AVitD。本研究可见,当不考虑VitD2的生物效力时,许多受试者尚表现为有足够的VitD贮存,但若将各种VitD组分折算为AVitD后,2/3以上疾病患者体内VitD贮存不足或缺乏。
25(OH)D能被25-羟基维生素D3-3-差示酶作用,使VitD3第3个碳原子上的羟基空间位置由3β反转为3α,形成3-epimer-25(OH)D3[14],即C3-epi。C3-epi与VitD3有着相同分子质量和结构式,仅空间构象不同,但它没有生物活性[14]。因此,相同VitD3水平,如果C3-epi含量高,其实质就是降低了VitD的体内贮存。在儿童,尤其1岁以下婴儿,由于VitD代谢通路尚不成熟,C-3异构化可能是25(OH)D的主要代谢途径之一,所以1岁以下婴儿C3-epi浓度很高[15]。本组健康受试者的分析结果也能进一步证明该结论。因此,儿童尤其是1岁以下婴儿如果不检测C3-epi水平,高估其体内VitD贮存的可能性极大。随着年龄的增长,如果血清C3-epi浓度依然高,可能表明VitD代谢通路成熟较慢。本研究发现当处于疾病状态时,患者C3-epi中位数和区间估计均高于健康受试者,表明某些疾病可能影响了机体内VitD的正常代谢,从而影响了机体的真实VitD贮存水平,这类患者如果不检测C3-epi水平,必将高估体内VitD贮存。此外同VitD3一样,VitD2也存在差向异构化,但因为正常生理状况下甚至在多数疾病状况下,VitD2在人体内的含量远较VitD3低,因此,除研究外,临床上检测VitD2的差向异构体对评价VitD贮存的意义不大。这也是本文不分析VitD2差向异构体的原因。但是,本研究结果发现,C3-epi增加的患者,有VitD2增加的趋势。那么,C3-epi的生成与VitD2水平有无关系?是VitD2促进C3-epi的生成,还是C3-epi增加导致的VitD2适应性增加?VitD2增加是否也意味着其差向异构体增加?这需要作进一步研究。
目前,还没有任何医疗机构或研究单位提供VitD2、VitD3及其比值(VitD2/VitD3)的参考值范围,因为现有临床医生均仅依据25(OH)D水平来评价受试者机体内VitD贮存。分析原因:第一,现有临床实验室所使用的免疫学检测方法尚不能分别检测VitD2和VitD3水平;第二,大多数人认为机体内VitD2水平远低于VitD3水平,VitD2的改变对总的25(OH)D水平影响不大;第三,极少有人关注C3-epi对25(OH)D水平的影响。但是,由于VitD2和VitD3活性不同,以及C3-epi形式的存在,即便相同25(OH)D检测水平,也可能由于VitD2、VitD3和C3-epi的组成不同,从而表现出不同的VitD贮存水平。因此,想要准确评估受试者机体内VitD营养状况,就必须准确测定VitD2、VitD3和C3-epi在内的VitD组分。由此可见,正确选择VitD的检测方法和其必须的组分检测,对正确认识和评估受试者机体内贮存至关重要。
由于受试者体内VitD可能存在C3-epi形式,如果只是检测血清25(OH)D水平,或者只检测VitD2和VitD3水平均会过高估计受试者体内VitD贮存。因此,C3-epi水平检测对准确评价受试者体内VitD贮存极为重要,尤其是1岁以下婴儿和某些疾病患儿。
