干扰长链非编码RNA MNX1-AS1对卵巢癌细胞的干样特性、氧化应激以及线粒体功能损伤的影响*
2021-10-29张晓丹杜德奇王鲁文
张晓丹 徐 毅 杜德奇 郭 莹 王鲁文
(郑州市妇幼保健院,1 产科,2 妇科,郑州 450000;3 郑州大学第三附属医院妇科,郑州 450000)
非编码RNA(non-coding RNA,ncRNA) 大约占人类基因组的98%,其中,长链非编码RNA(long non-coding RNA,lncRNA)是一类长度超过200个核苷酸的非编码序列[1-2]。某些lncRNA在恶性肿瘤组织或细胞系中具有异常表达,可作为早期诊断的参考、临床治疗的靶点或预后的标志,比如NEAT1[3]、HAGLROS[4]、TP73-AS1[5]、VPS9D1-AS1[6]等。通过多种途径参与肿瘤的发生与发展,在细胞的增殖、转移、侵袭、迁移、凋亡等方面发挥作用。因此,lncRNA在肿瘤研究中具有价值和潜力。卵巢癌是死亡率最高的女性生殖系统恶性肿瘤,5年生存率不超过50%[7]。仅15%患者在早期或局部阶段被诊断,治疗后药物抵抗性及复发率较高[8],寻找新的生物标志物来协助卵巢癌早期诊断和靶向治疗迫在眉睫。lncRNA在卵巢癌发生和发展中起着促进或抑制作用,干扰lncRNAs的异常表达可有效逆转肿瘤的进展。Han等[9]的研究显示lncRNA SOX2OT在卵巢癌中促进肿瘤细胞增殖和活性,Edward等[10]研究显示干扰lncRNA HOXA11-AS具有抑制上皮性卵巢癌致癌表型的作用,但lncRNA MNX1-AS1对卵巢癌的影响尚未报道。因此,本实验探讨干扰lncRNA MNX1-AS1对卵巢癌细胞的干样特性、氧化应激以及线粒体功能损伤的影响,以期为卵巢癌的临床诊断、治疗提供有价值的参考。
1 材料和方法
1.1 材料及试剂仪器
人卵巢癌细胞SKOV3购自中国科学院上海细胞库;RPMI1640培养液、干细胞无血清培养基(MSC Basal Medium)、10%胎牛血清、0.25%胰蛋白酶(美国Thermo Fisher公司);LipofectamineTM3000转染试剂(武汉普诺赛生命科技有限公司);阴性对照质粒、沉默表达序列质粒(山东维真生物科技有限公司);SDS-PAGE蛋白凝胶、RIPA细胞裂解液,TRIzol试剂,PCR试剂盒(南京金斯瑞生物科技有限公司);总蛋白提取试剂盒、BCA蛋白定量测定试剂盒(上海信裕生物技术有限公司);羊抗鼠OCT4抗体、鼠抗人SOX2抗体、鼠抗人ABCG2抗体(美国Sigma-Aldrich公司);丙二醛(MDA)试剂盒、超氧化物歧化酶(SOD)试剂盒、活性氧(ROS)试剂盒(上海晶抗生物工程有限公司);JC-1线粒体膜电位试剂盒(北京索莱宝科技有限公司)。
Rt2100c酶标检测仪(BioTeK美国伯腾仪器公司);CytoFLEX流式细胞仪(美国贝克曼库尔特有限公司);DMi8倒置荧光显微镜(德国徕卡公司);BPN-80CRH(uv) CO2恒温培养箱(上海一恒仪器有限公司);BBS-SSC超净工作台(济南鑫贝西生物技术有限公司);JIDI-16R台式多用途高速冷冻离心机(广州吉迪仪器有限公司)。
1.2 细胞培养、转染及分组
将SKOV3细胞转移至含10%胎牛血清、1%青-链霉素的RPMI-1640培养液中,置37℃、5%CO2恒温培养箱内培养,细胞生长达90%以上,消化处理后,调整细胞浓度为1×106/mL,取对数生长期细胞进行实验。
将消化稀释后的SKOV3细胞随机分成5组:对照组、阴性对照组(shRNA-NC)及3个干扰组(MNX1-AS1-shRNA1、MNX1-AS1-shRNA2、MNX1-AS1-shRNA3)。其中,空白组加等体积培养液,其余4组分别使用LipofectamineTM3000转染不同序列质粒,细胞培养48 h 后,进行后续实验。
1.3 RT-PCR检测RNA MNX1-AS1的表达
取方法1.2中转染的对数生长期细胞,经消化、离心、重悬后,稀释为1×106/mL,接种于96孔板,置37 ℃、5% CO2培养箱24 h。采用TRIzol试剂提取细胞样品中的总RNA,进行反转录,加入相应引物。用2-△△Ct法计算RNA MNX1-AS1的相对表达水平。
将生长良好的细胞,进行消化离心,用PBS清洗后转移至干细胞培养基,重悬细胞,并计数,经细胞铺板后,培养10 d,在显微镜下观察成球数量及状态。
1.4 免疫印迹检测干细胞标记物蛋白OCT4、SOX2、ABCG2的表达
取方法1.2中对数生长期细胞,PBS洗涤,加入裂解液,收集上清液。按照BCA试剂盒说明,进行蛋白定量、电泳、转膜、封闭后,选用OCT4、SOX2、ABCG2相应抗体,进行一抗、二抗、显色等操作。
1.5 试剂盒检测氧化应激标记物MDA、SOD的含量
取方法1.2中对数生长期细胞,用PBS重悬细胞,反复冻融3次破坏细胞膜,分别按照MDA、SOD试剂盒说明进行操作。
1.6 荧光探针检测ROS的含量
按照1∶1 000比例用无血清培养液稀释DCFHDA,取方法1.2中收集好的细胞悬浮,稀释为1×106个/mL,置于培养箱中孵育(37℃,20 min),洗涤3次,探针标记完成后,在激发波长503 nm,发射波长530 nm附近,用荧光显微镜进行观察。
1.7 流式细胞仪检测线粒体膜电位的变化
取方法1.2中收集好的细胞,离心后弃上清,根据线粒体膜电位检测试剂盒说明进行操作,加入JC-1荧光探针染液,置于37℃、5% CO2培养箱20 min,洗去染色液,用流式细胞仪检测。
1.8 免疫印迹检测线粒体损伤标记蛋白Bax/Bcl-2、cleaved cas3、cas3、c-Myc的表达
操作同方法1.4,选用Bax、Bcl-2、cleaved cas3、cas3、c-Myc相应抗体。
1.9 统计学处理
采用SPSS 21.0统计软件分析,数据用±s表示,行单因素方差分析(One-Way ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 不同shRNA序列干扰lncRNA MNX1-AS1表达的影响
与对照组相比,shRNA-NC组RNA MNX1-AS1表达水平差异无统计学意义;与shRNA-NC组相比,3个干扰组RNA MNX1-AS1表达水平均降低(P<0.05,图1),其中MNX1-AS1-shRNA3组干扰最为显著,选择此组为后续实验干扰组。

图1 不同shRNA序列干扰lncRNA MNX1-AS1表达的影响
2.2 干扰lncRNA MNX1-AS1对卵巢癌干细胞成球的影响
与对照组相比,shRNA-NC组干细胞成球差异无统计学意义;与shRNA-NC组相比,MNX1-AS1-shRNA3干扰组细胞成球数量及直径显著减少(P<0.05,图2)。结果提示,干扰lncRNA MNX1-AS1能抑制SKOV3干细胞特性,能够降低肿瘤细胞的自我更新及分化,缓解卵巢癌病程。
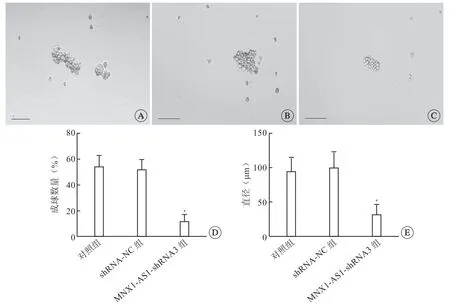
图2 各实验组对卵巢癌干细胞成球的影响
2.3 干扰lncRNA MNX1-AS1对卵巢癌干细胞标志物蛋白表达的影响
与对照组相比,shRNA-NC组标志物表达水平差异均无统计学意义;与shRNA-NC组相比,MNX1-AS1-shRNA3干扰组的OCT4、SOX2、ABCG2表达水平均降低(P<0.05,图3)。结果提示,干扰lncRNA MNX1-AS1能抑制SKOV3干细胞特性,在一定程度上缓解卵巢癌病程,与结果2.2的一致。
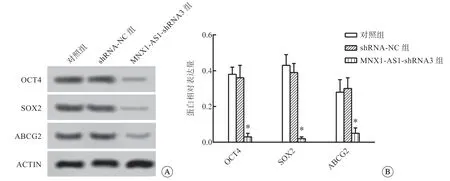
图3 各实验组对卵巢癌干细胞标志物蛋白表达的影响
2.4 干扰lncRNA MNX1-AS1对卵巢癌细胞线粒体功能的影响
与对照组相比,shRNA-NC组氧化应激标记物水平差异无统计学意义;与shRNA-NC组相比,MNX1-AS1-shRNA3干扰组MDA含量显著升高、SOD活性显著降低(P<0.05,图4A、B,见封三);MNX1-AS1-shRNA3干扰组细胞荧光强度增强,活性氧水平显著升高(P<0.05,图4C、D,见封三)。实验提示干扰lncRNA MNX1-AS1诱导氧化应激反应增强,促进SKOV3细胞线粒体损伤。
与对照组相比,shRNA-NC组卵巢癌线粒体指标水平差异无统计学意义;与shRNA-NC组相比,MNX1-AS1-shRNA3干扰组红色细胞转向绿色荧光的数目增多,绿色荧光细胞比例较大(P<0.05,图4E、F,见封三),表明线粒体的膜电位下降;MNX1-AS1-shRNA3干扰组Bax/Bcl-2、cleaved cas3/cas3表达水平显著增加,c-Myc表达显著降低(P<0.05,图4G、H,见封三)。提示干扰lncRNA MNX1-AS1促进SKOV3细胞线粒体损伤,对卵巢癌有缓解作用。
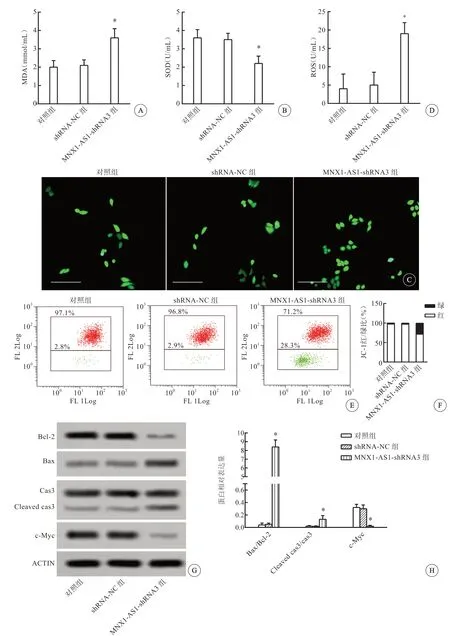
图4 各实验组对卵巢癌细胞线粒体功能的影响
3 讨论
近年来,肿瘤学领域的研究趋向于分子机制以及分子水平的临床诊断、治疗。其中,lncRNAs被证实与多种恶性肿瘤的生物学功能有关。Chen等[11]的研究表明lncRNA BLACAT1可作为子宫癌诊断和预后的潜在生物标志物。Huang等[12]的研究显示lncRNA PTTG3P通过上调PTTG1和激活PI3K/AKT信号通路促进肿瘤生长和转移,可作为肝癌预后的标志物;Xia等[13]指出二甲双胍可以通过破坏lncRNA MALAT1/miR-142-3p的海绵效应,抑制宫颈癌细胞增殖。
越来越多的lncRNA被发现在卵巢癌细胞中参与基因调控,阻断或促进癌症发展。Zeng等[14]报道lncRNA AB073614的上调可作为上皮性卵巢癌预后的标志因子,并在体内外促进肿瘤生长;余心华等[15]研究表明lncRNA ANRIL靶向miR-214的表达调控卵巢癌细胞的增殖与侵袭行为。本实验探讨干扰lncRNA MNX1-AS1对卵巢癌细胞的干样特性、氧化应激以及线粒体功能损伤的影响。
ABCG2转运蛋白维持干细胞稳定性,SOX2转录因子诱导成体干细胞转化为多功能细胞,OCT4蛋白维持干细胞多样性和自我更新的能力[15]。Wu等[16]报道干扰 lncRNA MALAT1通过增强YAP从细胞核到细胞质的易位来抑制卵巢癌干细胞的干性。结果提示,干扰lncRNA MNX1-AS1能减少干细胞成球数量及直径,降低标志物表达水平,抑制SKOV3干细胞特性,降低肿瘤细胞的自我更新及分化,缓解卵巢癌病程,与上述研究一致。
SOD是重要的抗氧化酶,能够清除超氧自由基[17]。自由基与脂质发生过氧化反应,最终产物是MDA,具有细胞毒性。因此MDA反映膜脂过氧化程度及膜系统损伤程度[18]。通过调节ROS水平,干扰细胞内稳态,促进膜系统受损致使肿瘤细胞程序性死亡,是治疗癌症的有效方法[19]。本实验显示,MNX1-AS1-shRNA3干扰组MDA含量及ROS活性显著升高、SOD活性显著降低,提示干扰lncRNA MNX1-AS1诱导氧化应激反应增强,促进SKOV3细胞线粒体损伤。
当Bax高表达或Bcl-2低表达时线粒体会释放细胞色素c激活凋亡[20]。因此,Bax/Bcl-2不仅是线粒体损伤的指标,也是决定细胞凋亡趋势的标志。此外,活化的caspase 3可促使下游的凋亡相关蛋白活化,进一步破坏线粒体生理结构完整[21]。Liu等[22]的研究显示lncRNA MEG3低表达诱导Bax/Bcl-2、cleaved cas3/cas3上调,促使膀胱癌细胞线粒体损伤,促进其凋亡。本实验MNX1-AS1-shRNA3干扰组绿色荧光细胞比例增加,表明线粒体的膜电位下降;Bax/Bcl-2、cleaved cas3/cas3表达水平显著增加,c-Myc表达显著降低。提示干扰lncRNA MNX1-AS1促进SKOV3细胞线粒体损伤、诱导其凋亡,对卵巢癌有缓解作用。
综上,干扰lncRNA MNX1-AS1抑制卵巢癌细胞的干样特性,减少肿瘤细胞的自我更新;增加 SKOV3细胞内ROS积聚,降低膜电位,致使线粒体损伤加重,诱导肿瘤细胞凋亡。因此,干扰lncRNA MNX1-AS1对SKOV3细胞抑制效果显著,具有靶向治疗卵巢癌的潜力。