丹参川芎嗪与硫酸镁对妊娠期高血压疾病大鼠的治疗效果及对胎盘组织缺氧诱导因子-1α、可溶性血管内皮生长因子受体-1表达的影响*
2021-10-29李光苗
李光苗 陈 飞 王 燕
(邢台市妇幼保健院妇产科,邢台 054000)
妊娠期高血压疾病(hypertensive disorders complicating pregnancy,HDCP)是孕妇妊娠时出现的一种常见疾病,其病情与新生儿不良结局发生率呈正相关,可影响胎儿及新生儿生长发育,严重者会出现死胎、早产、窒息等合并症[1]。HDCP随着时间推移,孕妇胎盘内的绒毛血管结构发生变化,绒毛纤维化增多、数量下降,严重者甚至出现血管闭塞,使得胎盘血流量减少,进一步影响胎儿的发育[2-3]。目前研究表明缺氧诱导因子-1α(hypoxia inducible factor 1α,HIF-1α)、可溶性血管内皮生长因子受体-1(soluble fms-like tyrosine kinase receptor 1,sFLT-1)均参与HDCP的发生,HIF-1α是缺氧状态下细胞分泌的核蛋白,与相关靶基因VEGF等结合后可促进血管新生,sFLT-1则与其功能相反,可抑制VEGF信号通路活性,导致血管新生障碍,胎盘绒毛完整性、通透性受到影响[4-5]。HDCP临床治疗中主要以硫酸镁为主,但硫酸镁毒性较大[6],因此需要寻找替代硫酸镁的新型治疗药。丹参川芎嗪注射液具有多种药理作用[7],但关于丹参川芎嗪注射液对HDCP大鼠胎盘组织的作用研究较少。由此,本研究探讨丹参川芎嗪与硫酸镁对HDCP大鼠的治疗效果及对胎盘组织中HIF-1α、sFLT-1的影响。
1 材料和方法
1.1 主要试剂
RT-PCR试剂盒(上海 优予);BCA蛋白浓度测定试剂盒、RPMI-1640培养基(上海 一研)。Wistar大鼠雌性80只,雄性40只,体质量225 g±26 g,购自南京 CAVENS生物技术有限公司,11~13周龄。
1.2 HDCP大鼠模型建立及分组
将135只大鼠于干净环境下饲养,于大鼠发情期时将2只雌鼠与1只雄鼠放于同一笼内过夜,第2天清晨发现阴道栓脱落大鼠记为妊娠第1天,共计有41只大鼠妊娠成功,妊娠第2天对其中30只大鼠尾静脉注射一氧化氮合成酶抑制剂(L-NAME)建立妊娠期高血压大鼠模型,注射持续至妊娠14 d,期间注射剂量125 mg/kg,1次/日。
将30只HDCP大鼠分为HDCP组、硫酸镁组,丹参组,每组10只,其余11只作为对照组。HDCP组、对照组大鼠于妊娠第17天于尾静脉分别腹腔注射5.0 mg·kg-1·d-1生理盐水、硫酸镁组大鼠腹腔注射60 mg·kg-1·d-1硫酸镁,丹参组大鼠腹腔注射10 mg·kg-1·d-1的丹参川芎嗪注射液,持续至妊娠第19天,记录3组大鼠妊娠第14天、19天动脉收缩压及24 h尿蛋白测量结果,所有大鼠在12~17 d后均表现为收缩压及24 h尿蛋白升高,大鼠建模后均给予药物治疗。
1.3 胎鼠发育情况
将饲养至第21天的各组大鼠给予乙醚麻醉,剖宫将胎鼠取出,记录胎鼠的身长,并对胎鼠、胎盘质量和死胎的情况进行记录。
1.4 H-E染色观察胎盘病理形态
取大鼠胎盘组织,甲醛溶液固定,梯度乙醇脱水,石蜡包埋后切片4 μm,中性树胶封片,苏木精和伊红染色液分别复染6~8 min、10 s,于显微镜下观察各组胎盘组织结构改变情况。
1.5 RT-PCR检测HIF-1α、sFLT-1 mRNA表达变化
将胰蛋白酶加入大鼠胎盘组织中进行消化反应,PBS冲洗,然后滴入0.9%NaCl溶液,采用TRIzol法提取总RNA,反转录成 cDNA,按试剂盒说明书操作。用DNA荧光染料SYBR GreenⅠ对HIF-1α、sFLT-1 mRNA表达水平进行检测,引物序列见表1,内参采用β-actin。PCR反应条件为60℃,10 min、95℃、72℃,各 30 s、95℃,5 min,循环次数40,实验重复3次,用相对定量2-ΔΔCT计算HIF-1α、sFLT-1表达。

表1 引物序列
1.6 免疫印迹检测HIF-1α、sFLT-1蛋白表达
取胎盘组织,PBS溶液洗涤后,切碎处理加入1 mL裂解液,提取组织中总蛋白测定浓度,在100 V SDS-PAGE对总蛋白进行电泳,蛋白样品采用Bradford法定量,将电泳产物转至PVDF 膜上,用10%的山羊血清,封闭0.5 h,分别加入一抗HIF-1α、sFLT-1(1∶2 000)。4℃孵育过夜,二抗常温孵育1 h(1∶2 000),β-actin 作内参,TBST冲洗后,ECL显色,BOX型凝胶成像系统检测扫描,检测HIF-1α、sFLT-1蛋白表达。
1.7 统计学处理
用SPSS 20.0 软件进行统计学分析。符合正态分布的资料用±s表示,组间比较采用单因素方差分析或χ2检验,组间两两比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血压、尿蛋白比较
与对照组相比,其余3组大鼠血压、尿蛋白值均升高,说明HDCP建模成功;与HDCP组相比,硫酸镁组、丹参组大鼠血压、尿蛋白值下降明显(P<0.05),硫酸镁组与丹参组差异有统计学意义(P<0.05)(表2)。
表2 各组大鼠血压和尿蛋白比较(n=10,±s)

表2 各组大鼠血压和尿蛋白比较(n=10,±s)
*P<0.05 vs对照组;△P<0.05 vs HDCP组;#P<0.05 vs硫酸镁组;▲P<0.05 vs同组治疗前
组别 血压(mmHg) 尿蛋白(mg/mL)干预前 干预后 干预前 干预后对照组 101.77±3.60 101.87±3.37 167.67±12.82 169.06±18.02 HDCP组 143.03±3.84* 142.65±3.42* 630.41±13.11* 628.74±22.21*硫酸镁组 142.91±3.77* 126.32±3.48*△▲ 629.35±12.75* 449.59±17.23*△▲丹参组 143.06±3.57* 120.61±3.51*△#▲ 629.92±13.03* 428.37±16.39*△#▲
2.2 各组胎鼠发育情况
对照组胎鼠、胎盘质量均高于HDCP组、丹参组(P<0.05);与HDCP组比较,硫酸镁组、丹参组胎鼠及胎盘质量明显增加(P<0.05);对照组无死胎,硫酸镁组大鼠死胎率为10.5%(9/85),丹参组为6.98%(6/86),均明显低于HDCP组的19.05%(16/84)(P<0.05)(表3)。
表3 各组胎鼠发育情况(n=10,±s,g)

表3 各组胎鼠发育情况(n=10,±s,g)
*P<0.05 vs对照组;△P<0.05 vs HDCP组;#P<0.05 vs硫酸镁组
组别 胎鼠质量 胎盘质量对照组 4.55±0.45 0.63±0.10 HDCP组 2.81±0.33* 0.42±0.08*硫酸镁组 4.33±0.36*△ 0.50±0.09*△丹参组 4.45±0.32*△# 0.58±0.08*△#
2.3 各组大鼠胎盘组织形态变化
H-E染色结果显示,对照组胎盘结构正常,细胞完整;HDCP组出现胎盘结构萎缩,绒毛数目显著减少,有坏死的绒毛纤维素样出现,细胞异常增殖;丹参组胎盘组织结构异常减轻,坏死绒毛纤维素样减少,且优于硫酸镁组(图1)。

图1 各组大鼠胎盘组织形态变化,H-E染色,标尺=50 μm
2.4 各组胎盘组织HIF-1α、sFLT-1 mRNA水平变化
RT-PCR法检测显示,与对照组比较,HDCP组胎盘组织HIF-1α、sFLT-1 mRNA水平明显升高(P<0.05);与HDCP组比较,硫酸镁组及丹参组HIF-1α、sFLT-1 mRNA水平明显下降(P<0.05),且丹参组低于硫酸镁组(P<0.05,图2)。

图2 各组大鼠胎盘组织HIF-1α、sFLT-1 mRNA表达水平变化
2.5 各组胎盘组织HIF-1α、sFLT-1蛋白表达变化
免疫印迹检测结果显示,与对照组比较,HDCP组胎盘组织HIF-1α、sFLT-1蛋白表达明显升高(P<0.05);与HDCP组比较,硫酸镁组及丹参组HIF-1α、sFLT-1蛋白表达明显下降(P<0.05),且丹参组低于硫酸镁组(P<0.05,图3)。
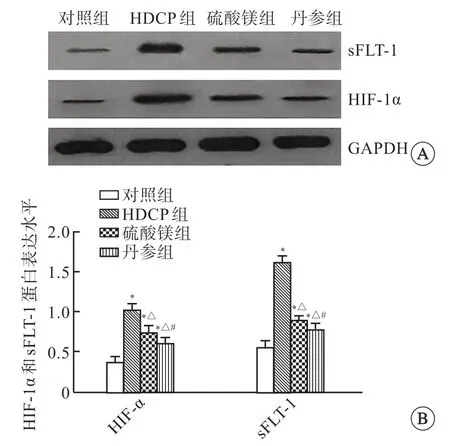
图3 各组大鼠胎盘组织HIF-1α、sFLT-1蛋白表达水平变化
3 讨论
HDCP是导致孕妇与围产儿死亡率较高的主要原因之一,其病理表现为水肿、血压升高、蛋白尿等[8]。目前HDCP的发病机制尚未完全明确,国内外相关的研究数据也存在差异。因此,产前准确判断孕妇是否患有HDCP,可降低孕产妇和新生儿患病概率[9]。目前尚无确切有效的方法治疗HDCP,降压药物可以有效降低孕妇血压,但降压药物均可通过胎盘被胎儿吸收,影响胎儿妊娠结局[10-11]。丹参川芎嗪注射液中含有丹参、盐酸川芎嗪等,均具有明显降压、抗炎、抗纤维化作用,近年来在治疗HDCP中得到了广泛应用[12]。
本研究结果显示,与对照组相比,其余3组大鼠血压、尿蛋白值均升高,说明HDCP建模成功。与HDCP组相比,硫酸镁组及丹参组大鼠血压、尿蛋白值下降明显。对照组胎鼠、胎盘质量均高于HDCP组、丹参组,与HDCP组比较,硫酸镁组、丹参组胎鼠及胎盘质量明显增加,且死胎率明显降低。临床常用硫酸镁改善患者血压,虽然其可以有效降低孕妇血压,但其药物成分可通过胎盘进入胎儿体内,对胎儿的发育产生一定的危害[13-14]。有研究证实,HDCP患者胎盘功能的异常变化,胎盘血管呈异常收缩痉挛状态,对胎儿的发育造成极大影响,严重时可能会出现胎死宫内[15]。相关文献报道,丹参川芎嗪注射液中的川芎嗪可影响胎盘血流量增加,对影响胎盘发育的血栓烷A分泌有明显的抑制作用[16]。川芎嗪是一种从川芎根茎分离的生物碱类,以往研究证实能够改善心脑血管疾病,对胎盘组织血流动力学产生影响,HDCP导致的胎盘组织血氧供应不足,川芎嗪能够滋养细胞基膜,增加绒毛血管基膜厚度和胎盘组织血流灌注,而丹参是扩张血管、促进血液循环的良药,可刺激血管内皮细胞的有丝分裂,提高血管内皮细胞的渗透性,有利于胎盘发育,同时对纤维蛋白溶解有很强的促进作用,改善胎盘血流状态及微循环障碍[17]。本研究结果与上述研究结果相符。
本研究对照组胎盘结构正常,细胞完整,HDCP组出现胎盘结构萎缩,绒毛数目显著减少,有坏死的绒毛纤维素样出现,细胞异常增殖,丹参组胎盘结构异常减轻,坏死绒毛纤维素样减少,且优于硫酸镁组。与对照组比较,HDCP组胎盘组织HIF-1α、sFLT-1 mRNA及蛋白水平明显升高,与HDCP组比较,硫酸镁组、丹参组HIF-1α、sFLT-1 mRNA及蛋白水平明显下降,且丹参组低于硫酸镁组。有研究证实,丹参川芎嗪与硫酸镁对HDCP的治疗两者同样具有降低大鼠血压、尿蛋白的作用,改善HDCP造成的胎盘、胎儿发育异常,降低胎鼠死亡率低,但丹参川芎嗪为中药成分,其安全性更高[18-19]。有学者认为,VEGF水平下降是血管内皮功能障碍及妊娠期血压升高的重要原因,HIF-1α可与VEGF相关靶基因结合后血管内皮细胞功能异常,胎盘发育迟缓,影响新生儿的健康[20]。薛峰等[21]通过对妊娠高血压孕产妇及健康孕产妇对比研究表明,妊娠高血压孕产妇血清中sFLT-1、胎盘生长因子(PLGF)水平及sFLT-1/PLGF比值均高于健康孕产妇,提示sFLT-1、PLGF参与妊娠高血压的发生及发展。相关研究证实,sFLT-1在血管中新分支生成、重建中扮演重要角色,HIF-1α水平升高造成血管内皮细胞的损伤,参与胎盘组织的结构改变,丹参川芎嗪降压机制可能与其扩张血管、抑制胎盘组织HIF-1α表达,同时具有利尿的功效有关[22]。
综上所述,丹参川芎嗪与硫酸镁均对HDCP大鼠有明显治疗作用,胎鼠妊娠结局较好,且丹参川芎嗪效果更佳,其作用机制可能与降低大鼠胎盘HIF-1α、sFLT-1表达有关。