嗜酸性粒细胞通过调节巨噬细胞极化减轻脂多糖诱导的急性肺损伤
2021-10-29李雅慧
李 红 李雅慧
(1 宁夏吴忠市人民医院老年医学科,全科医学科,吴忠 751100;2 解放军联勤保障部队第九四二医院内分泌风湿免疫科,银川 750004)
急性肺损伤(acute lung injury,ALI)是急性呼吸窘迫综合征的早期表现,病死率高达30%~40%,在老年患者中甚至高达60%[1]。目前认为,巨噬细胞是参与ALI进展的关键效应细胞,其对环境刺激表现出高度的可塑性和异质性,并可诱导分化为2种不同的极化状态:典型激活型(M1型)和交替激活型(M2型)[2]。M1巨噬细胞通过分泌各种细胞因子,如肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin,IL)-6和IL-12发挥促炎作用;相反,M2型巨噬细胞则产生抗炎细胞因子如IL-10和IL-13[3]。调节巨噬细胞极化会影响ALI的炎症反应,但其机制复杂。嗜酸性粒细胞(eosinophil,Eos)通常被认为是辅助性T细胞2效应细胞。研究显示,用IL-4和IL-10刺激的M2型巨噬细胞可以诱导嗜酸性粒细胞浸润[4]。脂肪组织嗜酸性粒细胞可通过IL-4和IL-13加速M2型巨噬细胞的极化来减少炎症反应[5]。最近一项临床评估表明嗜酸性粒细胞在ALI中具有潜在的抗炎作用[6]。为了确定嗜酸性粒细胞在ALI中的作用,本研究观察体外嗜酸性粒细胞对巨噬细胞极化的影响,以及体内注射嗜酸性粒细胞是否能改善ALI及其相关机制,旨在为ALI中嗜酸性粒细胞和巨噬细胞极化之间的相互作用提供重要的实验依据。
1 材料和方法
1.1 动物
Balb/c雄性小鼠(6周龄,体质量22~25 g)购自北京维通利华实验动物技术有限公司(SCXK(京)2016-0011)。将小鼠饲养在聚碳酸酯笼中,每笼5只,在无病原体和温度控制(25℃)的环境中进行严格的12 h光照/黑暗循环饲养,自由进食和水。
1.2 嗜酸性粒细胞的体外分离和扩增
参照文献[7]方法,从骨髓中分离并扩增嗜酸性粒细胞。取BALB/c小鼠股骨和胫骨,然后用10 mL的RPMI1640培养基冲洗以收集骨髓细胞。裂解红细胞后,骨髓细胞在含有100 ng/mL FLT3配体(以色列ProSpec公司)和100 ng/mL小鼠干细胞因子(以色列ProSpec公司)的改良RPMI1640培养基中重新悬浮。第4天,加入10 ng/mL重组小鼠IL-5(美国BioVision公司),每隔2 d用新鲜培养基替换一半培养基。第10天采集细胞,通过FAS-Calibur流式细胞仪(美国BD Biosciences公司)鉴定嗜酸性粒细胞。
1.3 巨噬细胞与嗜酸性粒细胞共培养
小鼠腹腔注射3%无菌硫乙醇酸盐培养基(美国Thermo Fisher Scientific公司),3 d后颈椎脱臼法处死小鼠。在无菌条件下打开腹腔,并用15 mL预冷的无血清RMPI1640冲洗。通过离心收集腹膜灌洗液中的细胞,并将其重悬在含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素(美国Gibco公司)的DMEM培养基(美国HyClone公司)中。将细胞以1×106/孔的密度接种在12孔板中,并在37℃下孵育2 h,去除非贴壁细胞,贴壁细胞融合率达到80%时,以1×106/mL的密度接种在48孔板中,用5 μg/mL LPS和100 U/mL重组小鼠γ干扰素(interferon γ,IFN-γ)(美国Bio-Basic公司)刺激3 h,然后与不同比例的嗜酸性粒细胞(1∶5、1∶10、1∶20)共培养24 h,测定巨噬细胞极化。
1.4 实时定量PCR检测促炎及抗炎因子的mRNA表达
用RNA分离试剂盒(美国Invitrogen公司)提取肺组织或细胞总RNA,用cDNA合成试剂盒(日本TaKaRa公司)在37℃下反转录15 min。然后,使用SYBR Premix Ex TaqTMⅡ(日本TaKaRa公司)和ABI 7500 PCR系统(美国Life Technologies公司)确定靶基因的表达水平。管家基因GAPDH用作内部对照。IL-6基因:正向序列 为5'-TAGTCCTTCCTACCCCAATTTCC-3',反向序列为5'- TTGGTCCTTAGCCACTCCTTC-3';TNF-α基因:正向序列为5'-AAGCCTGTAGCCCA CGTCGTA-3',反向序列为5'-GGCACCACTAGT TGGTTGTCTTTG-3';IL-10基因:正向序列为5'-G CTCTTACTGACTGGCATGAG-3',反向序列为5'-C GCAGCTCTAGGAGCATGTG-3';重组人精氨酸酶1、(recombinant arginase 1,Arg1)基因:正向序列为5'-CTCCAAGCCAAAGTCCTTAGAG-3',反向序列为5'-GGAGCTGTCATTAGGGACATCA-3';iNOS基因:正向序列为5'-CACCAAGCTGAACTTGAGC GA-3',反向序列为5'-CCATAGGAAAAGACTGCA CCGA-3';β-actin基因:正向序列为5'-AGTGTGA CGTTGACATCCGT-3',反向序列为5'-GCAGCT CAGTAACAGTCCGC-3'。使用2-ΔΔCt方法计算靶基因的相对表达值。
1.5 免疫印迹检测巨噬细胞中过氧化物酶增殖物激活受体γ(peroxidase proliferator-activated receptor γ,PPARγ)蛋白的表达
用冰冷的RIPA裂解缓冲液提取来自肺匀浆和细胞的总蛋白质,并使用BCA试剂盒(美国Thermo Fisher公司)测定蛋白质含量。通过凝胶电泳将蛋白带转移至聚偏二氟乙烯膜(美国Millipore公司)上,并在4℃下用5%脱脂乳封闭过夜。然后将膜与稀释的抗PPARγ(1∶500,美国Santa Cruz Biotechnology公司)和抗β-actin抗体(1∶10 000,上海康成生物工程有限公司)在室温下放置1 h,然后再加入HRP偶联的二抗 (1∶2 000,美国Santa Cruz Biotechnology公司),室温下放置40 min。使用Image-Pro Plus 6.0软件分析蛋白质表达水平。
1.6 siRNA转染小鼠巨噬细胞
在24孔板中培养的巨噬细胞融合度达到50%时,用含干扰对照RNA(si-NC)或PPARγ siRNA(si-PPARγ)(上海GenePharma公司)转染24 h后,再用5 μg/mL 脂多糖(lipopolysaccharide,LPS)和100 U/mL重组小鼠IFN-γ刺激3 h,然后与嗜酸性粒细胞(1∶20)共培养24 h,测定巨噬细胞极化。
1.7 动物分组和给药治疗
将60只Balb/c小鼠随机分为对照组、ALI组和ALI+Eos组,每组20只。参照文献[8]方法,ALI组通过气管内注射10 mg/kg LPS诱导ALI;对照组尾静脉给予相同体积的PBS缓冲液;ALI+Eos组给予尾静脉注射1×107个嗜酸性粒细胞,监测动物7 d的存活情况。在LPS注射后3 h和24 h处死动物,H-E染色评估左肺损伤程度,收集右肺检测促炎和抗炎细胞因子mRNA水平。
1.8 肺组织病理学观察
将石蜡包埋的肺组织切成5 μm的厚度,用H-E染色,中性树脂封固,并在BX41显微镜(日本Olympus公司)下评估肺组织病理形态学改变。评分内容包括间质水肿、肺泡水肿、中性粒细胞浸润和肺泡充血。根据严重程度,评分范围为0~4分:0分为无病变或非常轻微;1分为轻度病变;2分为中度病变;3分为重度病变;4分为极重度病变。以4项指标的总分平均值作为肺损伤评分。
1.9 流式细胞术检测肺泡巨噬细胞中iNOS和CD206的百分比
Acutase(南京福麦斯生物技术有限公司)消化肺泡巨噬细胞,制成单细胞悬液,再悬浮在染色缓冲液(美国BD Biosciences公司)中。随后,加入FcR阻断试剂(美国Miltenyi公司)以提高抗体的特异性。细胞首先用表面标记物(F4/80)染色,用固定/渗透缓冲液(南京福麦斯生物技术有限公司)固定和渗透,然后用APC偶联的iNOS(M1型标志物)和PE偶联的CD206(M2型标志物)(美国Biolegend公司)染色,通过流式细胞仪进行分析。
1.10 统计学处理
采用SPSS 23.0统计学软件对数据进行统计学分析。计量资料采用±s表示,组内比较采用单因素方差分析,组间使用Bonferroni事后检验进行成对比较。计数资料采用百分率(%)表示,组间比较采用对数秩检验分析不同组的存活率。P<0.05为差异有统计学意义。
2 结果
2.1 嗜酸性粒细胞对巨噬细胞极化的影响
与嗜酸性粒细胞共培养后,用LPS+IFN-γ刺激巨噬细胞,其TNF-α和IL-6 mRNA水平呈剂量依赖性降低,而IL-10 mRNA水平呈剂量依赖性增加(图1A)。巨噬细胞与嗜酸性粒细胞共培养后,M1型巨噬细胞标志基因iNOS表达增加,M2巨噬细胞标志基因Arg1表达减少,且呈剂量依赖性逆转(图1B),提示嗜酸性粒细胞促进巨噬细胞向M2表型分化。
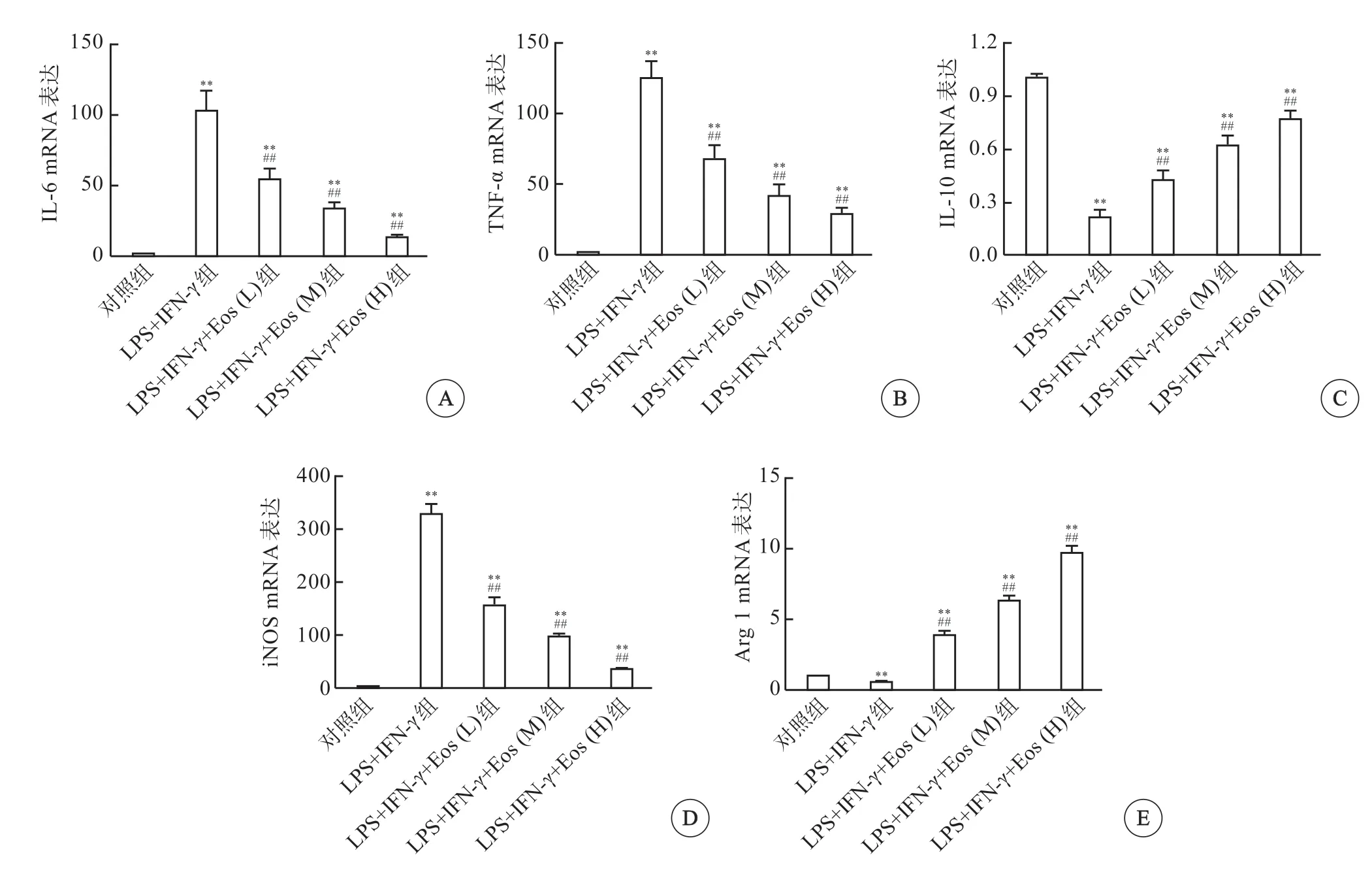
图1 嗜酸性粒细胞体外对巨噬细胞极化的影响
2.2 PPARγ通路参与嗜酸性粒细胞介导的巨噬细胞极化
免疫印迹检测显示,嗜酸性粒细胞增加巨噬细胞中的PPARγ活性(图2A),呈剂量依赖性;且嗜酸性粒细胞显著增加了LPS+IFN-γ刺激下PPARγ的活性(图2B)。转染si-PPARγ抑制了嗜酸性粒细胞对巨噬细胞向M2表型分化的促进作用 (图2C)。
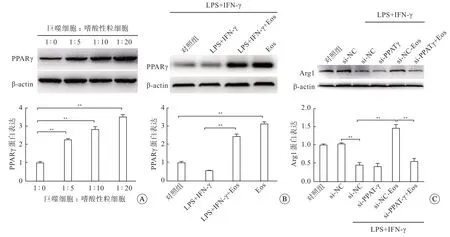
图2 PPARγ通路参与嗜酸性粒细胞介导的巨噬细胞极化
2.3 嗜酸性粒细胞对LPS致炎性小鼠ALI的影响
7 d存活率监测结果显示,静脉注射嗜酸性粒细胞显著提高了ALI小鼠的存活率(P<0.01)(图3A)。注射LPS后3 h和24 h,H-E染色显示小鼠气管内出现严重的肺水肿和炎症浸润,随着时间推移组织学评分明显增加。嗜酸性粒细胞干预可显著改善小鼠的肺损伤,减少组织损伤(图3B、3C)。

图3 嗜酸性粒细胞对LPS诱导的ALI小鼠的死亡率和肺损伤的影响
2.4 嗜酸性粒细胞对ALI小鼠肺巨噬细胞极化的影响
在3 h和24 h,LPS增加了肺部促炎性细胞因子IL-6和TNF-α mRNA水平。嗜酸性粒细胞干预可逆转上述作用。此外,LPS也增加了肺组织中抗炎细胞因子IL-10 mRNA水平,嗜酸性粒细胞干预则进一步增加了IL-10 mRNA的水平(图4A)。流式细胞术分析显示,LPS增加了肺泡M1型巨噬细胞iNOS的百分比和M2巨噬细胞标志基因CD206的百分比,嗜酸性粒细胞干预则进一步增加了肺泡CD206的百分比,而iNOS的百分比明显降低(图4B、4C)。此外,免疫印迹分析显示,ALI+Eos组肺组织中的PPAR γ活性显著高于ALI组(P<0.01)(图4D)。

图4 嗜酸性粒细胞对急性肺损伤小鼠肺巨噬细胞极化的影响
3 讨论
ALI与高死亡率有关,尤其是在老年患者中,它涉及由激活的细胞和体液免疫诱导的不受控制的系统性炎症反应,炎症细胞和细胞因子的积累导致毛细血管内皮和肺泡上皮屏障的破坏,并导致随后的肺水肿和缺氧[9]。尽管ALI的危险因素多种多样,但抑制肺部炎症是这一危重综合征的常见治疗策略[10]。调节驱动巨噬细胞极化的转录子的活性可能有助于减轻ALI患者的炎症和改善预后,因为M1和M2型巨噬细胞之间的平衡影响固有免疫反应的持续时间和大小,从而影响抗病原体反应和组织损伤[11]。近年来,大量研究表明嗜酸性粒细胞在非过敏性疾病组织中蓄积,并参与肿瘤的发生[12]、肠道炎症疾病[13]和造血干细胞稳态[14]。本研究体外实验表明,嗜酸性粒细胞可能通过促进PPAR-γ的表达,使巨噬细胞从M1型向M2型极化转变,增强抗炎递质的表达,从而为调节巨噬细胞极化治疗ALI提供一种潜在策略。
嗜酸性粒细胞通常认为是寄生虫感染或过敏性炎症的终端效应细胞,但越来越多的证据表明其在各种免疫反应中具有调节作用[15]。据报道,嗜酸性粒细胞与树突状细胞相互作用,协同促进过敏性气道的辅助性T细胞2免疫反应[16]。值得注意的是,最近的一项临床研究表明,ALI患者的肺中嗜酸性粒细胞数量增加,表明嗜酸性粒细胞可能在ALI中起着保护作用[6]。此外,嗜酸性粒细胞也参与促进损伤后组织修复的过程[17]。相反,嗜酸性粒细胞占优势的疾病患者,如哮喘,有较高的感染风险[18]。因此,嗜酸性粒细胞在ALI发病机制中的最终作用及其分子机制有待进一步研究。本研究采用在气管内注射LPS诱导ALI小鼠模型,研究结果显示静脉注射嗜酸性粒细胞可以保护小鼠免受LPS诱导的死亡。ALI组大部分死亡的小鼠均处于ALI的早期阶段,这可能是由于LPS激活TLR4信号通路产生大量炎症递质,导致严重的炎症浸润促进肺组织损伤。通过mRNA分析证实,单次LPS诱导后24 h内,各种炎症因子的水平发生变化,表明动物处于急性炎症的早期“细胞因子风暴”阶段。嗜酸性粒细胞下调了肺部的促炎基因(TNF-α和IL-6)表达,上调了抗炎基因(IL-10)表达,提示嗜酸性粒细胞抑制了LPS诱导的肺部炎症。进一步流式细胞术分析显示,给予嗜酸性粒细胞显著提高了ALI小鼠肺中M2型巨噬细胞的百分比。提示嗜酸性粒细胞可以通过促进巨噬细胞由M1型转化为M2抗炎表型来减轻LPS诱导的ALI。
PPARγ在炎症调节和脓毒症进展中扮演着重要角色[19]。有研究表明,活化PPARγ可显著降低脓毒症炎症递质的表达和组织损伤[20]。也有研究表明,激活PPARγ可显著促进巨噬细胞向M2表型极化,从而抑制炎症反应[21]。因此,PPARγ可能有助于嗜酸性粒细胞介导其对早期ALI的保护作用。在本研究的体外实验中,嗜酸性粒细胞显著增加了LPS+IFN-γ刺激下PPARγ的活性,并且体内实验显示嗜酸性粒细胞增强了ALI大鼠肺组织中PPARγ的活性。因此,嗜酸性粒细胞促进巨噬细胞的M2极化可能与PPARγ高表达相关,而PPARγ可直接作用于NF-κB以逆转M1/M2极化[21]。
综上所述,本研究揭示了嗜酸性粒细胞通过激活PPARγ信号通路,显著增强了巨噬细胞M2极化,并改善了LPS诱导的ALI。这些研究结果可能为ALI的诊断和干预提供新的方法。