Bax抑制因子1对人妊娠期肝内胆汁淤积症胎盘滋养细胞凋亡的影响及其机制*
2021-10-29冯国惠美丽班买买提祖农
冯国惠 美丽班·买买提祖农 黄 莺
(新疆维吾尔自治区人民医院产科,乌鲁木齐 830000)
妊娠期肝内胆汁淤积症(intrahepatic cholestasis of pregnancy,ICP)是一种以全身皮肤瘙痒、肝功能损伤和(或)血清总胆汁酸升高为主要特征的妊娠期特发性疾病[1]。研究表明,遗传、免疫及环境因素等均参与ICP发生发展过程[2],但ICP的具体发病机制仍不清楚。胎盘是母体与胎儿的物质交换器官,而胎盘绒毛膜滋养细胞是胎盘功能的主要执行细胞[3]。大量数据表明,ICP患者胎盘绒毛组织凋亡相关基因的表达异常增加,进一步的研究显示高浓度胆汁酸诱导的滋养细胞凋亡率明显增加[4-7]。Bax抑制因子1(Bax inhibitor-1,BI-1)是新发现的一种凋亡抑制因子,其主要表达于膜性细胞器(如线粒体、内质网等)表面。BI-1在生物进化中高度保守,且广泛存在于人体肺、前列腺、心、胎盘等器官与组织中[8-9]。研究表明,BI-1可通过线粒体相关的凋亡途径阻断细胞凋亡进程[10-11]。牛磺胆酸(taurocholate acid,TCA)是胆汁酸的牛磺酸偶联物,常被用来作为ICP的体外诱导物[7]。本研究通过检测BI-1在ICP患者胎盘组织的表达,并应用TCA与人滋养细胞系HTR8建立ICP体外模型,以探究BI-1在ICP中的作用及其相关机制。
1 材料和方法
1.1 标本采集
选取2018年5月至2019年5月新疆维吾尔自治区人民医院产科住院分娩的ICP孕产妇15例为研究对象,设为ICP组,年龄为(27.3±2.6)岁,孕周为(38.1±4.2)周。ICP的诊断按照中华医学会妇产科分会2015年制定的ICP诊疗指南[12]。另取同时期于本院住院分娩的15例正常孕产妇作为对照组,年龄为(28.5±1.7)岁,孕周为(37.5±5.6)周。2组孕妇的年龄、孕周相比差异均无统计学意义(P>0.05)。所有孕妇均为自然受孕的单胎初产妇,且分娩方式为经阴道分娩。ICP组的纳入条件符合ICP诊断标准,疾病排除合并原发性高血压、肝肾疾病、代谢及内分泌疾病等其他妊娠合并症患者,且孕期未使用避孕药、免疫调节剂及其他激素类药物。胎盘娩出后立即从脐带附着处取约1 cm×1 cm×1 cm大小的胎盘组织5~10块,避开出血点及钙化梗死灶,用4℃预冷的生理盐水冲洗数遍以除去血污,并将其固定于4%的甲醛溶液中以备后续实验使用。所有研究对象均签署知情同意书。
1.2 细胞系及主要试剂
人绒毛滋养细胞系HTR8由新疆医科大学第一附属医院妇产科惠赠;DMEM-F12(美国Hyclone公司);TRIzol试剂、Opti-MEM培养基(美国Invitrogen公司);胎牛血清(FBS)、1%的青链霉素(均为100 U/mL)、Annexin V-FITC/PI凋亡检测试剂盒(武汉博士德生物公司);SYBR Green PCR试剂盒(上海康为世纪公司);PCR引物(上海生工公司);免疫组织化学试剂盒(美国Burlingame公司);JC-1流式线粒体膜电位检测试剂盒(北京索莱宝生物科技公司);携带过表达BI-1和阴性对照质粒的慢病毒载体(LV-BI-1与LV-NC)由上海吉凯基因化学技术有限公司构建及检测;线粒体提取试剂(Qiagen公司);兔抗Bcl-2、Bax、cleaved-caspase-3、GAPDH单克隆抗体(美国Cell Signaling Technology公司);兔抗BI-1单克隆抗体(美国Abcam公司);小鼠抗细胞色素C(Cyt-C)、细胞色素C氧化酶(COX)Ⅳ单克隆抗体(美国Santa Cruz公司);辣根过氧化物酶(HRP)标记的山羊抗兔IgG(美国Pierce公司);其他试剂均为国产分析纯。
1.3 免疫组织化学显色
取固定于甲醛溶液中的胎盘组织,石蜡包埋,切片厚度4 μm,采用SP法检测2组胎盘组织中BI-1的表达。一抗为兔抗BI-1单克隆抗体(1∶100),二抗为HRP标记的山羊抗兔IgG(1∶200),其余操作严格按照试剂盒说明书进行。染色结果按染色强度与染色范围进行综合评定,其中染色强度定义为无色、淡黄色、棕黄色、棕褐色,依次评为0~4分;染色范围定义为0~10%、11%~50%、51%~75%、76%~100%,依次评为1~4分。最后将两者相加,0~3分为阴性,4分以上为阳性。
1.4 细胞培养、TCA处理及慢病毒感染与分组
①细胞培养:常规复苏HTR8细胞后使用含10 % FBS,1 %青链霉素的DMEM-F12培养液于37 ℃、5 % CO2培养箱进行培养。②TCA处理:取生长状态良好的HTR8细胞,细胞计数后,以5×105个/孔接种于12孔板中,分别加入2 mL含10、50、100 μmol/L的TCA培 养液刺激细胞,每个浓度设置3个复孔,于培养箱中培养24 h后检测不同处理条件下细胞中BI-1 mRNA及蛋白的表达。③慢病毒感染:感染前24 h,取生长状态良好的HTR8细胞,调整细胞密度至3×105/mL,并接种于24孔板中,用Opti-MEM稀释慢病毒液,使其感染指数(multiplicity of infection,MOI)值为20,同时添加1 μg/mL的Polybrene,置于上述条件的培养箱中培养12 h后,更换为10%FBS的DMEM-F12新鲜培养液继续培养48 h,荧光显微镜拍照观察绿色荧光表达情况。用1 μg/mL的嘌呤霉素筛选稳定转染的细胞进行后续实验。④细胞分组:将上述慢病毒感染后的HTR8细胞分为3组,阴性对照组(negative control,NC组),即正常培养的HTR8细胞;TCA+LV-NC组,即经100 μmol/L TCA处理的感染LV-NC的HTR8细胞;TCA+LV-BI-1组,即经100 μmol/L TCA处理的感染LV-BI-1的HTR8细胞。上述各组细胞置于37 ℃、5 % CO2恒温培养箱培养24 h后,收集细胞,以备后续实验使用。
1.5 Annexin V-FITC检测各组细胞凋亡
取各组HTR8细胞,1 200 r/min离心5 min后收集细胞沉淀,PBS重悬细胞并计数;取约6×105个细胞,经上述方法再次离心后,依次加入195 μL Annexin V-FITC结合液、5 μL的Annexin V-FITC和10 μL的PI染色液,混匀后室温下避光孵育30 min,随即上流式细胞仪进行分析。实验重复3次。
1.6 透射电镜观察HTR8细胞线粒体超微结构
取各组HTR8细胞,2.5%戊二醛室温下固定12 h后,于1%锇酸中再次固定2 h,梯度乙醇脱水、包埋、切片,加入醋酸铀和枸橼酸铅染色后制成超薄切片,于透射电子显微镜下观察细胞超微结构变化。
1.7 流式JC-1法检测线粒体膜电位
取各组HTR8细胞,1 200 r/min离心5 min后收集细胞沉淀,PBS重悬后,收集细胞于离心管中,调整细胞密度至1×106/mL,加入终浓度为10 μg/mL的JC-1染液,充分混匀后,于37℃细胞培养箱中孵育20 min。上述方法离心3次后,上流式细胞仪检测。实验重复3次。
1.8 实时荧光定量PCR(RT-PCR)检测滋养细胞中BI-1 mRNA的表达
采用TRIzol法提取各组HTR8细胞中总RNA,测定浓度与纯度后,按照cDNA合成试剂盒说明书方法将各组细胞中的总RNA逆转录为cDNA,再按照SYBR Green PCR试剂盒说明书建议的反应时间与温度进行RT-PCR反应。BI-1上游引物序列为5'-CCTCTTCTGGTGGATGC-3',下游引物序列为5'-GCCTCGCTCTGTTGATGTGA-3';GAPDH上游引物序列为5'-AGAAGGCTGGGGCTCATTT G-3',下游引物序列为5'-AGGGGCCATCCACAG TCTTC-3'。反应条件为:95ºC预变性10 min,95ºC变性10 s,60ºC退火30 s,72℃延伸15 s,共35个循环周期。应用公式2-∆∆Ct计算各基因相对表达量。实验重复3次。
1.9 免疫印迹检测滋养细胞BI-1及凋亡相关蛋白的表达
采用RIPA及PMSF裂解法提取各组HTR8细胞总蛋白,BCA法进行蛋白定量。配制聚丙烯酰胺凝胶,取约50 μg的蛋白进行SDS-PAGE电泳分离待测蛋白,采用湿转法将分离的蛋白转至硝酸纤维素膜上,5%的脱脂奶粉室温封闭2 h后,分别加入一抗BI-1(1∶500)、Bcl-2(1∶800)、Bax(1∶800)、cleaved caspase-3(1∶1 000)、Cyt-C(1∶800)、GAPDH(1∶2 000)后,4℃摇床孵育过夜。TBST溶液洗涤,加入HRP标记的山羊抗兔或大鼠抗小鼠IgG(1∶5 000),室温摇床孵育1 h。按照线粒体提取试剂盒说明书方法于冰上提取细胞中的线粒体,再用蛋白质提取试剂盒提取线粒体中的总蛋白,其余步骤同上,加入Cyt-C(1∶1 000)、COX Ⅳ(1∶2 000),并以COX Ⅳ为内参。最后在载有蛋白条带的PVDF膜上均匀滴加ECL发光液后于凝胶成像仪中进行曝光拍照。Image J软件测定条带灰度值,以目标蛋白与内参GAPDH的比值作为各蛋白相对含量。以上实验重复3次。
1.10 统计学处理
采用SPSS 19.0进行统计学分析,GraphPad Prism 5.0进行统计结果图的绘制。计量资料以±s表示。两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 BI-1在胎盘组织中的表达
免疫组织化学显色结果显示BI-1蛋白阳性着色为棕黄色。BI-1虽在胎盘组织中表达强度不高,但仍广泛分布于胎盘绒毛组织中,且其主要定位于滋养细胞的细胞质中。染色结果分析显示,正常对照组BI-1蛋白的阳性表达率为16.2%,而ICP组胎盘组织BI-1的阳性表达率为7.4%,差异有统计学意义(P<0.05)(图1,见封二)。
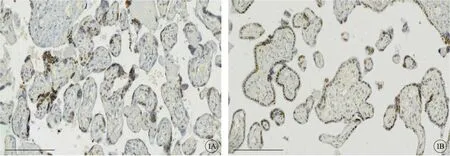
图1 IHC检测胎盘组织BI-1的表达,标尺=100 μm。
2.2 TCA对滋养细胞BI-1表达的影响
应用不同浓度的TCA(10、50、100 μmol/L)刺激HTR8细胞24 h后,应用RT-PCR及免疫印迹检测细胞BI-1 mRNA及蛋白的表达。结果显示,与正常培养的HTR8细胞相比,随TCA浓度的增加,BI-1 mRNA及蛋白表达均逐渐降低,其中以高浓度(100 μmol/L)TCA的抑制作用最为显著(P<0.01)(图2,见封二)。
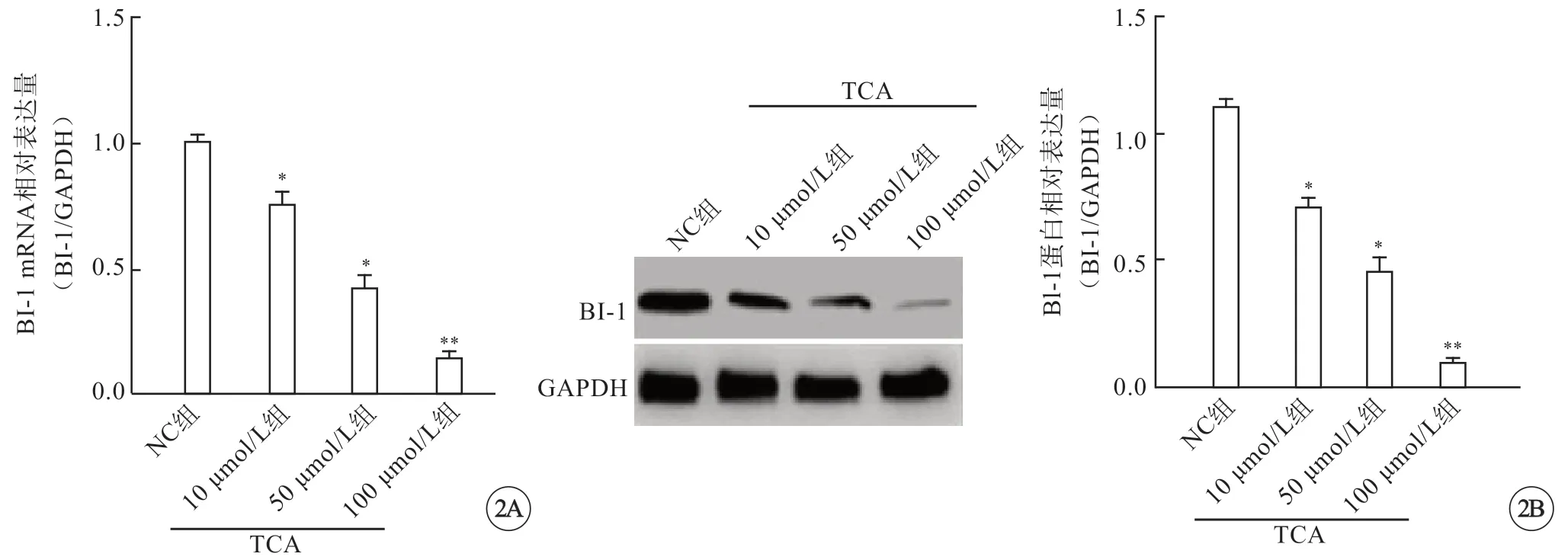
图2 TCA抑制HTR8细胞BI-1的表达。
2.3 感染慢病毒LV-BI-1后滋养细胞BI-1 mRNA的表达
应用荧光显微镜观察慢病毒的感染效率,结果显示(3A,见封二),LV-NC组及LV-BI-1组慢病毒成功感染HTR8细胞,效率可达80%以上。RTPCR检测感染后细胞中BI-1 mRNA的表达,结果显示,与未处理的HTR8细胞相比,感染LV-BI-1组细胞BI-1 mRNA表达显著增加(P<0.05),而感染LV-NC的细胞无明显变化(P>0.05),提示成功建立了过表达BI-1的滋养细胞系(图3B,见封二)。
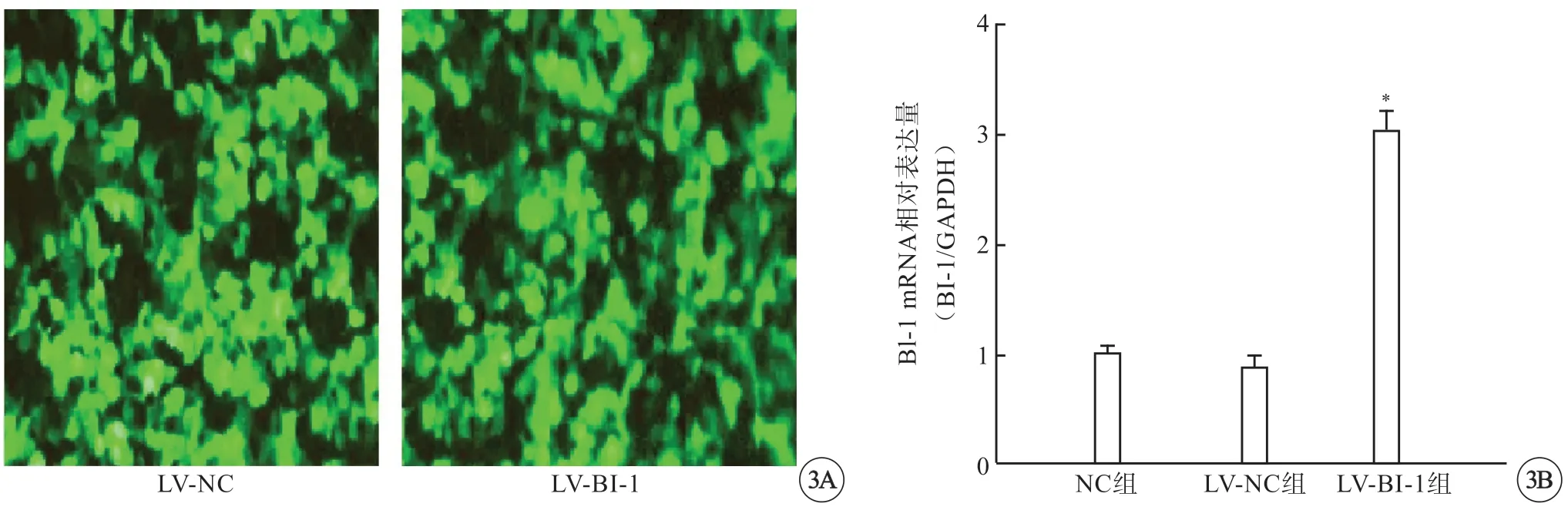
图3 感染慢病毒LV-BI-1后HTR8细胞BI-1 mRNA表达显著增加。
2.4 过表达BI-1对TCA诱导的滋养细胞凋亡的影响
应用Annexin V-FITC流式细胞仪检测TCA对过表达BI-1 HTR8细胞凋亡的影响,结果显示,与NC组相比,TCA+LV-NC组和TCA+LV-BI-1组细胞凋亡率均显著增加(P<0.05),而与TCA+LVNC组相比,LV+BI-1组HTR8细胞凋亡率明显降低(P<0.05)(图4,见封二)。
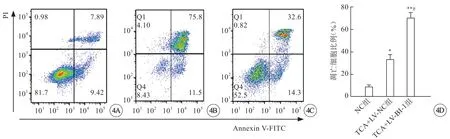
图4 过表达BI-1抑制TCA诱导的胎盘滋养细胞凋亡。
2.5 过表达BI-1对TCA诱导的滋养细胞线粒体结构的影响
透射电镜观察过表达BI-1对TCA诱导的HTR8细胞线粒体超微结构的影响,结果显示,NC组线粒体结构完整,外膜光滑、无肿胀,基质内颗粒(电子致密的无结构颗粒)含量丰富;TCA+LV-NC组HTR8细胞线粒体结构大量破坏,发生肿胀,线粒体嵴排列紊乱,线粒体膜破损严重,基质内颗粒明显减少,且能够见到少量空泡样变性;TCA+LVBI-1组可见细胞线粒体结构多数完整,线粒体嵴变短、数目减少,但线粒体嵴断裂少见,基质内颗粒丰富,仅部分线粒体出现肿胀、膜破损现象(图5)。

图5 过表达BI-1改善TCA诱导的滋养细胞线粒体损伤,标尺=1 μm
2.6 过表达BI-1对TCA诱导的滋养细胞线粒体膜电位的影响
JC-1流式细胞仪检测过表达BI-1对TCA诱导的HTR8细胞线粒体通透性转换孔开放水平的影响,结果显示,与NC组相比,TCA+LV-NC组和TCA+LV-BI-1组细胞的线粒体膜电位均显著增加(P<0.05),而与TCA+LV-NC组相比,LV+BI-1组HTR8细胞线粒体膜电位显著增加(P<0.05)(图6)。
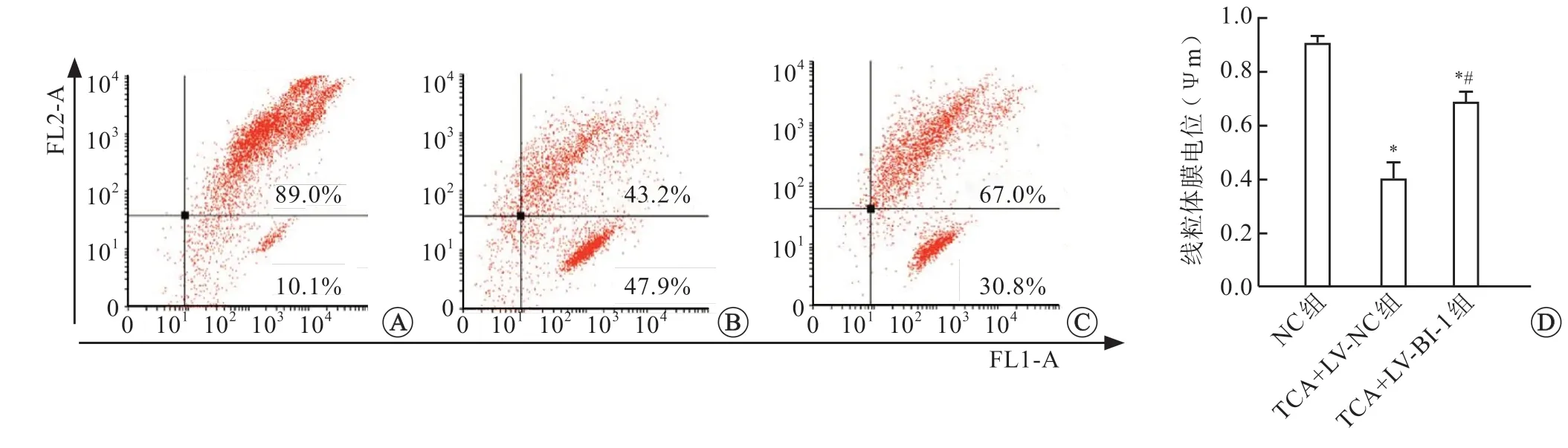
图6 过表达BI-1对TCA诱导的滋养细胞线粒体膜电位的影响
2.7 过表达BI-1对TCA诱导的滋养细胞Cyt-C及凋亡相关蛋白表达的影响
免疫印迹检测过表达BI-1对TCA诱导的HTR8细 胞Bcl-2/Bax比 值、Cyt-C及cleaved caspase-3表达的影响,结果显示,与NC组相比,TCA+LV-NC组和TCA+LV-BI-1组细胞Bcl-2/Bax比值均显著降低(P<0.05),而LV+BI-1组明显高于TCA+LVNC组(P<0.05);TCA+LV-NC组 和TCA+LV-BI-1组细胞中总Cyt-C的表达均显著增加(P<0.05),TCA+LV-BI-1组和TCA+LV-NC组差异无统计学意义(P>0.05);TCA+LV-NC组和TCA+LV-BI-1组细胞线粒体的Cyt-C表达均明显减少(P<0.05),而TCA+LV-BI-1组较TCA+LV-NC组明显增加(P<0.05);TCA+LV-NC组和TCA+LV-BI-1组细胞的cleaved caspase-3显著增加(P<0.05),而TCA+LV-BI-1组较TCA+LV-NC组显著降低(P<0.05)(图7)。
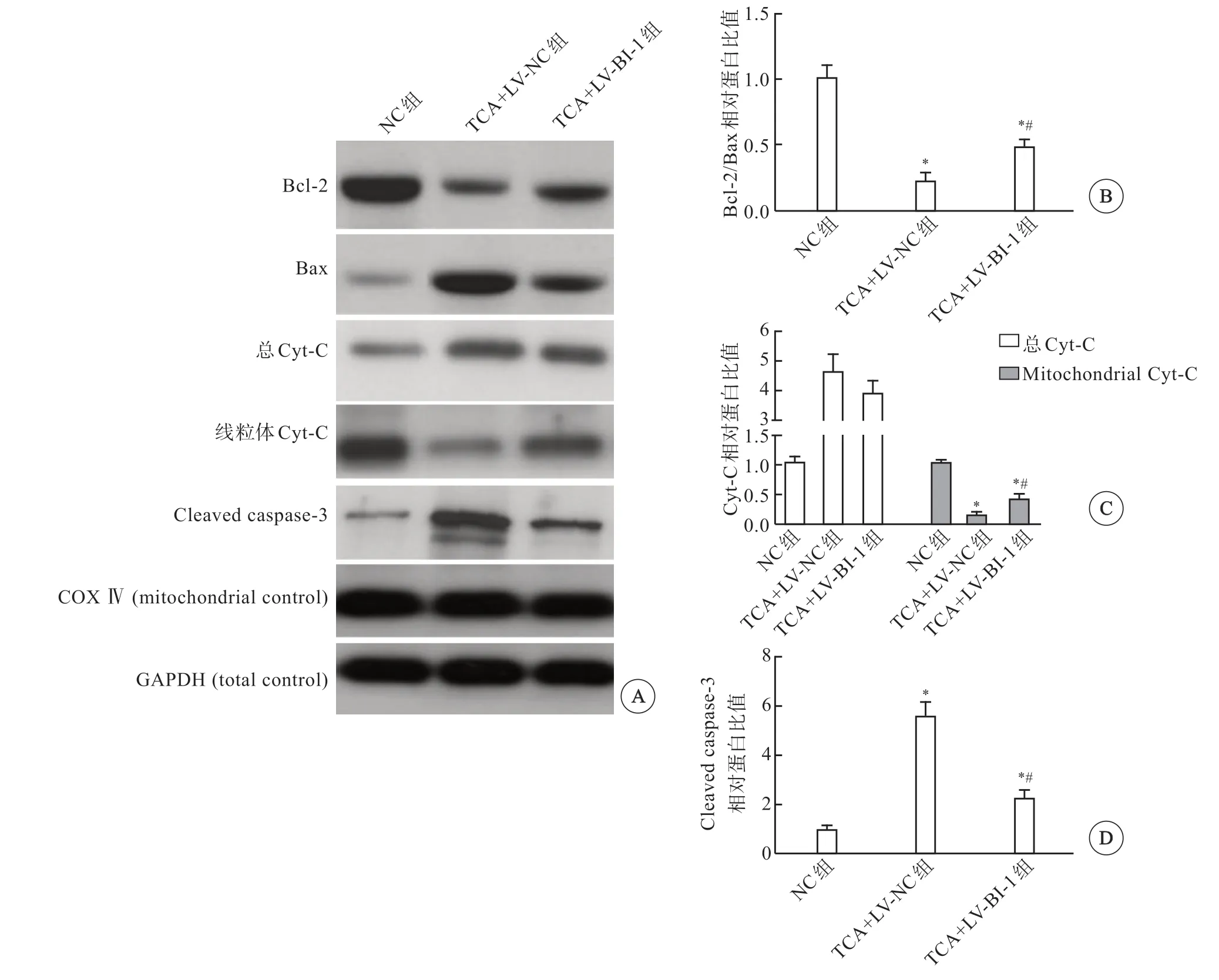
图7 过表达BI-1对TCA诱导的滋养细胞Cyt-C及凋亡相关蛋白表达的影响
3 讨论
高浓度的胆汁酸在体内和体外均诱导ICP患者胎盘组织的多种病理性变化,如合体滋养细胞结节数量的增加及凋亡基因的表达升高[14]。而最近的研究证实高浓度胆汁酸诱导的胎盘滋养细胞凋亡是引起ICP孕妇及胎儿并发症的病理生理机制的核心,其可能与ICP母体中异常增加的胆汁酸诱导滋养细胞过度凋亡,进而破坏胎盘的物质交换及屏障功能,从而增加不良妊娠结局的发生风险相关[2,7]。细胞凋亡主要有2种途径,即通过细胞外信号通路激活的细胞内凋亡酶诱导的凋亡与线粒体释放凋亡激活因子诱导的凋亡,其中线粒体途径凋亡是细胞死亡的主要方式[9]。线粒体不仅是广泛存在于细胞中的一种重要细胞器,也同样是细胞内死亡信号的重要感受器与放大器,在调控细胞凋亡过程中处于关键地位[15]。在正常生理水平下,线粒体处于稳定状态,但当其损伤时,可产生大量超氧化物和活性氧,损伤线粒体正常结构及功能[16]。线粒体膜电位是线粒体在转运物质时,膜间隙因积累大量质子而形成正电荷,但基质内呈负电位,这种现象导致线粒体内膜两侧形成电位差。当线粒体正常结构受到损伤时,外膜通透性增加,进而导致线粒体膜电位逐渐下降直至消失,故线粒体膜电位下降预示线粒体结构及功能的破坏,如若有害刺激持续存在,细胞将启动线粒体凋亡途径[17]。
BI-1是新发现的一种凋亡抑制基因,其蛋白产物能够抑制由Bax、星形孢菌素等引起的凋亡[9]。既往研究显示,BI-1并非与Bax直接作用,而是与抗凋亡蛋白Bcl-2和Bcl-XL相互结合,通过改变其表达,调节BI-1/Bcl-XL/Bcl-2和Bax比值,调控细胞凋亡[8]。同时BI-1还能有效抑制Bax/Bax同源二聚体的形成,从而阻碍其诱导的线粒体内Cyt-C的释放,抑制该途径引起细胞凋亡发生[18-21]。此外,BI-1/Bcl-2二聚体能够与线粒体通透性转换孔的主要组成成分,即外膜电压依赖性离子通道相结合,从而保护线粒体结构及功能的完整,进而维持线粒体膜电位的稳定,发挥其抗凋亡作用[19]。
本研究首先通过免疫组织化学显色显示BI-1在ICP患者胎盘组织中的表达显著低于正常对照组;体外培养滋养细胞系HTR8细胞显示,不同浓度的TCA能显著抑制滋养细胞BI-1 mRNA表达;应用慢病毒成功构建过表达BI-1的滋养细胞,流式细胞术检测证实TCA能够显著促进细胞的凋亡,而过表达BI-1能明显降低细胞的凋亡。为进一步探究BI-1抑制TCA诱导的滋养细胞凋亡机制,应用透射电镜观察不同处理组细胞线粒体超微结构的变化,证实过表达BI-1能明显保护TCA诱导的滋养细胞线粒体损伤,这与BI-1在其他细胞中对不良刺激诱导的线粒体结构损伤的保护作用一致[22]。JC-1流式实验结果表明,过表达BI-1能明显改善TCA诱导的滋养细胞线粒体膜电位降低趋势。免疫印迹检测凋亡相关蛋白显示,过表达BI-1可能是通过改变Bcl-2/Bax比值,抑制线粒体膜电位降低及结构损伤,从而减少细胞Cyt-C的释放,最终降低凋亡蛋白caspase-3活化而发挥上述作用。Cyt-C一般存在于线粒体的内、外膜间隙之间,生理条件下其不能穿过线粒体外膜到达细胞质,而线粒体膜电位的变化及结构损伤时,Cyt-C从线粒体内释放到细胞质中,并作为重要的促凋亡因子,在三磷酸脱氧腺苷的协同作用下与凋亡蛋白酶活化因子-1相互结合,激活caspase-3,启动caspase的级联反应,最终导致细胞凋亡的发生。其中caspase-3是细胞凋亡过程中的关键执行者,它的活化提示凋亡进入不可逆阶段[23-24]。
综上所述,BI-1在ICP患者胎盘组织中显著低表达,而过表达BI-1能够有效降低TCA所诱导的滋养细胞凋亡,其可能作用机制是过表达BI-1通过改变Bcl-2/Bax比值,抑制线粒体膜电位降低及结构损伤,减少线粒体Cyt-C的释放,从而发挥抗凋亡作用。本研究首次报道了BI-1在ICP中的表达及其相关作用,为研究ICP机制提供了新的见解。然而,上述作用机制可能仅仅是一个方面,有关BI-1在ICP的其他作用及机制,尚需进一步研究探讨。