壳三糖胍盐酸盐对胰岛素抵抗细胞模型的改善作用
2021-10-29郑安娜赵梦瑶游江珊潘小旭赵黎明
郑安娜,赵梦瑶,游江珊,潘小旭,赵黎明
(华东理工大学生物工程学院,发酵工业分离提取技术研发中心,生物反应器工程国家重点实验室,上海 200237)
2 型糖尿病是一类糖代谢性紊乱的慢性疾病,以高血糖为主要特征,伴随靶组织的胰岛素抵抗和胰岛细胞的胰岛素分泌相对不足[1−2]。胰岛素抵抗是指机体对胰岛素敏感度降低而无法降低血糖,胰岛β细胞为了克服血糖的升高会分泌更多的胰岛素从而长期处于超负荷状态,最终造成胰岛功能损伤[3−4]。胰岛素抵抗伴随代谢紊乱,产生机制极其复杂,受遗传和环境等多重因素相互影响[5]。从细胞水平上看,胰岛素抵抗的发生主要由于胰岛素作用的靶器官细胞产生缺陷,不能正常利用葡萄糖,从而引起血糖水平升高。从分子水平上看,引起胰岛素抵抗产生的原因主要可分为胰岛素受体前缺陷、受体缺陷以及受体后缺陷[6]。
壳寡糖是一种潜在的食品营养品[7],具有许多优良的生物活性,在食品、医药等行业广泛应用。壳寡糖能有效降低血糖,改善胰岛素抵抗,对糖尿病有一定的干预作用且具有安全性高、作用温和持久等特点[8−11],在降血糖功能食品的开发中具有重要价值。二甲双胍是治疗2 型糖尿病的典型药物[12−13],但其会引起乳酸中毒等不良副反应[14]。壳寡糖胍盐酸盐是指在壳寡糖的氨基上引入二甲双胍的特征结构胍基形成一种糖基胍化合物[15],其对糖尿病具有潜在的改善作用,有望成为一种新型的功能性食品。早在1989 年,Reitz 等[16]合成的含双胍官能团的单糖具有良好的降血糖的活性,近年来也有部分研究表明壳聚糖胍盐酸盐和壳寡糖胍盐酸盐均能有效降低血糖[17−18]。Zhang 等[17]发现壳聚糖双胍盐酸盐能够显著提高胰岛素抵抗HepG2 细胞的葡萄糖消耗量,有效改善HepG2 细胞的胰岛素抵抗情况。王园园等[19]发现壳寡糖胍盐酸盐可改善2 型糖尿病大鼠胰岛素抵抗,调节骨骼肌中胰岛素抵抗相关蛋白的表达,具有良好的应用前景。Wang 等[20]发现壳寡糖胍盐酸盐能够降低L6 骨骼肌细胞中的胰岛素抵抗,显著提高L6 细胞的活力以及促进葡萄糖的吸收。但由于上述研究基本上是基于壳聚糖或壳寡糖混合物的胍基取代物,尚未有单一聚合度特定结构的糖基胍化合物的降糖效果评价和干预机理研究,阻碍了该类糖基衍生物的进一步开发与应用。
本研究以壳三糖胍盐酸盐这一单一聚合度壳寡糖衍生物为对象,初步评价了单一聚合度壳寡糖胍盐酸盐在胰岛素抵抗细胞模型中的改善作用,为开发新型并具有糖尿病辅助干预效果的食品营养品提供理论支持。
1 材料与方法
1.1 材料与仪器
人肝细胞癌细胞系HepG2 上海中国科学院提供;壳三糖 实验室自制,结构式见图1(A),纯度为99.4%、脱乙酰度为100%;壳三糖胍盐酸盐 实验室自制,结构式见图1(B),胍基取代度按照元素分析法进行测定[21],测得实际样品中三种取代度分别为54%、67%、78%;棕榈酸、葡萄糖、二甲基亚砜、四甲基偶氮唑蓝(MTT) 上海泰坦科技股份有限公司;DMEM 高糖培养基、双抗、胰酶 天津灏洋生物制品科技有限责任公司;胎牛血清 美国Gibco 公司;葡萄糖测试盒、糖原测试盒、一氧化氮合成酶(NOS)测定试剂盒 南京建成生物工程研究所。

图1 壳三糖和壳三糖胍盐酸盐结构Fig.1 Structural formulas of chitotriose and chitotriose guanidine hydrochloride
Synergy HF 酶标仪 美国Bio Tek 公司;1379型生物安全柜 美国Thermo Fisher Scientific 公司;H1850R 高速低温离心机 湘仪离心机仪器有限公司;DXS-1 倒置生物显微镜 上海缔纶有限公司。
1.2 实验方法
1.2.1 细胞培养 将HepG2 细胞复苏后,使用含10%胎牛血清的DMEM 培养基并于37 ℃,5%CO2培养箱中进行培养。当细胞贴壁生长至80%以上且生长状态良好时,使用0.25%的胰酶消化传代,并取一定量细胞计数、铺板进行实验。
1.2.2 胰岛素抵抗细胞模型的建立及验证 以葡萄糖(糖)浓度为25、40、60、80、100 mmol/L(不含脂)和棕榈酸(脂)浓度为0.05、0.1、0.2、0.5、1.0 mmol/L(固定糖浓度为25 mmol/L)的培养基分别诱导细胞24 h,采用MTT 比色法测定细胞活力以筛选出安全剂量,接着使用安全剂量的葡萄糖和棕榈酸诱导细胞24 h后测定葡萄糖吸收量以确定建模的最佳诱导浓度,最后使用筛选出的葡萄糖和棕榈酸的浓度诱导细胞24、48、72 h 后,测定葡萄糖吸收量确定建模的最佳诱导时长[22]。在成功建立模型后,分别测定正常组与模型组的葡萄糖吸收量和糖原含量比较其差异以验证胰岛素抵抗细胞模型是否成功建立。
1.2.3 壳三糖胍盐酸盐胍基取代度的筛选 按照
1.2.2 筛选的最佳建模方法进行建模后,设置正常组、模型组、处理组,其中正常组为正常HepG2 细胞且不加样处理,模型组为胰岛素抵抗模型细胞不加样处理,处理组使用浓度为600 μg/mL,胍基取代度分别为54%、67%、78%的壳三糖胍盐酸盐对模型细胞进行干预24 h,测定各组细胞活力和葡萄糖吸收量。
1.2.4 壳三糖胍盐酸盐浓度的筛选 按照1.2.2 筛选的最佳建模方法进行建模后,设置正常组、模型组、处理组,其中处理组使用胍基取代度为78%,浓度分别50、300、600、900、1200 μg/mL的壳三糖胍盐酸盐对模型细胞进行干预24 h,测定各组细胞活力以筛选出安全剂量,接着使用安全剂量的壳三糖胍盐酸盐干预模型细胞24 h,测定各组葡萄糖吸收量。
1.2.5 壳三糖胍盐酸盐对胰岛素抵抗的改善作用按照1.2.2 筛选的最佳建模方法进行建模后,设置正常组、模型组、处理组,其中处理组分别为壳三糖组(600 μg/mL)、壳三糖胍盐酸盐组(600 μg/mL、胍基取代度为78%)、二甲双胍组(600 μg/mL)对模型细胞进行干预24 h,测定各组的葡萄糖吸收量、糖原含量、细胞iNOS 活力。
1.2.6 细胞活力的测定 采用MTT 法测定细胞活力,可以此来评定样品细胞毒性大小。在避光条件下,向待测细胞活力的样本中加入10 μL MTT 溶液后于37 ℃的CO2培养箱中孵育4 h,肉眼可观察到产生蓝紫色沉淀。移除上清液,每组加入100 μL 二甲基亚砜溶解沉淀,待完全溶解后使用酶标仪于570 nm 波长下测定其吸光值。细胞活力比计算见式(1)和式(2)。

1.2.7 葡萄糖含量的测定 葡萄糖的准确测定是诊断糖尿病的依据之一,本研究采用葡萄糖氧化酶-过氧化物酶法进行测定[23−24]。取待测样品1 μL 上清培养基为实验组,并设校准组和空白组,各组均加入100 μL 葡萄糖试剂,37 ℃孵育10 min 后于505 nm处测定各组吸光值,并且测定每组的蛋白含量平衡细胞量差异。葡萄糖吸收量比计算见式(3)和(4)。

式(3)中:5.55 表示校准品浓度,mmol/L;25 表示 DMEM 培养基的糖浓度,mmol/L。
1.2.8 糖原含量的测定 糖原在浓硫酸的催化下和蒽酮反应产生蓝色化合物,其含量可与同法处理的标准葡萄糖液比色确定。将待测糖原样品加一定量碱液沸水浴20 min 后取100 μL 样品作为实验组,并设置标准组和空白组。各组均加入显色液2 mL 并沸水浴5 min,待其冷却后于620 nm 处测定OD 值,并且测定每组的蛋白含量平衡细胞量之间的差异。细胞糖原含量比计算见式(5)和式(6)。

式(5)中:0.01 表示标准品浓度,mg/mL;10 为稀释倍数;1.11 为葡萄糖含量换算。
1.2.9 细胞一氧化氮(iNOS)活力的测定 分子氧在NOS 催化下产生NO,而NO 与亲核性物质形成于530 nm 处有高OD 值的物质。因此可依据OD 值测定细胞NOS 活力。取10 μL 待测细胞iNOS 活力的样品按照NOS 测定试剂盒说明书进行操作加样、混匀。使用酶标仪于530 nm 处测定各组OD 值,并且测定每组的蛋白含量平衡细胞量之间的差异,细胞iNOS 活力计算见式(7)和式(8)。

1.3 数据处理
实验重复三次,设置5 组平行实验,采用SPSS 22.0 软件进行数据处理分析,单因素方差分析法(One-way AVONA)分析比较,Graphpad Prism 8.0软件绘图。
2 结果与分析
2.1 胰岛素抵抗细胞模型的建立及验证
采用高糖高脂诱导HepG2 细胞建立胰岛抵抗细胞模型,建模结果如图2 所示,随着葡萄糖浓度增加,细胞活力下降不明显(图2A),但随着棕榈酸浓度增加,细胞活力持续降低,说明高浓度的棕榈酸会对细胞造成损伤。当棕榈酸浓度大于0.5 mmol/L 时细胞存活率极低,细胞严重损伤(图2B)。因此,选用安全剂量的葡萄糖浓度为25、40、60、80、100 mmol/L,棕榈酸浓度为0.05、0.1、0.2 mmol/L 处理HepG2 细胞一定时间后监测其葡萄糖吸收量,以确定建模的最佳诱导浓度及时间。如图2(C、D、E)所示,葡萄糖和棕榈酸诱导后各组葡萄糖吸收量均有所下降,其中当葡萄糖浓度为40 mmol/L,棕榈酸浓度为0.1 mmol/L时,诱导24 h 后葡萄糖吸收量最小,且与正常组相比差异显著(P<0.05)。因此,选择该条件建立胰岛素抵抗细胞模型。

图2 胰岛素抵抗细胞模型的建立Fig.2 Establishment of the insulin resistance cell model
对该胰岛素抵抗细胞模型进行验证,如图3 所示,和正常组相比,模型组细胞葡萄糖吸收量降低26.3%,糖原含量降低22.9%(P<0.05),表明模型组细胞受损处于糖代谢紊乱的状态[24],成功建立可以用于后续实验的胰岛素抵抗细胞模型。

图3 胰岛素抵抗细胞模型的验证Fig.3 Validation of the insulin resistance cell model
2.2 壳三糖胍盐酸盐的胍基取代度对细胞活力、葡萄糖吸收量的影响
壳三糖是由氨基葡萄糖通过β-1,4 糖苷键连接而成的三糖,因此在胍基取代时取代度可能不同,而壳三糖分子上连接的胍基数量与其生理活性有相关性,故需要探究不同取代度的壳三糖胍盐酸盐对细胞活力和葡萄糖吸收量的影响。如图4(A)所示,不同胍基取代度的壳三糖胍盐酸盐与模型组相比细胞活力没有显著变化(P>0.05),说明其安全性较高,可以用于后续实验。接着进行葡萄糖吸收量的测定,结果如图4(B)所示,三种胍基取代度的壳三糖胍盐酸盐的均能显著提高模型细胞中的葡萄糖吸收量(P<0.05),其中胍基取代度为78%的壳三糖胍盐酸盐效果最佳,说明高胍基含量对葡萄糖吸收量的改善效果更佳。因此,选用胍基取代度为78%的壳三糖胍盐酸盐进行后续实验。

图4 不同胍基取代度的壳三糖胍盐酸盐的筛选Fig.4 Screening of chitotriose guanidine hydrochloride with different degree of substitution of guanidine group
2.3 壳三糖胍盐酸盐的浓度对细胞活力、葡萄糖吸收量的影响
采用MTT 法测定各组的细胞活力,对壳三糖胍盐酸盐的干预浓度进行初步筛选。如图5(A)所示,当壳三糖胍盐酸盐的干预浓度分别为50、300、600 μg/mL 时,与模型组相比细胞活力均没有下降,相反有略微提升,但无显著性差异(P>0.05);当浓度大于900 μg/mL 时,细胞活力显著下降(P<0.05),因此选出干预浓度为50、300、600 μg/mL。接着比较不同干预浓度的壳三糖胍盐酸盐对模型细胞葡萄糖吸收量的改善效果差异(B),当浓度为50 μg/mL 时对模型组的葡萄糖吸收量没有显著性影响(P>0.05),而300、600 μg/mL 能显著提高模型细胞的葡萄糖吸收量(P<0.05),其中600 μg/mL 效果较佳。因此后续研究选用干预浓度为600 μg/mL。

图5 不同浓度的壳三糖胍盐酸盐的筛选Fig.5 Screening of different concentrations of chitotriose guanidine hydrochloride
2.4 壳三糖胍盐酸盐对对胰岛素抵抗的改善作用
2.4.1 壳三糖胍盐酸盐对葡萄糖吸收量的影响 对比壳三糖胍盐酸盐、二甲双胍和壳三糖对胰岛素抵抗细胞模型中葡萄糖吸收量的影响,结果如图6 所示。壳三糖胍盐酸盐组能显著提高葡萄糖吸收量,与模型组相比提升22.8%(P<0.05);且与壳三糖组相比,提升9.0%(P<0.05)。因此,壳三糖胍盐酸盐能提高受损的HepG2 细胞对葡萄糖的吸收量,且比壳三糖效果更佳。前人合成的混合聚合度壳寡糖胍盐酸盐与本研究结果相似,Zhang 等[18]发现壳寡糖胍可通过调控葡萄糖转运蛋白(GLUTs)的表达来控制葡萄糖的摄取,显著降低血糖水平。Wang 等[20]合成了COSG 用于降低L6 骨骼肌细胞中的胰岛素抵抗,发现其能促进细胞对葡萄糖的吸收。
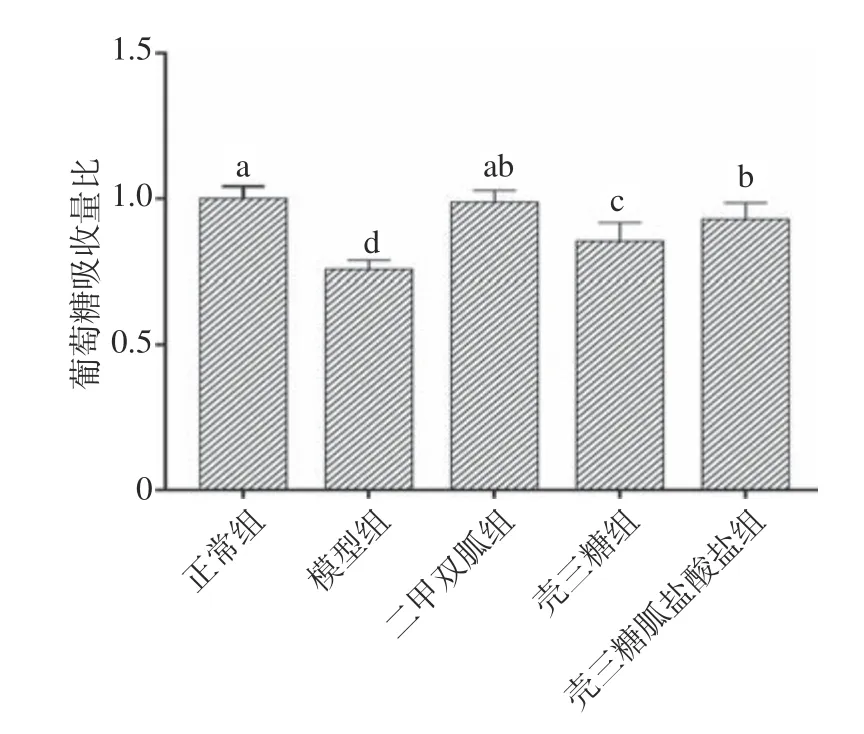
图6 壳三糖胍盐酸盐对葡萄糖吸收量的影响Fig.6 Effect of chitotriose guanide hydrochloride on glucose absorption
2.4.2 壳三糖胍盐酸盐对糖原含量的影响 糖原是机体储存糖的主要形式,对维持血糖的相对稳定极为重要。当血糖较高时,机体各组织均能利用葡萄糖合成糖原以降低血糖;当血糖较低时,肝糖元能分解输出葡萄糖以升高血糖。如图7 所示,壳三糖胍盐酸盐组能显著改善模型细胞的糖代谢紊乱,显著提高糖原含量24.2%(P<0.05),且与壳三糖组相比,提升糖原含量8.4%(P<0.05)。因此,壳三糖胍盐酸盐能改善受损的HepG2 细胞中糖代谢紊乱,减轻高糖高脂引起的糖原含量下降,且比壳三糖作用效果更佳。

图7 壳三糖胍盐酸盐对糖原含量的影响Fig.7 Effect of chitotriose guanide hydrochloride on glycogen content
2.4.3 壳三糖胍盐酸盐对细胞iNOS 活力的影响细胞iNOS 含量往往与炎症相关,可以直接反应机体的氧化应激水平,在整个2 型糖尿病的病理发展过程中起重要作用。如图8 所示,当HepG2 细胞受到高糖高脂诱导后,细胞受损处于氧化应激状态,iNOS活力显著高于正常组水平(P<0.05)。壳三糖胍盐酸盐组能显著降低胰岛素抵抗细胞模型iNOS 活力18.4%(P<0.05),且比壳三糖效果更佳。因此,壳三糖胍盐酸盐能减轻胰岛素抵抗细胞模型细胞的氧化应激。有研究者发现壳聚糖胍盐酸盐(CSGH)是一种优异的抗氧化剂,能调节细胞内氧化还原平衡。Liu 等[21]发现CSGH 清除DPPH 自由基的能力明显优于壳聚糖,而且对氧化损伤的细胞具有优异的修复作用。

图8 壳三糖胍盐酸盐对细胞iNOS 活力的影响Fig.8 Effect of chitotriose guanide hydrochloride on cell iNOS activity
3 结论
利用高糖高脂诱导的胰岛素抵抗细胞模型,评价了壳三糖胍盐酸盐对胰岛素抵抗的改善作用,为开发新型功能食品提供理论依据。结果表明,壳三糖胍盐酸盐对胰岛素抵抗的HepG2 细胞模型具有干预作用,且不同浓度以及胍基取代度具有的干预效果不同。其中600 μg/mL、78%胍基取代度的壳三糖胍盐酸盐的干预效果最佳,能显著提高受损HepG2 细胞对葡萄糖的吸收量,减轻高糖高脂引起的糖原含量下降,降低细胞内iNOS 活力,减轻氧化应激,且干预效果明显优于壳三糖。因此,单一聚合度的壳三糖胍盐酸盐对胰岛素抵抗有一定的改善作用,有望成为具有预防或辅助治疗糖尿病的新型食源性功能产品。但因其改善的作用机制仍不清晰,如何介导胞内信号通路仍需进一步深入探究。
