商业发酵剂中乳酸乳球菌发酵风味特性及其化学表征的研究
2021-10-29公丕民张鸿伟仝令君易华西王亚威刘同杰张兰威
谢 翔,公丕民,刘 奥,张鸿伟,仝令君,易华西,王亚威,刘同杰,,张兰威,
(1.中国海洋大学食品科学与工程学院,山东青岛 266000;2.青岛海关技术中心,山东青岛 266000;3.北京多爱特生物科技有限公司,北京 100000)
目前国内以酸奶为代表的发酵乳风味等品质同质化现象比较严重,已经与营养和品质、个性化需求不断增长形成矛盾[1]。发酵乳是一种经乳酸菌等微生物发酵的乳制品,从特色发酵菌种方面改善发酵乳品质,是改善产品同质化、提升产品特色的重要途径。风味是发酵乳重要的品质特性,虽然常用发酵剂中保加利亚乳杆菌和嗜热链球菌能产生发酵乳中关键的风味物质,但这些风味物质的产量远远不够,目前市面上多采用添加食用香精和其他辅料来满足消费者对不同风味的需求。然而,香精等的风味与天然牛奶发酵香气之间还存在一定的差 距[2]。因此,利用发酵过程本身,通过其他乳酸菌和传统发酵剂结合,生产出风味独特的发酵乳是发酵乳生产的新趋势[3]。已有一些研究揭示了发酵乳中代谢物的形成以及不同乳酸菌对风味化合物的影响[4−5],其中含有四个碳原子的化合物是酸奶的典型香气来源,统称为C4 化合物,包括2,3-丁二酮(双乙酰)、乙偶姻和2,3-丁二醇等[6]。在风味方面,与同型发酵的保加利亚乳杆菌和嗜热链球菌相比,乳酸乳球菌双乙酰变种在代谢糖产生乳酸的同时会产生更多的风味物质[7]。与嗜热链球菌相比,乳酸乳球菌会产生更高含量的2,3-丁二酮和乙偶姻,这两种成分对奶香味有较大贡献,可以改善发酵乳的风味。此外,乳酸乳球菌会产生更多的3-甲基-1-丁醇,与发酵乳中的果香味相关[8]。
乳酸乳球菌凭借其水解蛋白和产生挥发性风味物质的能力,在改善发酵乳制品质地和风味方面发挥巨大作用,广泛应用于干酪、酸奶和酸奶油等乳制品生产[9]。乳酸乳球菌包含4 个亚种,分别是乳酸乳球菌乳酸亚种(Lactococcus lactissubsp.lactis)、乳酸乳球菌乳脂亚种(Lactococcus lactissubsp.cremoris)、乳酸乳球菌霍氏亚种(Lactococcus lactissubsp.hordniae)和Lactococcus lactissubsp.tructae[10]。乳酸乳球菌乳酸亚种的一个变种是乳酸乳球菌双乙酰变种(Lactococcus lactissubsp.lactisvar.diacetylactis)。乳酸乳球菌能够赋予发酵乳制品良好的质地和风味,具有极高的工业和经济价值。在发酵乳制品生产过程中,乳酸乳球菌双乙酰变种能利用柠檬酸代谢生成2,3-丁二酮、二氧化碳和其他物质,赋予发酵乳制品特殊的风味[11]。在奶酪的生产过程中一般包括较长的成熟期,在此期间,牛奶成分会在乳酸乳球菌的作用下转化为决定奶酪口味的各种风味化合物。乳酸乳球菌通过降解乳蛋白以及代谢氨基酸产生挥发性香气成分,在奶酪风味形成中起着核心作用,并且在乳酸乳球菌中已广泛研究了涉及的蛋白质及其表达调控[12]。此外,发酵乳制品的质地特性不仅取决于发酵酸化引起的乳蛋白物理化学特性的变化,还受乳球菌产生的胞外多糖的影响,这些多糖有助于改变发酵乳制品的流变特性[13]。虽然乳酸乳球菌对发酵乳制品有重要的贡献,然而,目前针对乳酸乳球菌不同菌株风味发酵特性、不同风味香型区分的研究较缺乏,阻碍了乳酸乳球菌的精准和高效应用。
GC-IMS 法是近些年出现的风味分析的新技术,与传统的顶空-气相色谱质谱、固相微萃取-气相色谱质谱等方法相比,具有灵敏度高、检测限低、适合痕量组分分析、样品无需前处理、操作方便、检测速度快等优点[14−15],且应用GC-IMS 法得到的数据包括保留时间和漂移时间,是二维的分离,进一步提高了定性分析的准确性。目前GC-IMS 技术在乳制品方面的应用研究较少,尤其是在酸奶风味研究方面。与其他风味分析仪器所不同的是:气相色谱-质谱联用技术用于分析风味化合物的组成,电子鼻用于区分不同乳制品的风味,而GC-IMS 在获得风味化合物组成的同时能区分不同的样品[16]。本研究以各国商业发酵乳发酵剂中分离的乳酸乳球菌为实验对象,研究其在发酵乳中的风味特征,并基于感官评价和风味物质分析,确定其香型和关键风味物质,以期最终应用于特色风味发酵乳的生产。
1 材料与方法
1.1 材料与仪器
发酵剂2-1、2-2、2-3、6-17、6-18 美国杜邦Danisco 公司;发酵剂2-9 丹麦CHR-HANSEN 公司;发酵剂2-13 荷兰DSM 公司;发酵剂9-17 北京多爱特生物科技有限公司;HB0390 M17 琼脂、HB0391 M17 肉汤、HB8800 牛奶培养基、HB0384-1 MRS 肉汤、HB0384 MRS 琼脂 青岛高科园海博生物技术有限公司;全脂乳粉 黑龙江飞鹤乳业有限公司;氯化钠、一水柠檬酸 分析纯,国药集团化学试剂有限公司;5-溴-4-氯-3-吲哚-β-D-半乳糖苷(5-Bromo-4-chloro-3-indolyl-β-D-galactopyranoside,XGal) 上海索莱宝生物科技有限公司;牛奶香精315616 江苏豪蓓特食品有限公司;Kerry chedda cheese flavour c82142-02、Creamcheese 050004 1383T 芬美意香料(中国)有限公司。
iCinac 1710109 乳品发酵酸化监控仪 法国AMS 公司;SW-CJ-1D 型净化工作台 苏州净化设备有限公司;FlavourSpec®气相色谱-离子迁移谱联用仪 德国G.A.S mbH 公司;LDZX-75KBS 型立式压力蒸汽灭菌器 上海申安医疗器械厂;LRH-150F 生化培养箱 上海一恒科学仪器有限公司;HLR-310F 实验室冷藏箱 青岛海尔特种电器有限公司;Multiskan FC 酶标仪 赛默飞世尔科技有限公司;FA2204B 电子天平(d:0.1 mg) 上海天美天平仪器有限公司;YP1002N 电子天平(d:0.01 g) 上海菁海仪器有限公司。
1.2 实验方法
1.2.1 乳酸乳球菌的分离、鉴定
1.2.1.1 乳酸乳球菌的分离 将收集到的发酵剂用12 g/100 mL 已灭菌的牛奶培养基溶解,然后取1 mL溶解液用无菌生理盐水梯度稀释后,涂布于MRS 固体平板上,在30 ℃培养48 h。挑选不同菌落分别进行平板划线至纯菌,显微镜观察细菌形态,挑取在显微镜下形态为球菌的接种到MRS 液体培养基,之后通过生理生化鉴定[17−18]。
1.2.1.2β-半乳糖苷酶活性测试 在灭菌后的MRS 固体培养基中加入0.06 g/L的X-Gal,混匀后倒入培养皿中,将分离菌株在培养皿上划线,30 ℃培养2 d,观察菌落颜色。
1.2.1.3 耐盐性实验 将在X-Gal 培养基上显白色的菌株以2%(v/v)比例接种到含4 g/100 mL NaCl的MRS 液体培养基中,30 ℃培养2 d,观察能否生长。
1.2.1.4 利用柠檬酸产气实验 将在X-Gal 培养基上显白色的菌株以2%(v/v)比例接种到含0.5%(w/v)一水柠檬酸的M17 液体培养基中,30 ℃培养2 d,观察杜氏小管中产气情况。
1.2.1.5 乳酸乳球菌的鉴定 对分离得到的可能为乳酸乳球菌的菌株送生工生物工程(上海)股份有限公司进行16S rRNA 鉴定,将序列在NCBI 网站上进行Blast 比对,选取其中的乳酸乳球菌(Lactococcus lactis)进行后续实验。
1.2.2 乳酸乳球菌生长的测定 将活化好的菌株以2%(v/v)的接种量,接种到装有10 mL 灭菌后的M17 肉汤培养基的试管中,涡旋混匀后取200 μL 加入到无菌96 孔板中,于30 ℃恒温培养箱中培养,间隔2 h 用多功能酶标仪测定OD600nm值,连续测定14 h,每株菌4 个平行,以未接菌M17 培养基为空白。并以生长时间为横坐标,OD600nm为纵坐标,绘制菌株生长曲线[19]。
1.2.3 菌株发酵乳的制备及pH 测定 全脂乳粉以12 g/100 mL的比例溶于50 ℃的蒸馏水中复原,充分溶解之后进行杀菌(95 ℃,10 min)[20],立即冷却至30 ℃后,按2%(v/v)比例接种菌株,30 ℃发酵至pH4.50±0.05 后终止发酵,置于4 ℃后熟44 h,发酵过程中采用iCinac 乳品发酵酸化监控仪对菌株发酵过程中pH 变化和pH 变化率(d pH/d t)进行监测。采集发酵终止样本于4 ℃贮藏备检。
1.2.4 感官评价 7 名接受感官评价培训的成员(6 名女性和1 名男性)对发酵样品进行感官评价。所有的小组成员都熟悉相关风味特征,且要求确定每个发酵乳样品中最突出的香型。取样品10 g 预先密封在50 mL 品尝杯中,室温保存30 min,以使风味成分在顶空平衡[21],感官评价小组成员对于每个样品选出最接近的香型,记为1 分。参比样品的配制由乳酸乳球菌发酵乳加入一定比例香精制得,具体比例如表 1 所示。

表1 参比香型所加入香精比例Table 1 Reference fragrance composition
1.2.5 GC-IMS 测定挥发性风味成分
1.2.5.1 样品准备 准确称取2.0 g 在1.2.3 中制备的发酵乳制品于顶空瓶中,每个样品3 个平行。
1.2.5.2 顶空条件 孵育温度为60 ℃,孵育时间10 min,孵育速度250 r/min;进样速率51 mL/min,进样针温度T3 为65 ℃[22],进样体积500 μL。
1.2.5.3 GC-IMS 条件 色谱柱为FS-SE-54-CB-1 色谱柱(15 m × 0.53 mm,1 μm);IMS 温度T1 为45 ℃[23];柱温T2 为40 ℃[24];漂移气(E1)和载气(E2)均为氮气,纯度为99.999%。色谱洗脱程序:0~20 min 时,E1 恒定为150 mL/min;0~2 min 时,E2的流量为2 mL/min;2~5 min 时,E2的流量由2 mL/min 增大至10 mL/min;5~10 min 时,E2的流量由10 mL/min 增大至50 mL/min;10~20 min 时,E2的流量由50 mL/min 增大至100 mL/min[25]。
1.3 数据处理
所有数据均表示为平均值±标准差的形式。利用工作站Laboratory analytical viewer(LAV)对得到的谱图上的峰进行积分,用GC × IMS library search 参照NIST 数据库和IMS 数据库对物质进行定性分析,之后生成指纹图谱;并用The Unscrambler X 10.4 对谱图上峰的峰强度进行主成分分析(PCA)[26];以挥发性风味物质的峰强度为X 变量,感官评价的得分为Y 变量,用Simca 14.1 进行偏最小二乘回归分析(PLSR)分析并计算变量投影重要性(VIP)值。
2 结果与分析
2.1 乳酸乳球菌分离鉴定与生长特性
2.1.1 菌株分离与鉴定 X-Gal 是β-半乳糖苷酶的显色底物,在后者催化下会产生蓝色底物。因乳酸乳球菌不能表达β-半乳糖苷酶,不能水解X-Gal,故菌落为白色,发酵剂中的其他菌因可以水解X-Gal,菌落为蓝色[27]。
对分离得到的菌株进行革兰氏染色后,在油镜下观察,观察发现:乳酸乳球菌呈紫色,为革兰氏阳性菌株;在油镜下菌体细胞呈圆形或卵圆形,沿长轴方向成链;大多数成对或短链,有些形成长链[17],符合伯杰细菌鉴定手册上对于乳酸乳球菌的描述,初步判定分离得到的菌株为乳酸乳球菌。
经过β-半乳糖苷酶活性测试、耐盐性、利用柠檬酸产气实验得到可能为乳酸乳球菌的菌株,后续进行16S rRNA 测序,将测序结果在NCBI 网站上Blast 显示均为乳酸乳球菌,结果如表 2 所示。根据生理生化表现及发酵剂产品信息判定:菌株2-2-1、6-17-b2、6-18-b2、9-17-b12 是乳酸乳球菌双乙酰变种,菌株2-1-2、2-2-b2、2-2-b12、2-3-a2、2-9-7、2-9-a2、9-17-b3、9-17-b4 是乳酸乳球菌乳酸亚种,菌株2-2-3、2-2-b1、2-2-b4、2-3-a1、2-9-1、2-9-4、2-13-1、2-13-a1、9-17-b11 是乳酸乳球菌乳脂亚种。

表2 乳酸乳球菌的生理生化及其16S rRNA 测序结果Table 2 Physiological and biochemical and 16S rRNA sequencing results of Lactococcus lactis
2.1.2 菌株生长与产酸特性 根据菌株的生长曲线(图 1),在0~2 h,菌株处于生长迟滞期;在2~4 h,处于生长迟滞期和对数期的过渡阶段,繁殖量增长较迟缓期稍大;4~6 h,所有菌株都处于对数期,此时期菌株繁殖较快;在6 h 时,大部分菌株生长都达到稳定期,部分菌株如2-2-b1、2-2-b2、2-2-b12、6-18-b2 对数期持续到8 h,此时进入稳定期,菌株2-3-a1、2-3-a2、6-17-b2、9-17-b12 在10 h 时进入稳定期。

图1 菌株在M17 培养基中30 ℃培养生长曲线Fig.1 Growth curve of strains cultured in M17 medium at 30 ℃
从图 2 可知,在pH4.8~5.6 之间时,多数菌株在此阶段产酸最快。产酸速率整体上呈先增长后下降的趋势,大多数菌株在发酵300~500 min 之间产酸最快,但不同菌株间的产酸速率存在明显的区别,到达发酵终点(pH4.5)的时间在470~800 min不等。

图2 菌株在脱脂乳中pH 变化曲线Fig.2 The pH change curve of the strain in skimmed milk
2.2 发酵乳风味特征的感官评价
如表 3 所示,根据感官评价结果,对单菌株发酵乳进行风味分型,奶香味突出的菌株有12 株,分别为:6-18-b2、2-13-a1、2-13-1、2-9-a2、2-9-1、2-3-a1、9-17-b11、9-17-b4、2-2-3、2-2-b1、2-1-2、2-2-b2;以酪香味为特色的菌株有2 株:9-17-b12、6-17-b2;奶油味的菌株有3 株:2-2-1、2-9-4、2-3-a2。其余4 株菌的发酵乳香型同时具有以上香型中的两种,并无突出香型,难以区分。

表3 菌株风味感官分型结果Table 3 Flavor sensory typing results of strains
2.3 发酵乳GC-IMS 检测挥发性成分分析
对单菌株发酵乳做GC-IMS 检测,谱图中共分离出38 个峰,定性后共有25 种已知成分,7 个同时存在单体和二聚体,6 种未知成分;其中25 种已知成分中,有醇类9 种、酮类8 种、醛类3 种、羧酸1 种、酯4 种。各成分按保留指数排序得表 4。

表4 发酵乳中定性出的成分Table 4 Components in fermented milk

续表 4
赋予酸奶良好风味的主要化合物是2,3-丁二酮、乙偶姻和2-丁酮[28−29]。大多数醇类化合物的风味阈值较高,因此认为醇类化合物对发酵乳的风味影响不大[30]。醛类化合物的阈值较低,对发酵乳风味的形成贡献较大。大多数的酯类化合物的阈值较低,具有果香味或坚果仁味[31]。酮类对发酵乳风味的构成具有重要意义:2,3-丁二酮可以赋予发酵乳浓郁的奶油香味[32],乙偶姻是许多乳制品中常见的风味物质,能赋予发酵乳弱奶油香味[28],它们的阈值很低,微量的2,3-丁二酮和乙偶姻也会对发酵乳的风味产生影响[33]。此外,2-丁酮、2-戊酮、2-庚酮分别呈果香味、甜香味和奶油味[15]。
2.4 特异性指纹图谱
GC-IMS 具有较高的检测灵敏度,基于此可对不同菌株的风味物质进行指纹特征分析,并可辅助用于菌株的判定。将上述38 个峰积分后,用LAV的Gallery Plot 插件生成指纹图谱(图 3)。指纹图谱中可以看出:菌株6-18-b2、6-17-b2、9-17-b12、2-2-1的发酵乳中存在挥发性成分2,3-丁二酮和乙偶姻,而其他菌株发酵乳没检出这两种成分,结合发酵剂说明书及前期生理生化表现,基本可以确定上述四个菌株为乳酸乳球菌双乙酰变种(Lactococcus lactissubsp.lactisvar.diacetylactis)[7]。

图3 菌株发酵乳挥发性成分的指纹图谱Fig.3 Fingerprint of volatile components of fermented milk of strains
同时,发现菌株2-1-2、2-2-1、2-2-3、2-2-b1、2-2-b2、2-2-b4 发酵乳中乙酸乙酯含量高于其他菌株发酵乳,菌株2-3-a2 发酵乳中测得2,3-戊二酮含量较高,在其他菌株发酵剂中较少或几乎不存在,2,3-戊二酮具有奶油、焦糖香气,并带有坚果底香,而低含量的乙酸乙酯具有清灵、微带果香的酒香[25]。在所有发酵乳样品中均存在的挥发性风味成分有:异丙醇、正丙醇、2-丁酮、乙酸乙酯、2-戊酮、戊醛、1-戊醇、正己醛、2,3-丁二醇、正己醇、2-庚酮,这些成分在之前的发酵乳相关研究中已被检测出[15,34−36],可能是发酵乳中较为基本的成分。正己醛呈青草味,1-戊醇呈辣味,并伴有酒味[15],2,3-丁二醇是乙偶姻的还原形式,对奶油或黄油味的贡献有限[3]。
2.5 主成分分析
用LAV的Simca PCA 插件和计量分析软件The Unscrambler X 10.4 对21 株菌的挥发性成分进行主成分分析。用Min-Max 法对原始数据进行标准化,将峰强度数值映射到0~1000 之间。结果发现:前两个主成分解释69%的差异,前四个主成分解释了82%的差异。从图 4 中可以看出:在主成分1 方向上,菌株6-18-b2、6-17-b2、9-17-b12、2-2-1 和其他菌株可以明显区分;在主成分2 方向上,这四株菌可分为三类:菌株6-18-b2 为一类,菌株6-17-b2 和9-17-b12 为第二类,菌株2-2-1 为第三类,分类情况与感官评价结果表现一致。

图4 二十一株菌发酵乳PCA 图Fig.4 Principal component analysis diagram of fermented milk
通过比对PCA 图和载荷图(图 5),可以得出:主成分1 与乙偶姻、3-甲基-1-丁醇、丁酸甲酯、2,3-丁二酮、2-甲基丙酸乙酯、2,3-戊二酮、正丁醇、正丁醛、2-甲基丙醇、丁酸乙酯、羟丙酮、2,3-丁二醇、芳樟醇、戊醛、乙酸乙酯、2-戊酮、异丙醇呈正相关,与1-戊醇、正己醛、正己醇、正丙醇、丁基甲基酮、2-丁酮呈负相关。主成分2 与2-戊酮、正己醇、2-庚酮、芳樟醇、2-甲基丙醇、戊醛、2,3-戊二酮、3-甲基-1-丁醇、2,3-丁二酮、1-戊醇、乙偶姻、2,3-丁二醇、正己醛、丁酸甲酯、正丁醇呈负相关,与乙酸乙酯、羟丙酮、正丁醛、丁酸、异丙醇、2-丁酮、正丙醇、丁酸乙酯、2-甲基丙酸乙酯、丁基甲基酮呈正相关。

图5 载荷图Fig.5 Loading diagram
对菌株6-18-b2、6-17-b2、9-17-b12、2-2-1 进一步做PCA 分析如图 6 所示。因为这四株菌均为乳酸乳球菌双乙酰变种,所以此类菌株发酵产生的标志性成分2,3-丁二酮和双乙酰在上述四株菌的发酵乳中均有检测到,这是他们的共同点。此外,结合图 7载荷图,可以得出:以菌株2-2-1 为代表的奶油味,乙酸乙酯、丁酸对此香型贡献较大;以6-18-b2 为代表的奶香味,2-戊酮、戊醛、2,3-戊二酮、3-甲基-1-丁醇对此香型贡献较大;以6-17-b2 和9-17-b12 为代表的酪香味,正己醛、正己醇、2-丁酮对此香型贡献较大。

图6 四株菌发酵乳的PCA 图Fig.6 Principal component analysis diagram of fermented milk of four strains
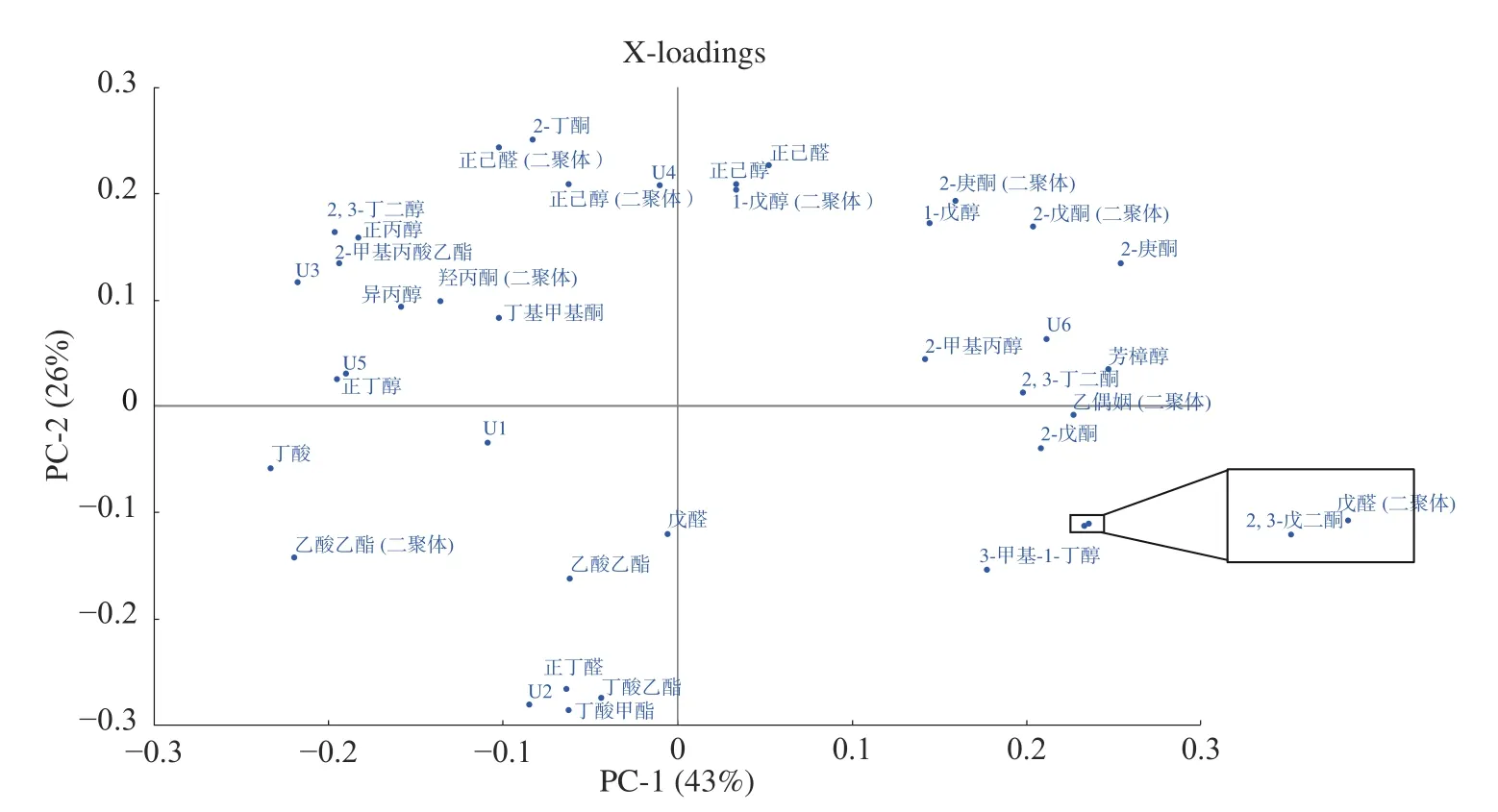
图7 四株菌发酵乳载荷图Fig.7 Loading diagram of four strains fermented milk
2.6 PLSR 分析感官香型与风味成分的关系
为了探究感官评价分型和挥发性风味物质的关系,以挥发性风味物质的峰强度为X 变量,感官评价的得分为Y 变量,对菌株6-18-b2、6-17-b2、9-17-b12、2-2-1 进行偏最小二乘回归分析。结果如图 8所示,可以看出:奶香味与戊醛、2-戊酮、2,3-戊二酮、2,3-丁二酮、乙偶姻、3-甲基-1-丁醇等物质联系较大,已有研究中也发现2,3-丁二酮赋予发酵乳奶香味[37];奶油味与乙酸乙酯和丁酸联系较大;酪香味与正己醛、正己醇、1-戊醇联系较大。乙酸乙酯可以带来更多的果味和奶油味[38]。
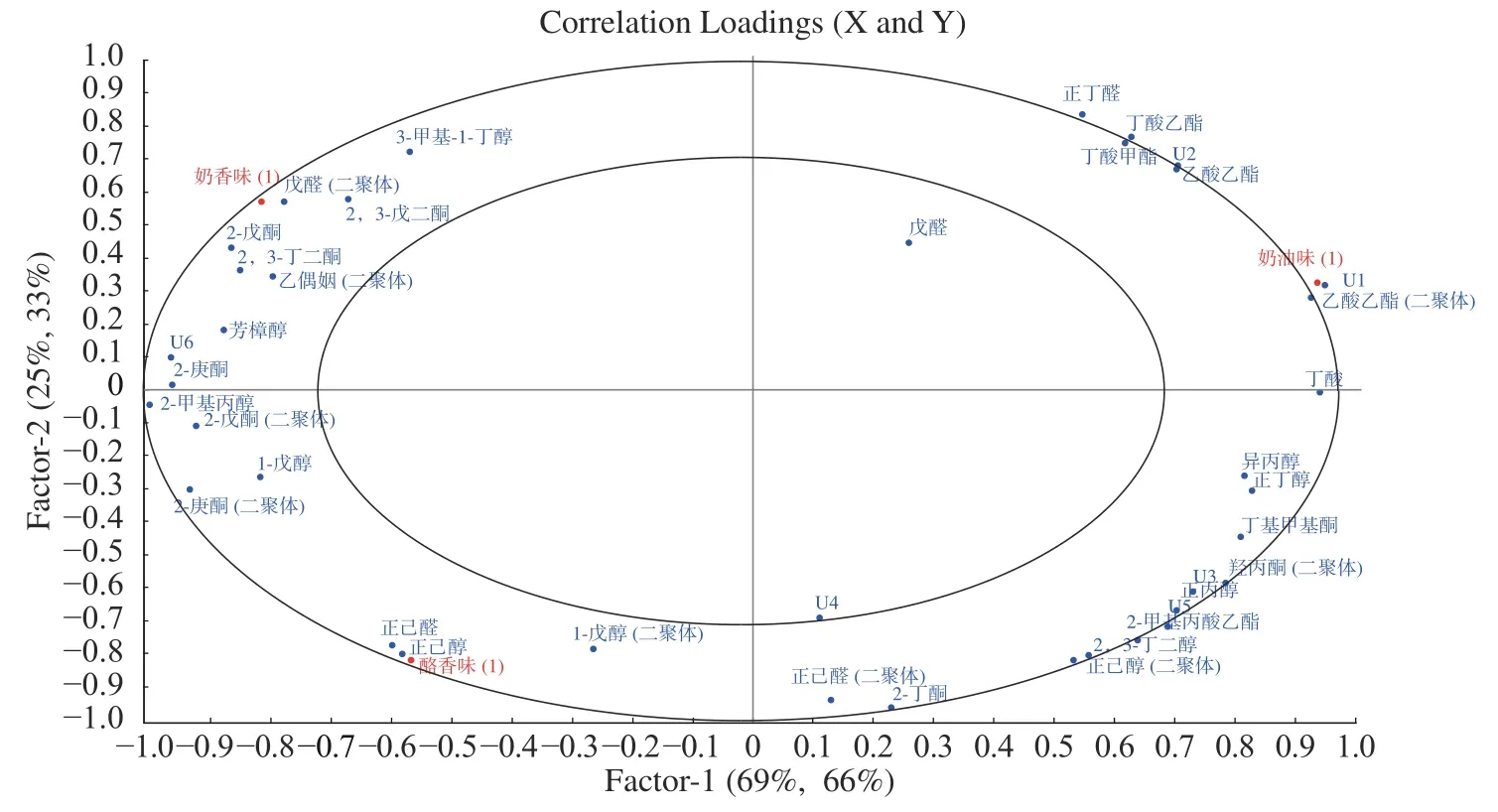
图8 感官分型与挥发性成分的PLSR 图Fig.8 Sensory classification and partial least squares regression analysis diagram of volatile components
进一步根据VIP 值(Variable Importance in Projection)估计PLS 投影中每个变量的重要性,VIP>1的变量与解释Y 变量最相关,因此,从图 9 可以得出,据VIP 值对发酵乳的风味影响较大的风味成分有:乙酸乙酯、正己醛、正丁醛、正己醇、丁酸乙酯、2-甲基丙醇、丁酸甲酯、2-庚酮、2-丁酮。
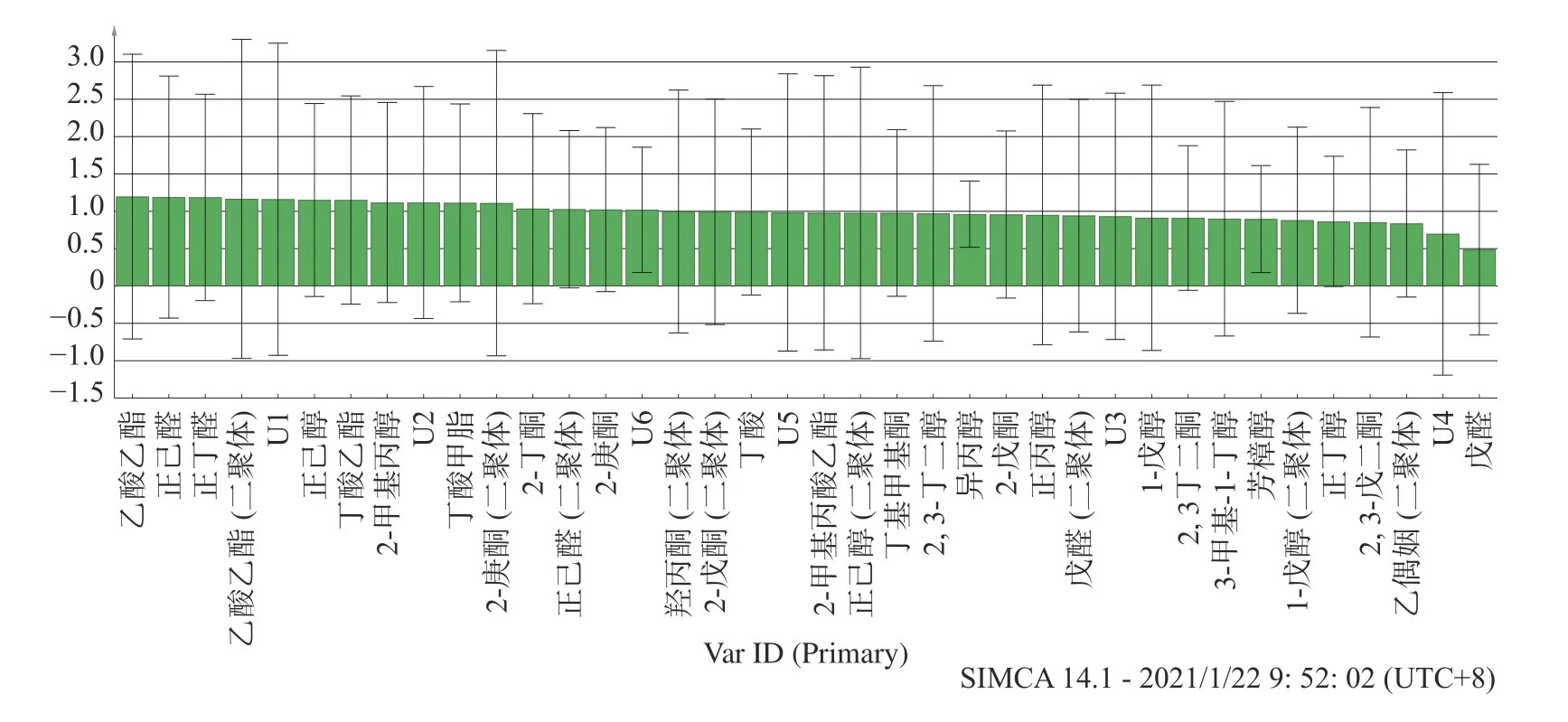
图9 风味物质的VIP 图Fig.9 Variable importance in projection of flavor substances
综合PLSR 结果和VIP 值来看,对酪香味影响比较大的成分有正己醛、正己醇;对奶油味影响较大的成分有乙酸乙酯;而各成分对于奶香味的影响都不是很重要,因此对奶香味影响较大的成分还需要进一步研究确定。
3 讨论与结论
从8 种商业发酵剂中分离得到21 株乳酸乳球菌,单独发酵复原乳的感官风味可以明显划分为奶香味、奶油味、酪香味三个香型。采用GC-IMS 检测并经PLSR 对香味分型和挥发性成分的相关性进行分析,确定对酪香味影响比较大的挥发性风味成分有正己醛、正己醇;对奶油味影响较大的成分有乙酸乙酯;奶香味虽然与戊醛、2-戊酮、2,3-戊二酮、2,3-丁二酮、乙偶姻、3-甲基-1-丁醇等物质联系较大,但是
关键性成分仍需进一步确认。本文的研究表明可以通过添加特定香型的乳酸乳球菌菌株辅助发酵,有目地改善发酵乳风味,解决发酵乳同质化现象。同时,在确定对各香型影响较大的挥发性风味成分后,锚定这些关键基因,并进行调控,预期可进一步提升乳制品风味品质。
