不同蕨菜制品醇提物体外抗氧化及降血糖活性研究
2021-10-29李榕娣庄远杯魏爱红钟婉如张声源
李榕娣,庄远杯,魏爱红,钟婉如,张 超,张 勇,张声源,
(1.嘉应学院广东省山区特色农业资源保护与精准利用重点实验室,广东梅州 514015;2.嘉应学院医学院客家药用生物资源研究所,广东梅州 514031)
蕨菜为乌毛蕨科乌毛蕨属乌毛蕨(Blechnum orientaleL.)的嫩芽,又名拳头菜、龙头菜,分布于中国各地[1]。蕨菜全草入药,用于清热利湿、消肿、利水、安神等功效[2]。现代药学研究表明,蕨菜含有许多黄酮类、藏素类、苯甲酸类等成分[3]。其中,黄酮为其主要有效成分,具有降血脂、抗过敏、增强机体免疫力、抗肿瘤等药理活性[4]。然而,关于抗氧化活性的研究多局限于采用单一加工处理方式的蕨菜粗提物,对不同加工处理方式蕨菜的抗氧化和降血糖活性与组分相关性研究未见报道,目标成分不明确。民间即食蕨菜不同加工处理方式主要有两种:一是加1%的食盐沸水热烫杀青,脆化冷却,盐水浸泡出售(湿品);二是经1%的食盐沸水热烫,脆化冷却,自然晒干(干品)[5]。研究显示,不同加工处理过程对蕨菜成分含量影响较大,其中经过加工处理的蕨菜中原蕨苷、维生素C 含量明显低于新鲜蕨菜[6−7],但针对不同加工处理方式蕨菜的总酚、总黄酮成分含量及抗氧化、降血糖活性比较研究未见报道。
糖尿病(Diabetes Mellitus,DM)已严重威胁人体健康,2019 年全球约4.63 亿20~79 岁成人患糖尿病,预计到2030 年,糖尿病患者会达到5.784 亿,呈高度流行态势[8−9]。α-葡萄糖苷酶位于小肠刷状缘,是降低餐后血糖的有效分子靶标,抑制其活性可显著延缓体内葡萄糖的吸收,降低血糖水平[10]。研究表明,持续高血糖水平引起的氧化应激反应可促进动脉粥样硬化等糖尿病并发症的形成[11],减少自由基的产生或直接淬灭体内产生的自由基是预防和治疗糖尿病及其并发症的有效手段[12]。目前临床广泛运用的抗氧化剂及α-葡萄糖苷酶抑制剂存在毒副作用,如阿卡波糖引起胀气、腹部不适、排气等胃肠道不良反应[13−14]。天然产物降糖作用具有多途径、多靶点的药理特点,作用温和持久、毒副作用小,可有效减轻糖尿病的症状并延缓并发症的发生和发展[15]。从可食用的天然产物中寻找安全、有效、且同时具有α-葡萄糖苷酶抑制活性和抗氧化活性的药物已成为研究热点。
为明确蕨菜的食用及药用价值,实验测定三种不同蕨菜95%乙醇提取物的总酚、总黄酮的含量差异,测定抗氧化活性、体外α-葡萄糖苷酶抑制活性、体外α-淀粉酶抑制活性,并对总酚、总黄酮含量与生物活性进行了相关性分析,为蕨菜的进一步研究和开发利用提供实验依据。
1 材料与方法
1.1 材料与仪器
蕨菜 2019 年2~3 月采于广东省梅州市大埔县,经嘉应学院医学院张声源副教授鉴定为乌毛蕨科(Blechnaceae)的乌毛蕨(Blechnum orientale L.)的嫩芽;α-葡萄糖苷酶(G5003-100U)、α-淀粉酶(A3176-500KU) sigma 公司;对-硝基苯基-α-D-吡喃葡萄糖苷(pNPG)、对硝基苯酚(pNP) 上海源叶科技有限公司;阿卡波糖 德国拜耳公司;3,5-二硝基水杨酸(DNS) 国药集团化学试剂有限公司;葡萄糖 西陇科学股份有限公司;丙三醇 天津市富宇精细化工有限公司;可溶性淀粉 天津市大茂化学试剂厂;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺)二氨盐(ABTS)、NaH2PO4·2H2O、Na2HPO4·12H2O、FeSO4·7H2O、水杨酸、K3[Fe(CN)6]、三氯化铁、三氯乙酸、维生素C(Vc)、亚硝酸钠 上海阿拉丁生化科技股份有限公司;硝酸铝 天津市科密欧化学试剂有限公司;没食子酸 分析纯,上海金穗生物科技有限公司;芦丁
分析纯,成都昂赛思生物科技有限公司;甲醇、乙腈 色谱纯,fisher scientific 公司。
Alliance 2695 型高效液相色谱仪、XBridge Peptide BEH C18色谱柱(250 mm× 4.6 mm,5 μm)沃特世科技(上海)有限公司;UV-1800 型紫外-可见分光光度计 日本岛津公司;MING-CHE 24ΜV 型超纯水机 法国Merck Millipore 公司;PB-21 型酸度计 北京赛多利斯科学仪器有限公司;N-1100V 型旋转蒸发仪 上海爱朗仪器有限公司;FA2004 型电子分析天平、BS110s 型电子分析天平德国Sartorius 公司;WJX-A1000 型高速多功能粉碎机 浙江省永康市红太阳机电有限公司;JP-100S 型超声波清洗器 深圳市洁盟清洗设备有限公;GL-25M 型离心机 上海赵迪生物科技有限公司;XW-80A 型旋涡混合器 上海精科实业有限公司;TGL16MC 型台式高速冷冻离心机 长沙湘锐离心机有限公司;数显HH-6 系列恒温水浴锅 金坛市国旺实验仪器厂。
1.2 实验方法
1.2.1 不同蕨菜醇提取物的制备 参考文献[5],a.鲜品(新鲜采摘的蕨菜);b.湿品(加1%的食盐沸水热烫、杀青);c.干品(经1%的食盐沸水热烫、杀青,再自然晒干);取上述三种供试品各2.0 kg,切碎,分别加10 L的95%乙醇浸泡12 h,超声辅助提取30 min(温度设为40 ℃,200 W,40 kHz)、过滤,重复上述操作2 次,合并三次滤液,浓缩得浸膏,得到鲜品浸膏210 g(得率10.5%,得率(%)=(浸膏质量/2000)×100,下同)、湿品浸膏196 g(得率9.8%)、干品浸膏228 g(得率11.43%),放置于冰箱4 ℃冷藏,备用。样品使用前加磷酸缓冲溶液(PBS,0.067 mol/L,pH6.8)溶解制备成不同质量浓度的溶液,质量浓度均以提取物计。
1.2.2 硝酸铝法测定总黄酮含量
1.2.2.1 芦丁标准曲线的制备 参考文献[16−17],精密称取干燥至恒重的芦丁对照品20 mg,用95%乙醇溶解并定容至100 mL的容量瓶中,摇匀,得质量浓度为0.2 mg/mL的芦丁对照品标准溶液,按浓度梯度配制成最终质量浓度为0.028、0.056、0.084、0.112、0.140 mg/mL的芦丁对照品标准溶液。分别精密移取不同质量浓度梯度芦丁对照品标准溶液7 mL,依次加入5%亚硝酸钠溶液1 mL,震荡摇匀,放置4 min,加入10 % Al(NO3)3溶液1 mL,摇匀,放置4 min,加入4%氢氧化钠试液10 mL,再加蒸馏水至刻度,充分摇匀,放置10 min,以95%的乙醇和显色试剂为空白,按照紫外-可见分光光度法,在波长为500 nm 处测定吸光度。吸收度(A)与其质量浓度(C,mg/mL)用最小二乘法求得回归方程。
1.2.2.2 总黄酮含量的测定 分别精确移取待测样品溶液3 mL,按照 “1.2.2.1”项的实验方法于500 nm处测定其吸光度,以PBS 代替待测样品为空白对照。每组实验平行测定3 次。各提取物的总黄酮含量参考芦丁(rutin,RT)标准曲线用芦丁当量(每克干样品中黄酮类化合物相当于芦丁的毫克数,mg/g)表示,根据公式(1)计算。每个提取物平行测定3 次。

式中:c 为待测样品稀释后的总黄酮浓度,由标准曲线拟合得出,mg/mL;v 为各待测样品提取液总体积,mL;k 为待测样品提取液稀释倍数;m 为蕨菜粉末质量,g。
1.2.3 福林酚法测定总酚含量
1.2.3.1 没食子酸标准曲线的制备 参考文献[18−19],精确称取干燥至恒重的没食子酸标准品20 mg,用蒸馏水溶解并定容于100 mL 棕色量瓶中,得质量浓度为0.2 mg/mL 没食子酸标准液。分别精密移取没食子酸标准溶液0.0、0.1、0.2、0.3、0.4、0.5 mL 置于6 个10 mL 棕色具塞比色管中,依次加入6 mL>蒸馏水,0.5 mL 福林试剂,充分摇匀,室温避光静置2 min,再加2 mL 7.5%碳酸钠溶液,用蒸馏水定容至刻度,40 ℃水浴10 min,最后25 ℃水浴暗置60 min。得没食子酸质量浓度分别为0、2、4、6、8、10 μg/mL的标准溶液,在760 nm 波长处测定其各吸光度。吸收度(A)与其浓度(C,μg/mL)用最小二乘法求得回归方程。
1.2.3.2 不同加工方法蕨菜总酚含量的测定 分别精确移取待测样品溶液10 mL,按照“1.2.3.1”项的实验方法于760 nm 处测定其吸光度,以PBS 代替待测样品为空白对照。每组实验平行测定3 次。各提取物的总酚含量参考没食子酸(gallic acid,GA)标准曲线用没食子酸当量(每克干样品中酚类化合物相当于没食子酸的毫克数,mg/g)表示,根据公式(2)计算。每个提取物平行测定3 次。

式中:c 为待测样品稀释后的总酚浓度,由标准曲线拟合得出,mg/mL;v 为各待测样品提取液总体积,mL;k 为待测样品提取液稀释倍数;m 为蕨菜粉末质量,g。
1.2.4 抗氧化活性测定
1.2.4.1 清除DPPH 自由基活性测定 参考文献[20−21],稍作改进。分别精密移取2.0 mL 不同质量浓度被试样品(不同加工方式蕨菜质量浓度均为:50.0、25.0、12.5、6.25、3.125 μg/mL;Vc 为:17.0、12.0、8.1、5.6、4.0 μg/mL)于10 mL 试管中,分别加入0.15 mmoL/L DPPH 溶液2.0 mL,室温避光静置20 min,于波长517 nm 处测定吸光度(Ai);同时测定2.0 mL DPPH溶液与2.0 mL 甲醇混合后在波长517 nm 处的吸光度(A0);测定2.0 mL 甲醇与2.0 mL 样品溶液在波长517 nm 处的吸光度(Aj);每组平行测定3 次,以抗坏血酸作为阳性对照。根据公式(3)计算出DPPH 自由基的清除率。

1.2.4.2 清除ABTS 自由基活性测定 参考文献[22−23],稍作改进。将7.0 mmoL/L的ABTS 溶液与2.45 mmoL/L 过硫酸钾溶液等体积混合,室温避光静置12~16 h,制备ABTS 自由基母液。10 mmoL/L(pH7.4)磷酸缓冲溶液将ABTS 自由基母液稀释,使其在波长734 nm 处吸光度达到(0.70±0.02)。分别将0.1 mL 不同质量浓度被试样品(不同加工方式蕨菜质量浓度均为:0.5、0.25、0.125、0.0625、0.03125 mg/mL;Vc 为:0.15、0.12、0.096、0.049、0.039 mg/mL)加入3.9 mL ABTS 自由基溶液中,振荡30 s 后室温静置10 min,于波长734 nm 处测量吸光度(Ai);同时测定3.9 mL ABTS 自由基溶液与0.1 mL 甲醇溶液混合后在波长734 nm 处的吸光度(A0);测定3.9 mL(10 mmoL/L;pH7.4)磷酸缓冲溶液与1.0 mL 样品溶液在波长734 nm 处的吸光度(Aj);每组平行测定3 次,以抗坏血酸作为阳性对照。根据公式(4)计算出ABTS 自由基的清除率。
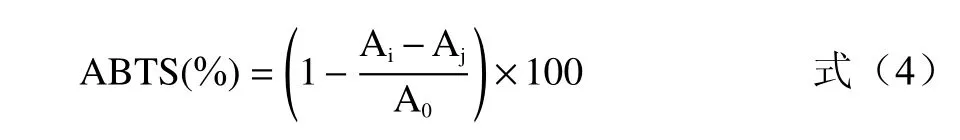
1.2.4.3 对Fe3+还原能力测定 参考文献[24],稍作改进。取各不同质量浓度被试样品(不同加工方式蕨菜质量浓度均为:90.0、80.0、70.0、60.0、50.0 μg/mL;Vc 为:36.0、24.0、16.0、12.0、8.0 μg/mL)2.5 mL,加入2.0 mol/L(pH6.8)的磷酸缓冲液2.5 mL 及1%的铁氰化钾溶液2.5 mL,摇匀后置于50 ℃恒温水浴锅中加热反应20 min,急速冷却后加入10%的三氯乙酸溶液2.5 mL,充分混匀,于4000 r/min 离心10 min,取上清液2.5 mL,依次加入2.0 mL 蒸馏水与0.5 mL FeCl3溶液混合均匀,于700 nm 处测定此反应体系的吸光值(Ai)。以 2.5 mL的蒸馏水代替不同浓度的试样品于在700 nm 处测得空白吸光值(A0)。不同质量浓度的Vc 标准溶液重复上述操作,以吸光度为纵坐标(Y),Vc 溶液浓度(μmol/mL)为横坐标(X),绘制标准曲线。每组平行测定3 次,铁还原力大小用每克样品的Vc 当量表示(μmol Vc/g)。
1.2.5 体外降血糖活性评价
1.2.5.1 对α-葡萄糖苷酶抑制活性的测定 参考文献[25],稍作改进。精密吸取0.067 mol/L(pH6.8)的磷酸盐缓冲溶液250 μL 于试管中、加入被试样品50 μL、0.1 U/mLα-葡萄糖苷酶300 μL,混匀,37 ℃恒温水浴20 min,加入4.0 mmol/L pNPG 200 uL,混匀,37 ℃恒温反应60 min,加入甲醇800 μL 终止反应,0.45 μm 微孔滤膜过滤,用HPLC 检测pNP,每组平行三次,以阿卡波糖为阳性对照。根据公式(5)计算酵母菌源α-葡萄糖苷酶的抑制率。

式中:Ao为缓冲液+酶液+底物反应后的pNP 峰面积;Ai:样品+酶液+底物反应后的pNP 峰面积;Aj:样品+缓冲液+底物反应后的pNP 峰面积。
色谱条件:色谱柱为XBridge Peptide BEH C18柱(5 μm,4.6 mm×250 mm);流动相:乙腈(A 液),0.1%甲酸水溶液(B 液)。梯度洗脱条件为:0~8 min,20%~30% A 液;8~13 min,30%~80%A 液;13~15 min,80%~20% A 液;15~25 min,20%A 液;进样量:10 μL;流速:1.0 mL/min;柱温:35 ℃;检测波长:315 nm。
1.2.5.2 对α-淀粉酶抑制活性的测定 参考文献[26−27],稍作改进。精密吸取被试样品0.3 mL,加0.3 mLα-淀粉酶溶液,混匀,于37 ℃水浴孵育5 min,加入0.3 mL 在 37 ℃水浴中同时预温5 min的1%可溶性淀粉溶液,混匀,反应15 min,立即加入0.5 mL DNS,煮沸5 min,随后于冰水中静置20 min,0.067 mol/L(pH6.8)磷酸缓冲溶液定容至5 mL,540 nm 下测吸光值,每组平行三次,以阿卡波糖为阳性对照。根据公式(6)计算α-淀粉酶抑制率。

式中:A0为样品溶液+酶溶液+PBS 溶液反应体系的吸光度值;Ab为酶溶液+PBS 溶液反应体系的吸光度值;Ai为样品溶液+酶溶液+淀粉溶液反应体系的吸光度值;Aj为样品溶液+PBS+淀粉溶液反应体系的吸光度值。
1.3 数据统计分析
实验重复3 次,采用Origin 8.5 软件进行数据处理,结果以平均值±标准差()表示,并得到相应的半数抑制浓度(IC50)。利用单因素方差分析和Duncan 法检验多组数据间差异的显著性(P<0.05 显著相关;P<0.01 极显著相关)。
2 结果与分析
2.1 总黄酮和总酚含量
芦丁的标准曲线如图1 所示,曲线的线性拟合方程Y=13.638X–0.033,R2=0.999,线性良好。

图1 芦丁标准曲线Fig.1 Rutin standard curve
没食子酸的标准曲线如图2 所示,曲线的线性拟合方程Y=0.1056X+0.0257,R2=0.997,线性良好。

图2 没食子酸标准曲线Fig.2 Gallic acid standard curve
由表1 可知,不同蕨菜的总黄酮、总酚含量大小依次为鲜品>湿品>干品,差异显著(P<0.05),表明经过食盐水热汤加工处理后的湿品和干品蕨菜总酚和总黄酮含量低,这可能与酚类和黄酮类中的羟基受热不稳定性有关,研究显示经过热烫后的酚类物质含量下降达到约60%[28]。其中鲜品总黄酮含量高达(156.75±1.28)mg RT/g,鲜品总酚含量高达(593±3.45)mg GA/g,该结果与陈乃东等[29]的研究结果一致。
表1 不同蕨菜醇提物总黄酮、总酚含量(,n=3)Table 1 Total flavonoid,polyphenol contents of different processing products from Blechnum orientale L.(,n=3)

表1 不同蕨菜醇提物总黄酮、总酚含量(,n=3)Table 1 Total flavonoid,polyphenol contents of different processing products from Blechnum orientale L.(,n=3)
注:同行肩标字母不同表示差异显著(P<0.05),表2~表5同。
2.2 抗氧化评价
2.2.1 DPPH 自由基清除作用 对DPPH 自由基清除作用由图3、表2 可知,不同蕨菜醇提取物对DPPH 自由基均具有一定程度的清除作用,清除率随质量浓度的增大而增大,呈一定的量效关系。IC50值大小依次为蕨菜干品>湿品>鲜品>Vc,差异显著(P<0.05)。IC50值越小,对自由基的清除能力越强。表明蕨菜鲜品对DPPH 自由基的清除能力最强,其IC50=(17.01±0.022)μg/mL,在质量浓度为50.0 μg/mL时清除率可达97.28%。

图3 不同蕨菜醇提取物对DPPH 自由基的清除作用Fig.3 Effect of different processing products from Blechnum orientale L. on scavenging rate for DPPH radical
表2 不同蕨菜醇提取物对DPPH 自由基清除作用的IC50 值(,n=3)Table 2 IC50 values of different processing products from Blechnum orientale L.on scavenging rate for DPPH radical (,n=3)

表2 不同蕨菜醇提取物对DPPH 自由基清除作用的IC50 值(,n=3)Table 2 IC50 values of different processing products from Blechnum orientale L.on scavenging rate for DPPH radical (,n=3)
2.2.2 ABTS 自由基清除作用 对ABTS 自由基清除作用由图4、表3 可知,不同蕨菜醇提取物对ABTS 自由基均具有一定程度的清除作用,清除率随质量浓度的增大而增大,呈一定的量效关系。IC50值大小依次为蕨菜干品>湿品>鲜品>Vc,差异显著(P<0.05)。表明蕨菜鲜品对ABTS 自由基的清除能力最强,其IC50=(0.20±0.001)mg/mL,在质量浓度为0.5 mg/mL 时最高清除率可达99.59%。

图4 不同蕨菜醇提取物对ABTS 自由基的清除作用Fig.4 Effect of different processing products from Blechnum orientale L. on scavenging rate for ABTS radical
表3 不同蕨菜醇提取物对ABTS 自由基清除作用的IC50 值(,n=3)Table 3 IC50 values of different processing products from Blechnum orientale L.on scavenging rate for ABTS radical (,n=3)

表3 不同蕨菜醇提取物对ABTS 自由基清除作用的IC50 值(,n=3)Table 3 IC50 values of different processing products from Blechnum orientale L.on scavenging rate for ABTS radical (,n=3)
2.2.3 Fe3+还原能力 对Fe3+还原能力由图5 可知,不同蕨菜醇提取物均具有一定的Fe3+还原能力,还原能力大小依次为鲜品>湿品>干品,其Vc 当量分别为(1427.77±1.36)、(1218.24±0.25)、(340.68±2.45)μmol Vc/g,差异显著(P<0.05)。

图5 蕨菜不同加工品对Fe 3+ 还原能力的影响Fig.5 Effect of different processing products from Blechnum orientale L.on reducing ferric
综合DPPH 自由基清除能力、ABTS 自由基清除能力和铁离子还原能力的实验结果,不同加工品抗氧化能力大小依次为鲜品>湿品>干品,表明经过加工处理后的蕨菜抗氧化活性降低,该结果与总黄酮、总酚变化趋势一致,这可能与蕨菜在经过加工处理后总黄酮、总酚和蛋白质、维生素C 等营养成分含量降低有关[7]。吴永祥等[30]也观察到类似的趋势,其结果显示经过发酵加工处理后的蕨菜醇提物总酚含量降低,清除DPPH 自由基和ABTS 自由基能力降低。
2.3 体外降血糖活性
2.3.1 对a-葡萄糖苷酶活性的抑制 图6、表4 可知,不同蕨菜醇提取物对酵母菌来源α-葡萄糖苷酶均具有一定程度的抑制作用,且在一定质量浓度范围内,随着质量浓度的增加,其抑制活性显著提高,呈一定的量效关系,α-葡萄糖苷酶活性抑制的IC50值大小依次为鲜品>干品>湿品,差异显著(P<0.05)。表明蕨菜湿品抑制α-葡萄糖苷酶活性最强,其IC50=(1.65±0.054)μg/mL,在质量浓度为15.0 μg/mL时抑制率可达89.62%。

图6 不同蕨菜醇提取物对酵母菌来源α-葡萄糖苷酶抑制活性Fig.6 Inhibition of different processing products from Blechnum orientale L.on yeast α-glucosidase activity
表4 不同蕨菜醇提取物对酵母菌来源α-葡萄糖苷酶抑制活性的IC50 值(,n=3)Table 4 IC50 of the inhibitory activity of different processing products from Blechnum orientale L.to yeast α-glucosidase (,n=3)

表4 不同蕨菜醇提取物对酵母菌来源α-葡萄糖苷酶抑制活性的IC50 值(,n=3)Table 4 IC50 of the inhibitory activity of different processing products from Blechnum orientale L.to yeast α-glucosidase (,n=3)
2.3.2 对α淀粉酶活性的抑制 由图7、表5 可知,不同蕨菜醇提取物对α-淀粉酶均具有一定程度的抑制作用,且在一定质量浓度范围内,随着质量浓度的增加,其抑制活性显著提高,呈一定的量效关系。对α-淀粉酶活性抑制的IC50值大小依次为鲜品>干品>湿品,差异显著(P<0.05)。其中,湿品的IC50值低于阿卡波糖,干品和鲜品的IC50值高于阿卡波糖。表明蕨菜湿品抑制α-淀粉酶活性最强,且活性强于阳性对照阿卡波糖,其IC50=(0.056±0.001)mg/mL,在质量浓度为0.1 mg/mL 时抑制率可达77.09%。
表5 不同蕨菜醇提取物对α-淀粉酶抑制活性的IC50 值(,n=3)Table 5 IC50 of the inhibitory activity of different processing products from Blechnum orientale L.to α-amylase (,n=3)

表5 不同蕨菜醇提取物对α-淀粉酶抑制活性的IC50 值(,n=3)Table 5 IC50 of the inhibitory activity of different processing products from Blechnum orientale L.to α-amylase (,n=3)

图7 不同蕨菜醇提取物对α-淀粉酶抑制活性Fig.7 Inhibition of different processing products from Blechnum orientale L.on α-amylase activity
综合α-葡萄糖苷酶与α-淀粉酶活性抑制的结果显示,不同蕨菜醇提取物体外降血糖活性大小依次为湿品>干品>鲜品,表明加工处理后的蕨菜的降血糖活性优于新鲜蕨菜。其中,不同蕨菜醇提取物对酵母菌来源α-葡萄糖苷酶抑制作用强于阿卡波糖,其可能原因在于蕨菜提取物中丰富的酚类、黄酮、多糖、生物碱等成分类型和多种成分的协调作用的结果有关[2],研究显示酚类、多糖具有显著的α-葡萄糖苷酶抑制活性,甚至优于阿卡波糖[31]。
2.4 相关性分析
由表6 可知,总酚和总黄酮含量与抗氧化活性(DPPH 自由基清除能力、ABTS 自由基清除能力、还原能力)均呈极显著正相关性(P<0.01)。总酚与α-葡萄糖苷酶抑制活性呈极显著正相关性(P<0.01),但总酚与α-淀粉酶抑制活性、总黄酮与α-葡萄糖苷酶抑制活性、α-淀粉酶抑制活性呈显著正相关性(P<0.05)。

表6 不同蕨菜醇提取物总酚、总黄酮与抗氧化、α-葡萄糖苷酶、α-淀粉酶的抑制活性的相关性Table 6 The relationships of the contents of total polyphenols and total flavonoids with the antioxidant activity、α-glucosidase and α-amylase inhibitory activity of different processing products from Blechnum orientale L.
结果表明,总酚、总黄酮是蕨菜发挥抗氧化活性的重要物质基础,可能与其总酚、总黄酮富含酚羟基结构有关[32],而其降血糖活性与总酚、总黄酮未显示极显著正相关,表明其发挥降血糖活性物质基础除总酚、总黄酮,可能与其他活性成分,如蕨菜中的多糖、生物碱类有关[2]。
3 结论
实验以不同蕨菜醇提取物为原料,对其总酚、总黄酮含量及其体外抗氧化和降血糖活性进行了系统研究。结果显示,不同蕨菜醇提取物均含有丰富的总酚、总黄酮和显著的抗氧化和降血糖活性,且抗氧化活性与总酚和总黄酮含量呈极显著相关,降血糖活性与总酚和黄酮呈显著正相关。其中,蕨菜鲜品具有最高的总酚、总黄酮含量和抗氧化活性,蕨菜湿品具有最高的体外降血糖活性,应重点从鲜品出发寻找发挥抗氧化活性的酚类和黄酮类成分,从湿品出发寻找降低餐后血糖的活性成分。
研究结果对蕨菜的生产加工提供一定的数据参考,特别是对蕨菜在食品药品工业中的潜在应用研究具有一定的参考价值。然而,蕨菜发挥抗氧化活性中酚类、黄酮类具体结构及构效关系和作用机制有待进一步深入,除酚类、黄酮类,蕨菜发挥降血糖活性的其他物质基础和作用机制有待进一步阐明。
