美国促进生物医药产业创新发展政策经验及启示
2021-10-29胡海鹏莫富传
胡海鹏, 袁 永, 莫富传
(广东省科技创新监测研究中心, 广州 510033)
生物医药产业是各国重点发展的战略性新兴产业之一,也是以研发创新为核心驱动力的朝阳产业。特别是新冠肺炎疫情发生以来,凸显生物医药创新能力对应对突发疾病防控科研攻关支撑的至关重要性。美国是全球公认的生物医药产业创新强国,促进生物医药产业创新发展政策经验对中国具有重要借鉴意义。当前,学术界关于美国生物医药产业发展已有一定研究,但目前研究关注重点聚焦在生物防御战略[1-3]、产业集聚发展[4-5]、临床审批监管[6-8]以及产业竞争要素[9-10]等。生物医药作为以研发创新为核心的新兴产业,当前研究对于美国生物医药产业创新发展现状分析较为笼统,系统探讨美国生物医药产业创新发展政策经验研究较少。本文基于集聚区、企业、高校、人才、医院、创新成果等维度深入剖析美国生物医药产业创新发展现状特点,并全面分析促进产业创新发展的政策经验,最后提出启示建议。
1 现状特点
美国是世界生物医药技术的发源地,二战后开始医药制药技术研发,形成波士顿、旧金山、圣地亚哥、华盛顿-巴尔的摩、北卡三角研究地带、西雅图、纽约、费城、洛杉矶等9大发展势头良好的生物医药产业集群及区域,其中前5 个是世界著名的生物医药集聚创新基地(表1)。目前,美国在世界上形成了明显代际优势,掌握了最先进的生物技术,拥有全球最多的生物技术专利、最顶尖的生物医药研发企业及机构,表现为以下4个方面。

表1 美国5大生物医药知名创新集聚区
1.1 集聚大批顶尖生物医药创新龙头企业
在制药方面,美国《制药经理人》杂志公布“2020年度全球制药企业50强排行榜”,美国的辉瑞、默克、百时美施贵宝、强生等15家美国企业入选,占榜单总数30%。入选企业中,处方药销售总额达3 178.84亿美元,占榜单总额的44.37%;研发收入总额达624.93亿美元,占榜单总额的48.16%。在医疗器械方面,根据国外权威的第三方网站QMED最新发布的“2019年医疗器械企业百强榜单”,美敦力、强生、雅培、GE医疗等48家美国企业入选,占榜单总数48%。入选企业中,企业营业收入总额达2 331.64亿美元,占榜单总额的65.85%;企业市值达16 541.93亿美元,占榜单总市值的77.43%。与此同时,这些生物医药龙头企业强大的企业自身实力不仅保证了生物医药新技术和新产品的研发,而且在创造性、敏捷性和成长性方面具有突出的优势,带动相关企业特别是中小企业的发展,推动整个美国生物医药产业的发展。
1.2 培育大批世界一流的生物医药高校及人才
在生物医药领域高校方面,根据QS 世界大学排名显示,2020年生命科学与医学世界排名前200 的高校中,美国有61所高校入选,远超过排名第二的英国21 所上榜高校。与此同时,大批生物医药顶尖高校及学科为美国生物医药产业创新发展培养了大量学科人才及承担了研发创新工作,支撑美国生物医药产业集聚区快速发展[11]。在生物医药顶尖创新人才方面,1901年设立诺贝尔生理学或医学奖至今,诺贝尔生理学或医学奖共颁发111次,有222人获得该奖,来自美国的诺贝尔生理学或医学奖的共103人,占获得总数的46.40%。其中,获奖得主来自哈佛大学12人、洛克菲勒大学9人、得克萨斯大学5人、加州理工学院5人、美国国立卫生研究院4人、哈钦森癌症研究中心3人。
1.3 发展大批生物医药研发机构及研究型医院
为了确保在生物技术和生物武器领域的领先优势,美国不断加大生物安全领域创新平台的投入,建设美国陆军传染病医学研究所等15家P4实验室,数量和建设面积居世界之首。其中,马里兰州5家、得克萨斯州3家、佐治亚州2家,主要隶属于国防部、卫生公众服务部门、国土安全部以及大学,聚焦开展重大传染病研究。在研究型医院建设方面,根据美国《新闻周刊》发布的“2020年世界最佳医院”,全球前100的医院中美国占据18席,排名前10的医院中,美国占据4席。这些医院强调科技和人才的创新,致力于解决临床实际问题的科学研究,临床医疗水平和科研能力世界一流。
1.4 产出大批具有全球影响力的创新成果
根据incoPat创新指数研究中心与IPRdaily中文网联合发布的2020全球生物医药产业发明专利排行榜TOP100,美国共48家机构上榜,生物医药发明专利申请数量共12 059件,占榜单总数的59.91%。在原研药方面,根据世界各大医药公司最新年报,2019年全球药物销售额TOP100中,美国占53个,销售总额达到2 174.32亿美元,数量和销售总额分别占53%、64.74%。其中,全球药物销售额TOP10的中,美国占9个。
2 政策经验
近几十年间,美国全力支持生物医药产业的发展,推动在战略谋划、创新平台建设、企业创新发展、临床审批机制以及创新生态环境等方面建立完善的政策扶持体系。
2.1 顶层战略谋划推动全美生物医药产业创新
1)从国家层面持续制定国家生物安全战略。美国历来高度重视生物安全,小布什政府、奥巴马政府、特朗普政府制定了《国家生物防御战略》《国家卫生安全战略2019—2022》《全球卫生安全战略》,推动全美生物医药产业创新发展。其中,2018年9月,特朗普签署第14号国家安全总统备忘录发布《国家生物防御战略》,强调大力发展生命科学和生物技术体系,支持建立美国创新基地(表2)。
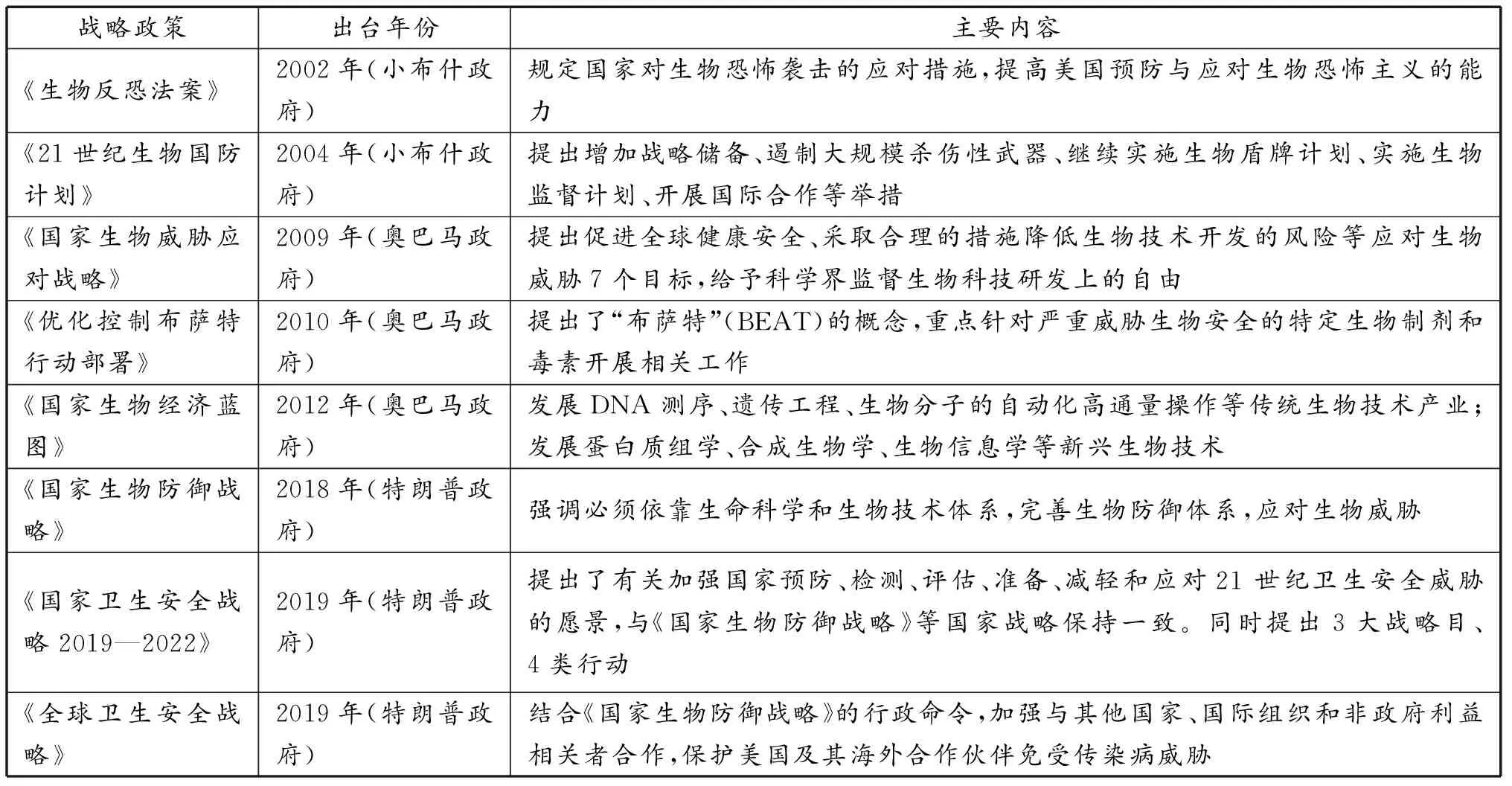
表2 美国近年出台生物安全战略情况
2)将生物医药作为国家创新战略重要支持领域。2015年10月,美国新版《美国创新战略》将 “精准医学概念治疗疾病”“通过脑计划加速发展新型神经技术”“推动在卫生保健方面的突破性创新”作为国家优先突破领域,并提出精密医疗、大脑计划两大战略领域。
2.2 建立多层次的生物医药研发及创新平台体系
1)建立以美国国立卫生研究院(NIH)为主的生物医药基础研究投入渠道。美国政府通过NIH投资于生物医学研究,发展成为美国生物医药领域知识创造最重要投资主体,并成为世界的最大医学研究中心之一。NIH 的主要任务是资助和引导生物医学研究,用新的方法进行预防、检测、诊断及治疗疾病,NIH 所资助的研究大部分是基础医学研究[12]。
2)成立弗雷德里克国家实验室。弗雷德里克国家实验室隶属于国立卫生研究院的国家癌症研究所,是全美唯一一家完全专注于生物医学研究的国家实验室,被赋予满足国家最迫切的生物医学研究需求的国家使命[13],并在癌症和艾滋病方面开展基础、转化和临床前研究与开发。
3)推动建立临床与转化医学中心体系。美国国立卫生研究院成立了临床与转化科学基金(CTSA)项目,NIH-CTSA项目资助建立的临床与转化医学中心,目的在于建立临床与转化医学中心网络,推动临床与转化医学的研究,使中心成为验证临床与转化医学相关政策规范和方法的试验基地。NIH采用合作协议的模式,由NIH附属的国家研究资源中心负责管理,5年为一个周期对临床与转化医学中心给予资金支持,每个中心获得年度NIH-CTSA项目资助400~2 300万美元[14]。
4)建立覆盖全国的国家动物卫生实验室网络。为提升动物外来病入侵和生物恐怖袭击的应对能力,美国组建了国家动物卫生实验室网络(NAHLN),旨在通过开展持续性监测活动,及时发现动物外来病、新发病以及应对生物恐怖袭击,保护美国动物健康、公共卫生安全和食品供给安全。目前,NAHLN共有12 个一级实验室。
5)注重培育发展研究型医院。美国医院承担职能在新的医疗环境和系统不断发展,通过注重科学研究与临床实际的结合、注重与研究型大学及其他医疗机构建立多学科研究平台、注重培养和引进临床与科研双优的复合型人才、注重医院的文化建设,研究型医院逐渐发展成为现代医院发展对标的标杆。美国研究型医院基本上是国际一流的大型医院,具有高超的临床诊疗技术水平,综合实力雄厚。
2.3 大力支持生物医药企业创新发展
1)注重支持企业开展“孤儿药”研发。1983年1月,美国总统里根签署《孤儿药法案》,开创了孤儿药由政府支持的先河,成为美国罕见病用药方面的基础性法律[15],随后相继出台《孤儿药法案实施办法》《减轻税负法案》《孤儿药研究资助法案》《孤儿药实施细则》,提出采用基金资助、抵扣税收、市场垄断权、快速审批通道、协议帮助、开放性协议等方式支持孤儿药研发(表3)。
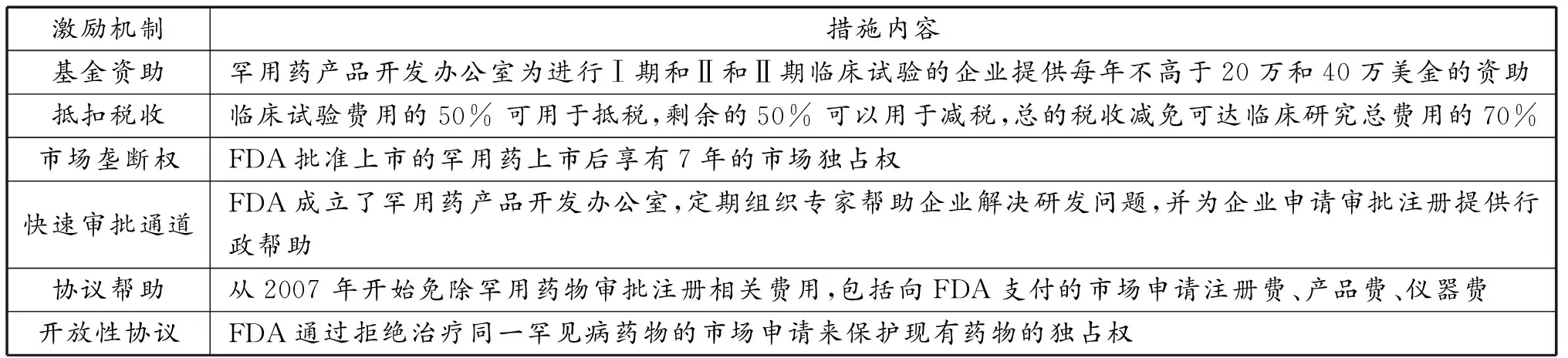
表3 美国“孤儿药”研发激励机制
2)支持生物医药中小企业创新。为增强中小制药企业的创新活力,美国食品药品监督管理局(FDA)针对小微生物医药企业设置了小微企业办公室,并对小微企业实行项目资助、注册收费减免、优先审评、快速通道等机制(表4)。FDA 还发布了《小微企业指南》。另外,美国还致力于建立生物技术领域的创新型专业孵化器,包括LabCentral、IndieBio等,为美国生物医药中小企业研发创新提供完善的研发服务。

表4 美国生物医药中小企业研发创新政策举措
3)美国发达的资本市场为生物医药企业研发提供多元化的融资渠道。美国生物医药企业得益于全球最发达的资本市场,在证券市场反面,美国拥有纽约证券交易所、全美证券交易所、纳斯达克市场、招示板市场等证券市场,为生物医药企业提供证券和股指的现货、证券和股指的期货及期权、可转换债券、信托凭证(ADRs)等品种,保障了生物医药企业的融资发展需求。
2.4 构建完善的临床审批机制
1)建立以美国食品药品监督管理局为核心的临床审批监督制度体系。20 世纪60 年代,《联邦医药法》正式要求医药公司向FDA证明其产品同时具备安全性和有效性,此后相继出台《罕见病药物法》《药品价格竞争与专利期恢复法》《处方药使用者费用法》《处方药使用者费用法(1992)》《动物药使用者费用法(2003)》《仿制药使用者费用法(2012)》[17],逐步构建形成临床审批监督制度体系,推动美国成为全球最严格的药品审核的国家。
2)注重建立生物类似药专门的研发注册审批绿色机制。为平衡药品创新和可及性,FDA通过《生物制品价格竞争与创新法案》以及《证明生物类似药与参比生物制品具有生物相似性的科学考量》《证明生物类似药与参比生物制品具有生物相似性的临床药理数据》等一系列生物类似药研发与评价指南,提出适当简化研发与评价中的技术要求、设立专门的生物类似药审评途径、建立生物类似药注册专利链接制度等,构建了生物类似药的研发评价指南和专门的注册审批制度。
3)建立统一的临床试验数据信息化平台。为了规范临床试验的操作,1997年美国启动开发北美临床试验数据中心,2002年正式运行,主要针对新药或干预措施的临床试验注册,将临床试验中的信息和数据在公开的临床试验注册机构进行登记注册,以便向公众、临床研究人员和赞助者提供可靠有效的信息,使临床试验的设计和实施更加透明化,所有人均可通过网络免费对注册的临床试验进行查询和评价[14]。目前,北美临床试验数据中心临床试验数据覆盖了美国境内的50多个州和192个国家,是国际上最重要的临床试验注册机构之一。
2.5 打造有利于生物医药产业研发创新的生态环境
1)建立体系化的生物医药创新支持机制。在制度法规层面,美国通过研究制定相应的法律法规、财政预算、管理法规、税收政策等,不断加强生物技术研究、鼓励发明创新和促进生物技术转移等。在产业创新机构管理层面,在国家层面成立内阁级的生物防御指导委员会,主席由卫生和公众服务部部长担任,与生物防御相关的机构负责人也加入生物防御指导委员会中,协调各部门共同解决生物威胁问题。
2)运用研发外包模式开展临床研究。研发外包与研发业务离岸外包是美国生物医药产业创新重要的运行模式。与CRO共同开发新药已成为美国生物医药企业新药研发的战略性环节,全美约20%生物医药研发开支用于研发外包业务[18],培育了昆泰、实验室集团、精鼎医药、PPD等一批世界顶尖的CRO企业。
3)创新体制机制扩大药品器械市场。建立医药产业适用的专利保护制度、数据保护制度、专利期补偿制度,为创新药物上市后提供了足够长的市场独占期。创新药垄断定价,美国药品定价机制为市场自由定价,创新药在市场独占期内可以制定较高的垄断价格[19],为美国医药创新提供了丰厚的创新回报;通过医疗卫生制度改革扩大居民对生物医药产品和服务的需求。
3 启示建议
3.1 注重顶层谋划设计促进生物医药创新发展机制
借鉴美国从制度法规、产业创新管理等方面顶层谋划设计,对促进生物医药创新发展具有重要意义。
1)要制定综合统筹的生物医药战略规划。系统规划生物医药及细分领域,在国家层面制定和实施生物医药行动计划,形成生物医药领域创新的强大国家战略能力。与此同时,通过研究制定配套完善的财政资助计划、管理法规办法、税收政策举措等,加强生物医药产业研发创新。
2)要建立促进生物医药产业创新的统筹管理机构。生物医药产业创新涉及卫健、药监、科技、发改、工信、市场监管、中医药等跨部门管理,部门之间存在条块分割,导致促进生物医药产业创新发展难以形成合力。借鉴美国经验要建立战略性协调机构,负责促进生物医药产业发展的协调、指挥、评估工作,建立配套多部门工作协调机制,完善生物医药产业治理体系和规范化管理运行机制[2]。
3)加强科研伦理建设。要成立了相对独立的伦理委员会,严格开展对研究者的资格审查,保障参与者和其他研究人员的相关权益,发展中国特色的临床研究资源共享的模式。
3.2 注重突出生物安全的战略地位
美国站在国家安全的高度看待生物安全问题,借鉴研究制定国家生物安全战略,积极推动生物安全成为维护国家生物安全的最高指导方针。
1)要树立生物安全战略发展观。要加强生物安全在国家安全体系中的战略地位,把生物安全与经济安全、国防安全、能源安全、信息安全等并列为国家安全的重要组成部分,统筹资源进行生物技术的研发,对生物安全进行顶层设计。要建立应对重大生物安全事件防控机制及应急规划方案,加强生物安全情报发现分析、生物安全研究基础设施建设、生物安全监测评估。加强对人口基因和动植物基因等资源管控,保障国民健康和国家安全。
2)要构建生物安全国家战略体系。充分发挥中央国家安全委员会对生物安全发展的统筹作用,加快构建国家生物安全法律法规体系、制度保障体系。结合中国生物安全和技术发展领域实际情况,制定生物安全领域相关的国家战略,健全中国生物安全管理法律法规体系,出台生物安全相关法规、指南规范、技术标准。以《生物安全法》为基础,进一步制定和完善生物信息数据跨境非法交易、野生动植物保护、外来物种入侵防御、生物武器防御等法律法规,做好与《传染病防治法》《进出境动植物检疫法》等现有法规的衔接工作。
3.3 注重加强生物医药领域的研发投入
借鉴美国推动建立由财政投入、企业投资、风险投资等多元化的生物医药研发投入体系。
1)要加强对生物医药产业的基础研究投入。为推动药品器械的自主创新,要加大对发展医学与生命科学的基础研究领域,引导大学、科研机构、医院瞄准世界科技发展前沿,聚焦脑科学、生命组学、病原生物学、合成生物学等前瞻性领域开展基础与应用基础研究,以科研基金的形式加强研发扶持。
2)加强利用风投创投支持生物医药研发创新。生物医药产业是需要极高资金投入的产业。要发展现代化的生物医药资本市场,依托证券市场、风投创投向生物医药企业投资,制定倾向于小微生物医药企业提供投融资的优惠政策。要建立健全创业投资引导基金的投入机制,引导风投创投基金支持创新型生物技术初创公司的孵育,保障新药研发的资金需求。
3)建立“罕见药”“生物类似药”研发支持机制。制定支持“罕见药”“生物类似药”研发的专门性政策法规,健全从基础研究、药物开发、临床试验、注册上市、推广应用全流程的支持机制。基于“罕见药”“生物类似药”的特殊性,设立单独的注册审评路径,在保证安全的前提下,建立恰当的标准和要求评估的可比性、安全性及有效性,优化审评尺度,推动“罕见药”“生物类似药”尽早进入临床研究,缩短研发周期。
3.4 注重培育世界一流生物医药科技创新平台及龙头企业
1)规划建设高水平生物医药科技基础设施与实验室。围绕新冠肺炎疫情等重大突发传染病和重大疾病等人民群众迫切关注的焦点问题,完善科研攻关体系和重大平台载体建设,增强生物医药领域战略科技力量和战略储备能力。突出国家意志和目标导向,争取在生物医药领域建设国家实验室。推进现有国家重点实验室优化调整,支持在生命科学领域新建一批国家重点实验室。依托高校、科研机构建设一批高等级生物安全实验室。
2)加快培育世界一流的生物医药龙头企业。要鼓励企业加强自主研发,加大对生物医药研发投入,依托国家重大新药创制科技重大专项等国家级科研项目的资助,强化与制药企业对接与合作,提高技术成果转化率。进一步营造生物医药企业竞争环境,鼓励生物医药企业间并购转让,引入国外优质生物医药企业与中国生物医药企业开展合作竞争,充分调动生物医药企业创新活力。强化政府对创新药物全生命周期支持,通过资金扶持、药品定价、税收优惠制度、医保采购等政策倾斜,提高生物医药企业的创新能动性。
3)加快建设临床医学研究中心。围绕疾病防治的重大需求和临床研究中存在的共性技术问题,组建和运营好国家临床医学研究中心,开展大规模、多中心的循证评价、防诊治新技术新方法、诊疗规范和疗效评研究,推动基础向临床转化,提升疾病诊疗技术水平。
3.5 注重建立完善的临床研究审批监管支撑体系
1)建立机制完善的临床研究监管体系。药品安全监管涉及药监、工商、卫生委等多部门管理,容易造成多头领导。借鉴FDA建设经验,要建立统一的领导机构和药品安全监管体系,明确机构设置、运行机制等,强化监管主体、职能划分。大力发展行业协会等民间组织,发挥外部机构的约束机制,增加对政府、市场的监督力量。从国家层面完善修订新药审批监管法律法规,加快创新药品审批,加速创新产品的市场化速度,节约企业成本和社会成本。
2)大力发展研发外包等新业态。医药研发业务离岸外包已经成为美国医药跨国企业创新的重要运行模式,中国要建立完善的科技中介服务体系,通过税收优惠及奖励培育和扶持一批本土研发外包机构发展壮大。加强医药研发的国际合作,推动本土医药企业参与跨国医药企业的研发外包。
3)加强权威的临床试验数据库建设。政府部门要牵头建立完善的生物医学数据管理制度体系,制定了完善的管理规范,形成生物医学数据资源自动汇聚渠道。加强收集整理中国已产生或即将产生的生物医学数据与信息,构建中国生物信息数据库。
