N6-甲基腺苷甲基化对小鼠脑缺血-再灌注损伤中微小核糖核酸-155表达和脑损伤的调控作用
2021-10-28何欣燃王黎洲安天志
何欣燃,王黎洲,许 敏,安天志,周 石,李 兴
作者单位:550004 贵阳 贵州医科大学医学影像学院
目前急性缺血性脑卒中的主要治疗方式是静脉溶栓和血管内介入治疗,如血管内机械取栓、动脉溶栓和动脉成形术[1]。然而研究表明,血管成功再通仍可发生脑缺血-再灌注损伤(cerebral ischemiareperfusion injury,CIRI),造成更为严重的脑组织结构和功能损害[2]。因此,探究CIRI 潜在分子机制,开发新的治疗靶点以减轻脑损伤,是当前缺血性脑卒中研究的主要目标。目前已报道微小核糖核酸(microRNA,miRNA,miR)在慢性心血管或肾脏疾病过程中的作用[3]。有研究发现信使RNA(mRNA)和长非编码RNA,与DNA 和组蛋白相似,可被化学修饰,最为重要的是mRNA 转录后调控可影响关键蛋白表达和脑功能[4]。RNA 最丰富的内部化学修饰N6-甲基腺苷(N6-methyladenosine,m6A)是mRNA稳定性、蛋白表达和其他数个细胞过程的关键调节因子[5],m6A 上的pri-miRNA 可扰乱miRNA 成熟[6]。近期研究表明mRNA 上m6A 修饰是可逆的,并受催化甲基转移酶如甲基转移酶样蛋白(methyltransferase like protein,METTL)3、METTL4、METTL14 等催化[7]。本课题组前期研究结果证实miR-155 表达与脑部神经元凋亡呈负相关[8],但CIRI 过程中调控miR-155 表达的上游机制即m6A 甲基化是如何调控primiRNA,从而调控miR-155 集中尚未阐明。本研究旨在探讨m6A 修饰与miR-155 表达水平在CIRI形成过程中的潜在机制。
1 材料与方法
1.1 实验细胞和动物
小鼠脑神经瘤母细胞(N2a)及293T 细胞均购自湖南丰晖生物科技公司。本研究采用的实验方案已获贵州医科大学动物实验伦理委员会批准,并按照动物实验指南进行。所用动物为8月龄C57BL/6雄性C57BL/6 小鼠,体质量20~25 g。术前小鼠在12 h 光照和12 h 黑暗条件、控制温度(21±2)℃、控制湿度60%~75%环境中饲养1 周,保证充足的实验室饲料和水。
1.2 主要实验试剂
miR-155 过表达质粒(上海吉凯基因医学科技公司),TRIzol 试剂、磷酸缓冲液(PBS)(美国Thermo Fisher 科技公司),β- 肌动蛋白(actin)内参抗体、miR-155 mimics、miR-155 inhibitor(英国Abcam 公司),DL5000 marker、DL2000 marker、限制性内切酶(日本TaKaRa 公司),质粒小量提取试剂盒(北京索莱宝科技公司),DH5α 感受态细胞(北京擎科生物科技公司)。
1.3 小鼠CIRI 建立和实验动物分组
实验组小鼠接受颈内动脉线栓法构建大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型[9],建模成功24 h 后开始实验;假手术组小鼠麻醉后,不置入线栓,不阻塞大脑中动脉,其余手术步骤与实验组相同。手术过程中及结束后均使用37℃恒温电热板维持小鼠体温,直至其完全苏醒。共分为7 组,分别为假手术组(sham)、缺血-再灌注模型组(MCAO)、缺血-再灌注模型右侧脑室注射对照组(LV-NEG)、缺血-再灌注模型右侧脑室注入miR-155 过表达组(LV-miR-155)、缺血-再灌注模型右侧脑室注入对照质粒组(LV-minics)、缺血-再灌注模型右侧脑室注入METTL3 高表达质粒组(LVMETTL3)、缺血-再灌注模型右侧脑室注入METTL3沉默表达质粒组(LV-METTL3-inhibitor),每组各6只鼠。
1.4 实时定量聚合酶链反应检测
采用TRIzol 法从处死小鼠脑组织提取RNA,以39 μL 焦碳酸二乙酯(DEPC)处理水稀释1 μL RNA(1∶40 稀释),NanoDrop 仪测定样品浓度和纯度,A260/A280 比值应在1.6 以上。总RNA 逆转录。取聚合酶链反应(PCR)混合液20 μL,转移至各孔中;将PCR 板装入实时定量聚合酶链反应(RT-qPCR)仪,按照如下程序运行:95℃2 min,95℃5 s,60℃30 s,95℃5 s,循环次数40 次。产物经1%琼脂糖凝胶电泳,并用Image-Pro Plus 图像分析软件计算吸光度值,以与3-磷酸甘油醛脱氢酶(GAPDH)相对值记录结果。2-△△Ct 法分析基因相对表达[10],计算公式:ΔΔCT=ΔCt(MCAO 组)-ΔCt(对照组)。引物序列(苏州金唯智生物科技有公司)如下:miR-155-F:5′-GCTTCGGTTAATGCTAATCGTG-3′;miR-155-R:5′-CAGAGCAGGGTCCGAGGTA-3′;GAPDH 上游引物5′-GGCAAGTTCAACGGCACAG-3′,下游引物5′-ACGCCAGTAGACTCCACGAC-3′。
1.5 慢病毒转染检测
为了构建带His 标签的慢病毒表达载体,采用PCDH 载体系列行目的基因miR-155 和METTL3 过表达,PLKO 系列行目的基因miR-155 和METTL3敲除。质粒合成由外包公司合作完成。采用293T 细胞进行慢病毒包装,大肠杆菌DH5α 行扩增慢病毒包装的质粒。细胞准备好后取5~10 μg/mL 聚凝胺作为转染浓度,转染后24 h 吸取慢病毒转染液中原有培养基,加入新鲜培养基继续培养24 h,加入2 μg/mL 嘌呤霉素行选择性培养细胞24 h,共计培养3 代即可得到含有慢病毒表达质粒的细胞;将转染慢病毒载体的细胞通过胰酶进行消化,然后加入人工脑脊液中,注射至小鼠右脑室;转染后5 d 行造模检测,RT-qPCR 检测转染结果。
1.6 蛋白质印迹分析
细胞裂解液PBS 对小鼠右脑组织样本进行裂解,4℃、12 000×g离心2~3 min,收集上清液,Bradford 法检测相关蛋白浓度;蛋白质经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,然后转移至聚偏二氟乙烯(PVDF)膜上;按蛋白印迹位置剪开PVDF 膜,每张膜加入一抗稀释液2 mL;含一抗溶液的封闭液滴加于摇床塑料膜上,将Western 膜从封闭液中取出,滤纸贴角稍吸干,正面朝下贴在一抗上,4℃静置过夜;一抗试剂孵育结束后,用含Tween®20 磷酸盐缓冲液(PBST)对膜再次清洗,将二抗试剂按1∶1 000 比例加入胶体溶液中,将膜与一抗在4℃孵育过夜,然后与偶联的二抗在室温下孵育2 h;PBST 对膜再次清洗;最后置于Super ECL Plus 超敏发光液中2 min,凝胶成像仪中成像。Image Lab 软件分析蛋白条带灰度值,β-actin 作为对照,室温下在中封闭1 h 后,通过增强化学发光检测试剂盒显示目标蛋白条带。
1.7 数据分析
采用SPSS 20.0 软件对所有数据进行统计学分析,所有数值均取3 次独立实验±s,统计分析用t检验,非正态分布数据用非参数检验,P<0.05为差异有统计学意义。
2 结果
2.1 MCAO 模型脑细胞中miR-155 表达水平
RT-qPCR 检测显示,MCAO 组小鼠脑组织细胞中pri-miR-155 表达水平与sham 组相比显著降低(P=0.009),但pre-miR-155、miR-155 表达显著升高(P=0.007、0.000 8),见图1。
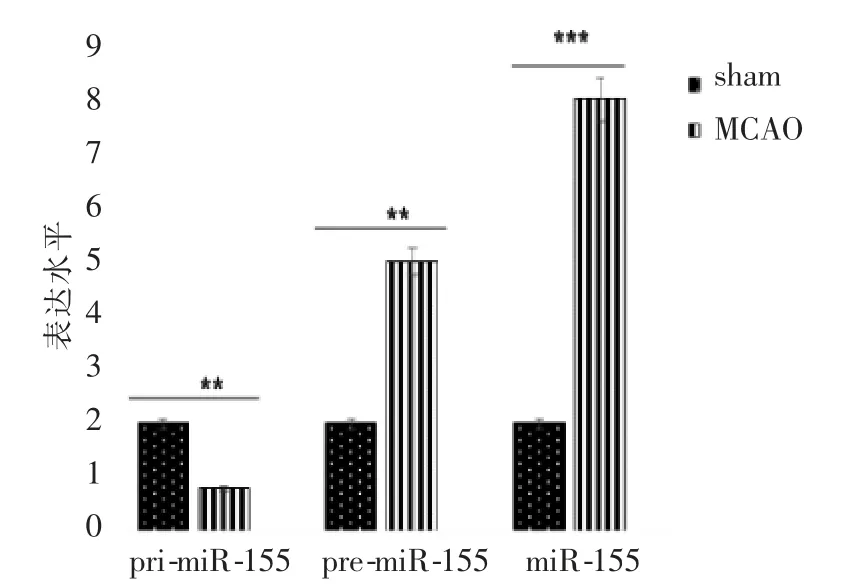
图1 MCAO 组和sham 组小鼠脑组织中miR-155 表达水平
2.2 METTL 复合物在MACO 模型中表达水平
建模24 h 检测显示,MACO 模型鼠右脑组织细胞中METTL3、miR-155 表达水平均升高(P<0.05)(图2①),METTL3 蛋白表达水平随miR-155 剂量增加而升高(图2②),但METTL14 mRNA 与肾母细胞瘤1 相关蛋白(WTAP)mRNA 表达水平,差异均无统计学意义(P>0.05)(图2③)

图2 METTL3、METTL14 及WTAP 在MACO 模型中表达水平分析
2.3 METTL3 过表达对miR-155 水平的影响
慢病毒过表达质粒LV-METTL3 组细胞中METTL3 过表达与对照质粒LV-minics 组相比,使pri-miR-155 表达水平显著降低(P=0.008),同时升高pre-miR-155 和miR-155 表达水平(P=0.04、0.009),差异均有统计学意义(图3)。
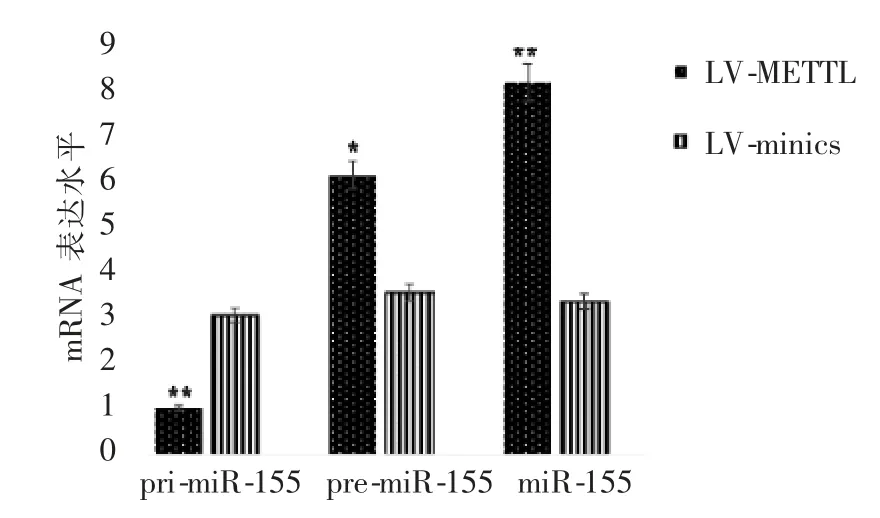
图3 METTL3 过表达对小鼠CIRI过程中miR-155 水平的影响
2.4 METTL3 低表达对miR-155 水平的影响
慢病毒沉默表达质粒LV-METTL3-inhibitor 组细胞中METTL3 沉默表达与对照质粒LV-minics 组相比,显著升高pri-miR-155 表达水平(P=0.006),同时降低pre-miR-155、miR-155 表达水平(P=0.03、0.009),差异均有统计学意义(图4)。
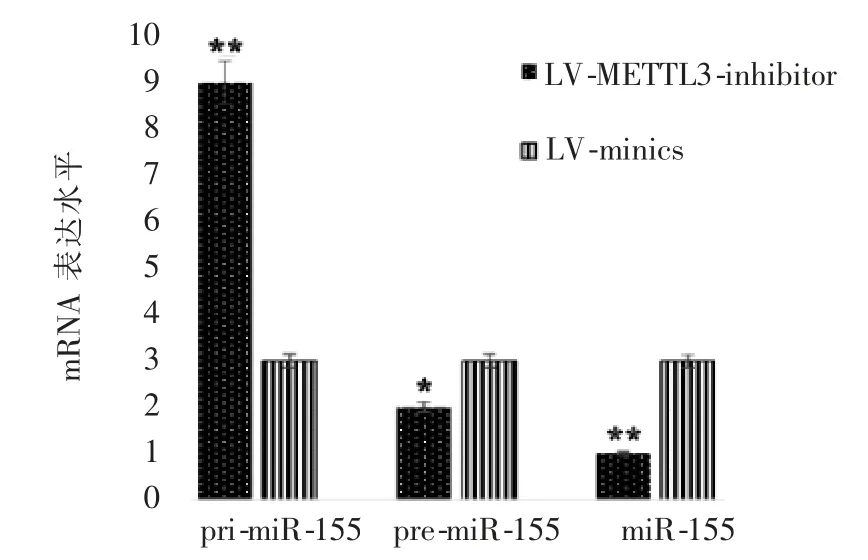
图4 沉默表达METTL3 对小鼠CIRI 过程中miR-155 水平的影响
3 讨论
近年来,m6A 修饰成为表观遗传研究热点。m6A 修饰参与哺乳动物许多生物学过程,如RNA剪接、蛋白质翻译和干细胞更新[11]。Li 等[12]研究报道m6A 上METTL3 可通过与翻译起始密码子相互作用促进翻译,进一步影响癌细胞生长、存活和侵袭。Visvanathan 等[13]研究显示,METTL3 介导的m6A修饰在神经胶质瘤细胞维持和去分化中具有关键作用,揭示了METTL3 作为胶质母细胞瘤治疗中潜在分子靶点的基本作用。上述研究虽然证实METTL3 在肿瘤细胞中的重要调节机制,但目前尚无针对CIRI 过程中M6A 修饰影响的报道,也很少有研究关注METTL3 在CIRI 发生中的潜在机制[14],因此本研究探讨METTL3 在CIRI 中对miR-155 是否存在调控作用。
有研究报道,miR-155 体内表达能显著改善脑缺血症状,增加血管内皮通透性[3]。有研究证实miR-155 表达水平变化与脑损伤程度密切相关,miR-155 表达升高与脑损伤程度加剧相关[15]。Wang等[16]研究发现,抑制脑细胞中miR-155-5p、pri-miR-155 和pre-miR-155 表达,可改善大鼠脑缺血损伤程度,提示miR-155 可能是一种新型脑血管病治疗剂。该结论为本研究结果提供了强有力佐证,表明miR-155 在脑损伤中具有重要作用。本课题组先前研究发现miR-155 在CIRI 过程中异常表达[8]。本研究将pri-miR-155 中异常m6A 修饰与CIRI 发生和发展联系起来,结果提示MCAO 模型小鼠脑组织细胞中miR-155 水平可能是pri-miR-155 加工和成熟异常造成的。
m6A 在miRNA 成熟过程中起到关键的调控作用。m6A 甲基转移酶复合物由METTL3、METTL14和WTAP 组成,其中METTL3 过表达能增强pri-miR中m6A 修饰,并加速其向miRNA 成熟[17]。本研究结果辅证了这一观点,证实MCAO 建模24 h 小鼠右脑中METTL3 和miR- 155 表达均显著增高,METTL3 蛋白表达也随miR-155 剂量增加而显著增加,但METTL14 和WTAP 并无显著差异;了解到METTL3 和miR-155 表达水平呈正相关后,为进一步探究METTL3 表达对pri-miR-155 和pre-miR-155表达的影响,又分别构建METTL3 高表达和低表达小鼠模型,最终发现METTL3 表达升高能促进premiR-155 成熟,从而导致miR-155 表达水平升高。
本研究结论认为,CIRI 过程中METTL3 表达升高可促进pre-miR-155 成熟,进而升高miR-155 表达水平。这可能为未来缺血性脑卒中患者提供一新治疗策略。
