FNA样本BRAF V600E基因突变检测对甲状腺结节定性诊断的应用价值
2021-10-28姜燕平荀延萍傅佳仪
姜燕平 荀延萍 傅佳仪
超声引导下进行细针穿刺细胞学检查(fine needle aspiration,FNA),为当前鉴别甲状腺结节最常用手段,具有准确性高、微创以及易操作等优点,但依然存在10%~40%的甲状腺结节难以经FNA 明确诊断[1]。BRAF V600E基因突变为目前报道最多的一种甲状腺乳头状癌(papillary thyroid carcinoma,PTC)突变类型。以往研究指出,BRAF V600E基因突变检测能够辅助细胞学诊断[2]。本文以98 个甲状腺结节FNA样本为实验对象,探讨甲状腺结节FNA样本检测BRAF V600E基因突变在良恶性定性诊断中的应用价值,以期为提高甲状腺结节诊断准确性提供有效途径应用依据。现报道如下。
1 临床资料
1.1 一般资料 选取2015 年1 月—2020 年2 月浙江大学医学院附属杭州市第一人民医院接受FNC检测的甲状腺结节患者98 例,其中男29 例,女69例,年龄25~72(46.83±8.65)岁,结节直径0.7~2.6(1.09±0.20)cm。
1.2 纳入及排除标准 纳入标准:(1)单个结节;(2)有FNA 指征[3]:①经过超声检查发现可疑恶性征象:病灶形态不规则,且其纵横比值超过1,边界显示不清,中央型血流,呈现极低回声以及微钙化;②病灶最大径超过0.5cm;③未合并全身器质性疾病或者出血性疾病等;(3)资料完整;(4)对研究知情,签署研究知情同意书。排除标准:(1)合并精神疾病;(2)伴凝血功能障碍;(3)具有其他肿瘤病史;(4)合并严重冠心病、高血压或者糖尿病等。
2 方 法
2.1 FNA 检查方法 FNA 前采取常规超声检查方式确定目标;对于手术治疗者,予以常规病理检查。
超声引导下FNA:指导患者处于仰卧位(穿刺体位),适当垫高颈部,保持头适当后仰,充分暴露颈部,常规探查甲状腺结节部位并定位于颈部体表,常规消毒、铺巾后,采取常规超声技术确定进针部位、具体角度与深度。手握探头的同时,适当固定加压,且以另一手持针进针,注意穿刺路线与超声探头表面长轴之间30°~40°。顺利进入目标后,在超声引导下用穿刺针分3 次穿入肿块内,并做到快速拔针,取出血性液体少许,仔细把针内容物推至相应玻片上涂片,并将其快速固定好,肉眼观察,判断所取标本是否足够,确认无误后予以细胞学病理检测。
细胞学病理诊断结果包括:(1)穿刺样本量较少;(2)考虑属于良性病变;(3)无法明确意义的病变;(4)诊断为嗜酸性肿瘤病变或滤泡性肿瘤病变;(5)可疑恶性肿瘤病变;(6)恶性肿瘤病变。其中(1)~(4)评估为细胞学阴性,(5)~(6)评估为细胞学阳性。BRAF V600E基因突变检测:选择福建厦门艾德人类BRAF基因V600E 突变检测试剂盒,采用荧光聚合酶链反应(polymerase chain reaction,PCR)法。引物序列如下:正义引物序列为5'-TCATAATGCTTGCTCTGATAGGA-3';反义引物序列为5'-GGCCAAAAATTTAATCAGTGGA-3',引物序列的设计、合成由上海生工生物工程技术服务有限公司负责。DNA抽提采用福建厦门艾德核酸提取试剂盒(型号:FFPE DNA),进行PCR 扩增后,可以将检测结果分为两种:野生型(未发现扩增信号,见图1)以及突变型(发现扩增信号,见图2)。

图1 野生型样本扩增曲线图

图2 突变型样本扩增曲线图
2.2 观察指标 以明确细胞学检查结果或常规病理诊断为“金标准”,观察BRAF V600E基因突变检测鉴别甲状腺结节良恶性敏感度、特异度及准确性。敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;准确性=(真阳性例数+真阴性例数)/总例数×100%;阳性预测值=真阳性例数/检出的总阳性例数×100%;阴性预测值=真阴性例数/检出的总阴性例数×100%。观察常规病理学诊断情况,分析BRAF V600E基因突变与PTC 临床特征关系。
2.3 统计学方法 应用SPSS 19.0 软件进行数据分析,计数资料以(%)表示,使用χ2检验;计量资料以均数±标准差(±s)表示,采用t 检验,P<0.05 为差异有统计学意义;采用Kappa 检验法进行一致性分析,中等一致性:Kappa 值范围为0.41~0.60,高度一致性:Kappa 值范围为0.61~0.80,几乎完全一致:Kappa值超过0.80。
3 结果
3.1 细胞学检查与常规病理结果 明确细胞学检查结果或常规病理诊断显示78 个PTC,20 个良性结节89.74%(70/78);PTC 显示BRAF V600E基因突变型10.26%(8/78),显示野生型。
3.2 BRAF V600E基因突变检测与金标准对照结果BRAF V600E基因突变检测诊断敏感度89.74%(70/78),特异度100.00%(20/20),准确性91.84%(90/98),阳性预测值100.00%(70/70),阴性预测值71.43%(20/28),Kappa 值0.78。见表1。
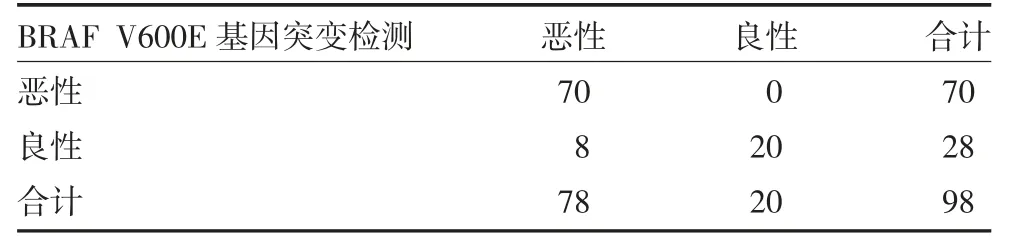
表1 BRAF V600E基因突变检测与金标准对照(例)
3.3 常规病理学诊断分析 细胞学病理检查无法明确结节8 个,经过手术常规病理检查,证实为4 例PTC(其中1 例为野生型,3 例突变型)与4 例良性结节(均为野生型)。
3.4 BRAF V600E基因突变与PTC 临床特征关系38 例PTC 予以手术治疗,并行常规病理检查(均显示PTC),其中30 例为BRAF V600E基因突变型,8 例野生型。突变型与野生型PTC 患者性别、年龄、甲状腺包膜侵犯率、中央区淋巴结转移率、桥本甲状腺炎发生率、肿瘤最大径比较差异无统计学意义(P>0.05)。见表2。

表2 BRAF V600E基因突变与PTC 临床特征关系
4 讨论
FNA 诊断范围受到细胞学形态限制,无法全面了解病变类型,故其检查结果依然存在一定不确定性。对于某些细胞学无法确诊甲状腺结节,一般恶性可能性为5%~10%,甚至可达50%~75%[4]。
研究表明,甲状腺癌BRAF基因相关突变位点里面,BRAF V600E 位点发生突变为当前最常见的一种变异表达形式,在各种BRAF 突变中,其比例高达95%[5]。BRAF V600E基因突变主要出现于经典型PTC,在滤泡癌以及髓样癌中较为罕见,且在甲状腺良性结节检测中未发现这种突变,故临床普遍PTC最常见,具有较高特异性的一种基因异常为BRAF基因突变[6-7]。文献报道,甲状腺结节FNA样本测定患者BRAF V600E基因突变情况,是术前PTC 特异性非常高的诊断手段[8]。本研究结果显示,BRAF V600E基因突变检测方式诊断甲状腺结节良恶性敏感度89.74%,特异度100.00%,准确性91.84%,Kappa 值高达0.78,与上述报道观点相符。说明BRAF V600E基因突变检测具有较高诊断准确性,与病理诊断几乎完全一致。对于FNA 中病理意义不明确甲状腺结节,若经BRAF V600E基因检测显示为突变型,则更益于PTC 诊断[9]。当前,以BRAF V600E基因突变情况和PTC 侵袭性关系为主要研究内容的报道结果争议较大。相关研究表明,BRAF V600E基因突变可预测PTC 存在侵袭性,包括肿瘤更高分期、出现淋巴结转移以及包膜侵犯等[10]。然而,亦有研究显示,BRAF V600E基因突变的发生和PTC 侵袭性之间没有显著相关性[11]。相关研究指出,相较于BRAF V600E基因野生型PTC,突变型PTC 患者甲状腺包膜侵犯出现率更高,但是在颈部淋巴结转移率方面不存在显著差异[12]。本研究中,突变型与野生型PTC 患者甲状腺包膜侵犯率、中央区淋巴结转移率以及桥本甲状腺炎发生率比较无显著差异,BRAF V600E基因突变检测并不能预测PTC 患者甲状腺包膜侵犯以及中央区淋巴结转移情况,与上述报道结果并不完全一致。可能与本次研究样本量较少,具有一定局限性有关。
综上所述,FNA样本检测BRAF V600E基因突变对于诊断甲状腺结节良恶性具有重要价值,然而其不能预测PTC 甲状腺包膜侵犯或者中央区淋巴结转移情况。
