伴有淋巴样间质的微结节型胸腺癌1例
2021-10-27毛文杰
毛文杰 李 斌
(兰州大学第二医院胸外科 兰州大学第二临床医学院,兰州 730030)
伴有淋巴样间质的微结节型胸腺癌(micronodular thymic carcinoma with lymphoid hyperplasia,MNC)[1~3]是一种极为罕见的胸腺上皮源性肿瘤,具有低度恶性行为,在临床工作中易被忽视。我科于2018年1月收治1例MNC,报道如下。
1 临床资料
患者男,54岁,因“体检CT发现纵隔占位1个月”于2018年1月8日入院。既往体健。胸部增强CT检查(图1):前上纵隔见类圆形软组织密度影,大小约2.4 cm×2.8 cm×2.2 cm,平扫CT值约35 Hu,轻度强化,边缘尚光整,边界较清晰,部分与周围脂肪组织界线模糊。余化验、检查未见明显异常。术前诊断为胸腺瘤。
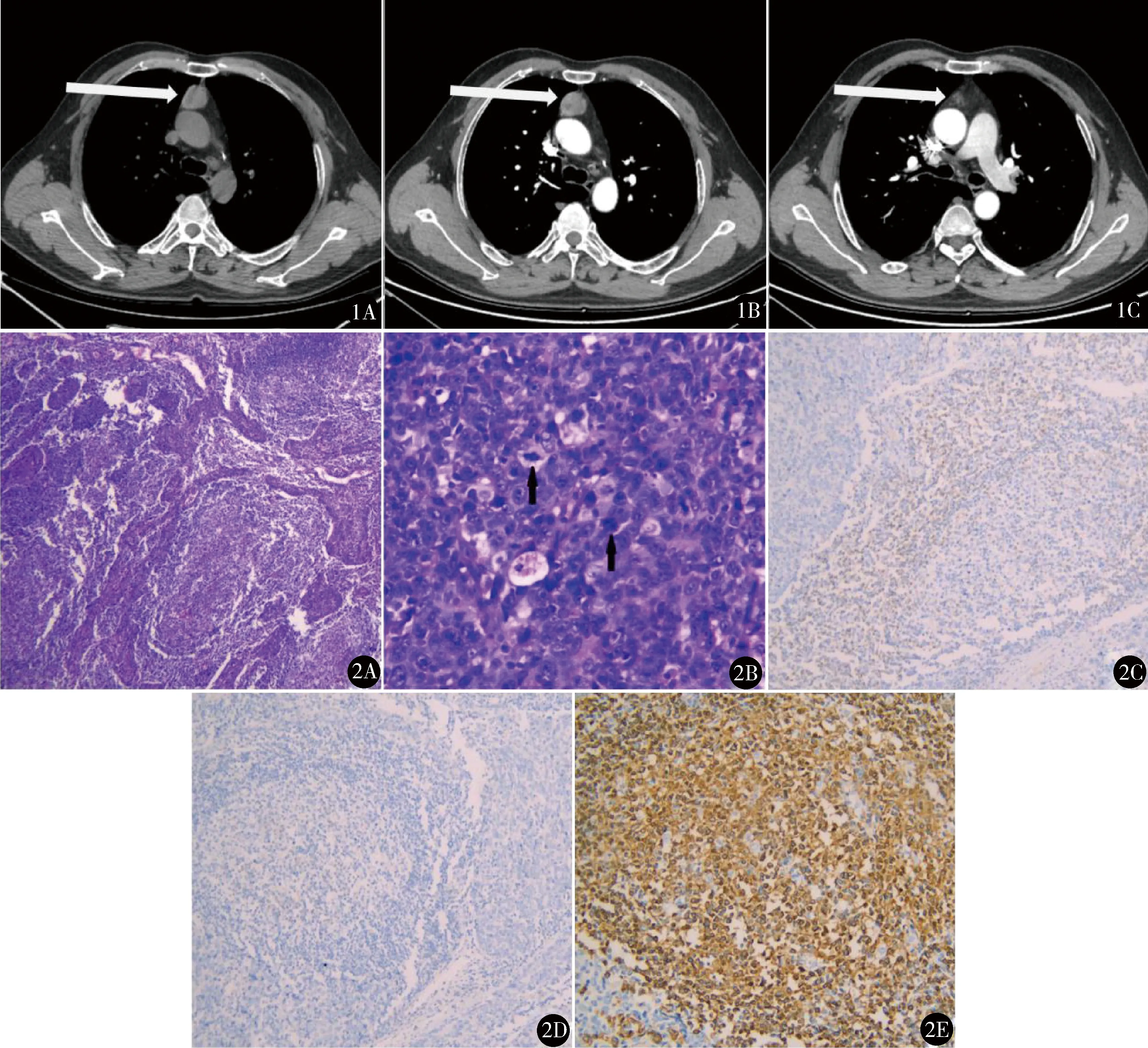
图1 CT示纵隔肿物:A.平扫示前上纵隔约2.4 cm×2.8 cm×2.2 cm类圆形软组织密度影,CT值约35 Hu;B.动脉期轻度强化;C.主肺动脉层面肿瘤与周围脂肪间隙模糊 图2 术后病理:A.高度异型的肿瘤细胞形成微结节、条索样或片状结构(HE染色 ×40);B.多个核分裂象肿瘤细胞(HE染色 ×400);C.免疫组化示淋巴滤泡中可见CD5+的成熟T淋巴细胞,但肿瘤细胞不表达CD5(×100);D.免疫组化示淋巴滤泡中未见TdT+的幼稚T淋巴细胞(×100);E.免疫组化示淋巴滤泡中主要为CD20强阳性的成熟B淋巴细胞(×200)
于1月19日在全麻下行经剑突下胸腔镜胸腺肿瘤扩大切除术。剑突下2 cm纵切口,左、右肋弓下缘0.5 cm切口,置入trocar,建立人工气胸。游离胸骨后间隙至胸廓入口,紧贴胸骨后游离纵隔胸膜至双侧胸廓内静脉,打开纵隔胸膜,暴露胸腔。探查见肿物位于前上纵隔升主动脉前方,表面胸膜光滑,包膜欠完整,可见部分侵犯周围脂肪,但未累及纵隔胸膜和心包,质硬,实性。沿双侧膈神经前缘、左右胸廓内静脉内侧缘仔细游离心包和气管前脂肪至甲状腺下缘,游离胸腺动静脉并使用Hem-o-lok钳夹阻断,沿膈神经向下分别清扫左右心膈角脂肪,彻底清扫上腔静脉、主动脉沟、无名静脉周围、主肺动脉窗及膈神经周围脂肪组织,完整取出标本。经右侧肋弓下腔镜操作孔放置胸腔引流管,由于已打开双侧纵隔胸膜,引流管放置在中纵隔兼顾双侧胸腔。手术时间180 min,术中出血量100 ml。术后病理:大体可见一切面灰白色结节样肿物,直径2.8 cm×2.5 cm×2.5 cm,实性,质脆。镜下境界清楚,部分区域侵入周围脂肪组织。实性区域见肿瘤细胞呈微结节状、条索样或片状分布,间质浸润大量淋巴细胞,其间可见多个淋巴滤泡(图2A)。肿瘤细胞以异形细胞为主,细胞大且呈多边形,胞浆丰富、嗜酸性,核仁突出,核分裂象易见(>10/10HPF),核浆比增大、异型深染,可见坏死,此外也可见少量短梭形细胞(图2B)。免疫组化(图2C~E):瘤细胞上皮膜抗原(EMA)强+,波形蛋白(Vimentin)+,细胞角蛋白(CK)5/6强+,CK7散在+,CK19强+,白细胞分化抗原(CD)5-,CD30-,CD117强+,P53散在+,Ki67阳性率约70%;T细胞CD3+,CD5+,CD1a-,末端脱氧核苷酸转移酶(TdT)-;B细胞CD20强+。提示:伴有淋巴样间质的微结节型胸腺癌。分期:Masaoka Ⅱb期。术后第1天低热,最高体温37.6 ℃,物理降温后恢复正常,术后第4天拔出引流管,第5天出院。术后1个月于我院放疗科行调强放疗(IMRT)一个疗程40天,临床靶区(CTV)为术区及高危区,计划靶区(PTV)为CTV+0.5 cm,放疗剂量PTV 60Gy/2Gy/30f,治疗过程顺利。门诊定期随访,恢复良好,术后2年半(2020年7月31日)复查胸部增强CT无复发。
2 讨论
胸腺上皮性肿瘤形态多样,成分复杂,往往与成熟度不同的T淋巴细胞浸润有关。而伴有大量B淋巴细胞聚集并形成生发中心的胸腺肿瘤极为少见[2]。MNC于1999年[4]首次报道,并由Weissferdt等[1]命名。MNC的发病率尚无报道,文献[1~8]显示该病好发于中老年人群,男性略多于女性。大部分患者无明显临床症状,因不相关疾病检查时偶然发现,肿瘤较大压迫邻近器官会出现胸痛、呼吸困难等症状。胸腺瘤患者多伴有自身免疫性疾病或其他部位肿瘤史[9,10],而这种情况在MNC患者中较少见[2,5,8]。MNC的影像学表现不具有特异性,明确诊断有赖于病理特征和常见纵隔肿瘤的排除性诊断。本例54岁男性,体检发现前上纵隔占位,无任何症状,无特殊病史。
MNC的病理诊断复杂,需与其他纵隔肿瘤相鉴别,如A/AB型胸腺瘤、伴有淋巴样间质的微结节型胸腺瘤(micronodular thymoma with lymphoid stroma,MNT)[11]、淋巴上皮瘤样胸腺癌、恶性肿瘤纵隔淋巴结转移、转移性肉瘤等肿瘤细胞可呈微结节生长模式或间质中有大量B淋巴细胞聚集的肿瘤,因此镜下肿瘤细胞形态及免疫组化染色是诊断的重要手段。具有恶性细胞学特征的肿瘤细胞呈微结节型生长模式,其间含有大量生发中心的突出淋巴间质是MNC的典型病理特征,此外,肿瘤细胞也可聚集成片状、索状等结构,而免疫组化染色中的CD3、CD5、CD20、CD117及TdT等分子标志物有助于MNC的诊断和鉴别[7,8]。本例术前诊断胸腺瘤,术后病理示肿瘤细胞高度异形并呈特殊的生长模式,免疫组化可见间质浸润大量淋巴细胞并形成生发中心,结合HE染色与免疫组化可诊断为MNC。
由于MNC极为罕见,目前针对该病尚无规范的诊疗方案及指南。MNC的治疗可参考其他常见胸腺癌[12],首选手术切除,术后治疗依肿瘤分期而定。对于Ⅰ期完整切除的肿瘤可单纯进行密切随访,而Ⅱ~Ⅳ期或不能完整切除者,术后可行辅助放疗±化疗并密切随访[13]。本例术前CT疑似Masaoka Ⅱb期,故选择创伤小,视野广,最重要的是可以彻底清除胸腺及其周围脂肪的经剑突下胸腔镜胸腺肿瘤扩大切除术[14,15]。术后确认为Ⅱb期,故建议术后放疗。然而,对于完整切除的MNC是否需要术后放疗或者化疗还需要更多的临床研究以及长期随访观察[7]。虽然MNC表现出一定的恶性行为,但预后较其他类型胸腺癌好。研究[1,5]认为该肿瘤良好的预后与其间质中大量增生的淋巴细胞有关,这可能表示宿主对肿瘤细胞产生了一定的免疫反应。因此,我们建议对MNC进行相对积极且较长时间的术后随访。本例术后定期随访3年,未见肿瘤复发,预后良好,但需进一步观察。
总之,MNC发病率较低且病理复杂,极易与其他类型胸腺肿瘤相混淆而导致后续治疗方案的误判,所以临床及病理医生应掌握其典型的临床病理特征,从而制定正确的治疗方案和随访计划。
