Nrf2/HO-1通路及氧化应激介导的及己地上部分醇提取物致大鼠肺毒性研究
2021-10-27朱恩泽孙淑萍吴晨光李安琪杜云艳谢先进
朱恩泽,孙淑萍,吴晨光,李安琪,孙 琪,杜云艳,谢先进
及己(Chloranthus serratusRoem.et Schalt.)为金粟兰科金粟兰属植物,通常以根、全草或地上部分入药.它具有解毒消肿、活血化瘀、祛风止痛、抗菌消炎、通筋活络的功效,可以治疗跌打损伤、疖肿等症.研究证实,及己有明显的抗炎活性[1−2],但同时具有毒性,服用过量的及己会导致患者手足抽搐、呕吐、结膜充血等,甚至出现死亡[3].尚不清楚及己何种部位在保持良好治疗效果的同时毒性较小.前期实验结果显示,及己根、茎、叶醇提取物的心脏毒性作用机制可能与激活脂质过氧化物酶有关[4].通过比较及己根和雷公藤诱导的大鼠肺毒性大小发现,及己水提取物可能通过激发氧化应激并调控Nrf2/HO−1通路诱导肺毒性[5].张武等研究表明,因及己中毒死亡的小鼠经肉眼观察肺组织有淤血水肿.光镜下,肺组织和毛细血管出现淤血扩张、灶性出血及局部肺水肿的症状,且部分肺泡腔内可见蛋白性液体[6].以上均表明,及己具有肺毒性,但是其与剂量的相关性尚无明确的定论.
多项研究均表明及己对多种脏器有毒性[7],其中,最易受损的是肺组织,因为它是含氧量最多的器官,所以最易受内源性和外源性氧自由基损伤[8].因此,在肺组织中发生的氧化损伤可能是大鼠发生肺损伤的首要原因.未见文献报道及己地上部分醇提取物高低剂量致肺毒性是否呈剂量依赖性,且其毒性机制尚不明确.中草药的合理利用受到国内外多数学者和专家关注,中药确有良好的治疗作用,但其临床应用一直受其毒性限制,成为中药合理利用的一道难题.因此,当开发和合理利用中药时,我们必须对其毒性进行研究.
目前比较明确的中药毒性机制为机体产生的氧自由基参与氧化应激反应从而对机体产生毒性[9].在氧自由基产生和消耗达到平衡时,机体能够维持正常的生理状态,这种平衡一旦被打破,就会诱发氧化应激损伤.一般情况下,肺能够清除体内氧自由基,使其产生和清除保持恒定,是因为肺细胞内含有许多具有较好的氧自由基清除功效的酶参与氧自由基的清除,并抵抗氧自由基造成的肺组织损伤[10].和氧化应激直接相关的指标为总超氧化物歧化酶(T−SOD)、脂质过氧化产物−丙二醛(MDA)、谷胱甘肽(GSH)、过氧化氢酶(CAT)等.
本实验初步考察了及己地上部分醇提取物的肺毒性大小,并初步探讨了其毒性机制,为及己安全合理应用于临床提供了参考依据.
1 材料与方法
1.1 实验药物
及己采收于广西玉林,经皖南医学院朱建华教授参考《中药大辞典》及中国植物图谱数据库鉴定为真品,常温干燥保存.
1.2 动物
Sprague−Dawley(SD)大鼠(清洁级雄性),体重200±10 g,从青龙山动物场获得,批准文号:19−014.饲养条件:温度24~26℃、相对湿度40%~60%、通风且每天光照12 h、自由摄食和饮水,适应性喂养一周后用于实验.
1.3 试剂
GSH(批 号:20190615)、CAT(批 号:20190614)、T−SOD(批号:20190613)、MDA(批号:20190616)试剂盒均购自南京建成生物工程研究所;BCA蛋白浓度测定试剂盒(批号:020817170505)、BeyoECL plus化学发光试剂盒(批号:030519190603)均购自Beyotime Biotech⁃nology;Mouse Anti−β−Actin(批号:66240−1−LS)、Goat Anti−Mouse IgG(批 号:BST12F21C50)、Rabbit Anti Nrf2(批号:16396−1−AP,美国Pro⁃teintech公司)、Rabbit Anti HO−1(批号:ZP10 39BP39)、Goat Anti−Rabbit IgG(批 号:BST12 L05A54)、免疫组化三步法试剂盒(批号:12H25C)均购自BOSTER Biological Technology Co.Ltd.
1.4 仪器
高速冷冻离心机(安徽嘉文仪器装备有限公司);Amersham Imager 600超灵敏多功能成像仪(General Electric Company);伯乐电泳仪(Bio−Rad)(上海启步生物科技有限公司);EPOCH全波长酶标仪(深圳山特电子有限公司);CKX3OLYMpUS显微镜(昆山诺普森实验室用品科技有限公司);日立U−5100分光光度计(日本日立有限公司)等.
1.5 方法
1.5.1 提取物的制备
将及己地上部分洗净、干燥、粉碎至粗粉并称取适量,用12倍量75%乙醇浸泡0.5 h,回流提取1.5 h;然后依次用10倍、8倍75%乙醇分别回流提取1.0 h,每次抽滤、合并3次滤液,蒸发浓缩至无醇味且呈粘稠状,真空干燥,粉碎并过80目筛,得提取物,计算提取物得率.得率(%)=提取物重量/药材粗粉重量×100%.
1.5.2 紫外指纹图谱分析
称取0.05 g及己地上部分醇提取物,用75%乙醇溶解配制成1 mg·mL−1的样品溶液.用75%乙醇进行空白校正,在以下光谱条件下用紫外分光光度计扫描样品:扫描范围为190~500 nm;扫描速 度为400 nm·min−1;采样间隔为1.0 nm.
1.5.3 急性毒性实验
实验开始前,按照文献中折算表确定剂量[6],最终确定大鼠日给药量(及己地上部分醇提取物质量,g·kg−1)=成人日服量(3 g)×0.018(换算系数)×醇提取物得率×倍数(DC低组:50倍;DC高组:100倍)×5,即得DC低组、DC高组剂量分别为1.58 g·kg−1、3.16 g·kg−1.选取2只大鼠灌胃给予高剂量的2.5倍(7.90 g·kg−1),在48 h内观察大鼠的形态变化及存活情况等.
1.5.4 动物分组与给药
取24只雄性SD大鼠按随机数表法随机均分为:空白组(KB)、DC低组(50倍)、DC高组(100倍),每组8只.将提取物用0.5%羧甲基纤维素钠溶液配制均匀后灌胃给予大鼠对应剂量,KB组给予相同量的0.5%羧甲基纤维素钠溶液,14天内每日按时灌胃1次,于第15天处死.
1.5.5 大鼠一般状况的观察及其脏器指数的计算
实验期间,每日定时监测大鼠的饮食、活动,记录皮毛、色泽等变化情况.每隔2日称量一次大鼠体重.于第15天,用20%乌拉坦溶液按照5 mL·kg−1的剂量麻醉大鼠后摘除眼球取血,并颈椎脱臼处死后迅速解剖取出大鼠肺.用分析天平称重,于−80℃保存备用并计算脏器指数.脏器指数(%)=脏器重量/体重×100%.
1.5.6 肺组织匀浆中T-SOD、MDA、GSH和CAT含量测定
取出−80℃保存的肺组织,室温复温,剪下适宜大小称重,置于手动匀浆器中,加入9倍体积的生理盐水,冰水浴条件下手动匀浆,以12 000 rpm条件低温离心15 min,收集上清液,分别按照试剂盒说明书来测定T−SOD、MDA、GSH和CAT的含量.
1.5.7 肺组织病理学观察
取适量肺组织,用10%甲醛溶液固定,用脱水剂脱水,石蜡包埋,用切片机切片、于载玻片贴片、脱蜡复水,用苏木素−伊红(HE)染液染色后,置于光学显微镜下查看并评估各组肺组织病理学改变,并从以下三项进行病理学损伤评分[11]:①肺毛细血管充血、肺内出血;②炎性细胞在血管壁及肺间隙集聚或浸润;③肺泡壁增厚.每项有5个评分,其中无损伤为0分,损伤达观察视野的25%为1分,损伤达观察视野的50%为2分,损伤达观察视野的75%为3分,整个视野弥漫性肺损伤为4分.取各项评分之和为总评分.由不了解本实验设计的专业病理医生进行肺损伤评分.
1.5.8 免疫组化法检测ICAM-1的表达水平
将1.5.7步骤中制作的切片,经脱蜡后依次于100%、95%、85%、75%和50%的酒精中复水、灭活酶、抗原热修复、正常血清封闭、清洗、一抗4℃孵育过夜、二抗孵育1 h、滴加SABC、DAB显色、苏木素复染、脱水、透明、封片等,于显微镜下观察拍照,用Image J统计得出阳性表达值并定量分析.
1.5.9 Western blotting检测Nrf2和HO-1蛋白的表达情况
取适量肺组织于EP管中,向管中加入裂解液(RIPA和PMSF比例为100∶1)于冰上研磨匀浆,在4℃下,以12 000 rpm条件用离心机离心20 min,取上清液为样品,加上样缓冲液(5×),于沸水中加热变性.将蛋白用凝胶电泳进行分离,转移至NC膜.用5%脱脂牛奶封闭,清洗后继续4℃孵育一抗(β−actin、Nrf2、HO−1)过夜,然后孵育二抗1 h,加入现配的ECL显影液曝光显影,用Image J得出条带的灰度值,取对应比值(目的蛋白/内参灰度值)进行统计分析.
1.5.10 统计学方法
2 结果
2.1 紫外指纹图谱
从样品的全波长扫描光谱可以看出,及己地上部分醇提取物的主要吸收范围为190~350 nm.及己地上部分醇提取物在292 nm、268 nm、266 nm、247 nm、235 nm、232 nm和190 nm处均有吸收峰,在可见光范围内没有干扰.见图1.

图1 及己地上部分醇提取物的紫外指纹图谱
2.2 急性毒性实验结果
在灌胃剂量高达7.90 g·kg−1时,未出现大鼠死亡的现象,这表明DC的LD50高于7.90 g·kg−1.因此,最终以1.58 g·kg−1、3.16 g·kg−1评估DC诱发大鼠肺毒性大小.
2.3 对各组大鼠一般体征的影响
KB组大鼠饮食正常,毛密、有光泽,活动状态均正常,反应敏捷.DC低组大鼠皮毛无光泽,活动和饮食均略微减少,反应迟钝;DC高组皮毛暗淡无光,有脱落,皮毛质感粗糙,饮食明显减少,出现嗜睡、精神萎靡的状态.
2.4 对各组大鼠体重变化的影响
给药期间,KB组大鼠体重正常升高;与KB组相比,DC低组和DC高组体重变化率明显降低(p<0.05或p<0.01),且DC高组降低程度更明显,见图2.
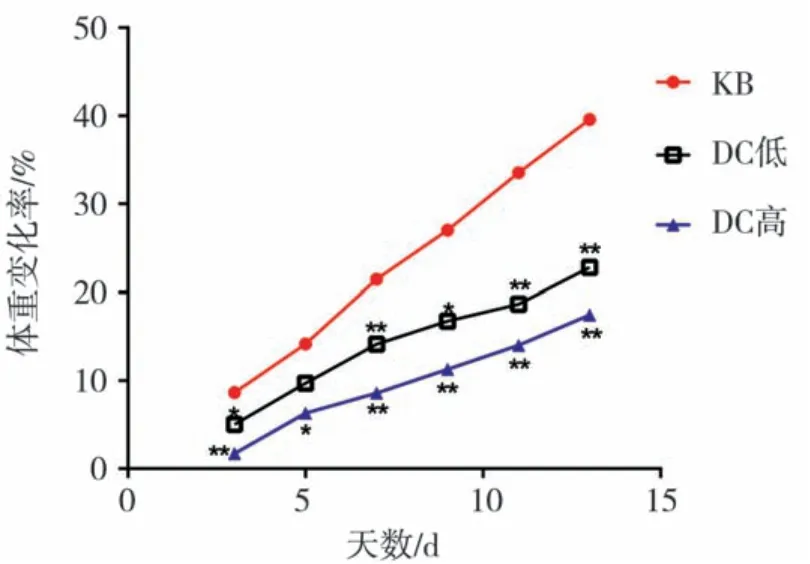
图2 各组大鼠体重变化率曲线
2.5 对各组大鼠肺形态的影响
KB组肉眼观察可见肺表面呈淡粉红色且十分光滑,触摸比较后发现其具有良好的弹性,未见其他异常;DC低组肺表面局部有少量出血点,弹性尚可;DC高组肺表面有多个明显的出血点,整个脏器呈深红色,弹性远不及KB组,边缘有明显钝化,见图3.

图3 各组大鼠肺形态
2.6 对各组大鼠肺指数的影响
连续灌胃给药14天后,DC低组、DC高组的肺指数较KB组略微增加,无统计学意义(p<0.05),见图4.

图4 及己不同部位醇提取物对大鼠肺指数的影响
2.7 对各组大鼠肺匀浆指标T-SOD、MDA、GSH和CAT含量的影响
与KB组相比,DC低组四个指标含量变化均不显著(p>0.05);DC高组CAT水平较KB组显著性降低(p<0.05).DC高组与KB组、DC低组相比,MDA水平极显著性升高(p<0.01),GSH水平和CAT水平显著性降低(p<0.05),见表1.
表1 对不同组SD大鼠肺匀浆指标的影响(±s,n=8)

表1 对不同组SD大鼠肺匀浆指标的影响(±s,n=8)
注:与KB组相比,*表示p<0.05,**表示p<0.01;与DC低组相比,#表示p<0.05,##表示p<0.01.
组别KB组DC低组DC高组T−SOD/(U·mg−1)98.84±1.34 96.25±1.11 83.33±1.53**##MDA/(nmol·mg−1)1.08±0.06 1.31±0.05 2.04±0.33**##GSH/(µmol·g−1)4.50±1.29 4.21±0.45 2.52±0.24*#CAT/(U·mg−1)4.31±0.39 4.08±0.26 3.67±0.18*
2.8 对各组大鼠肺组织病理形态学的影响
KB组肺泡组织结构完整,大小正常,未见炎细胞浸润,肺泡腔未见扩大异常,间质无明显水肿,未见明显充血情况;DC低组在支气管周围有炎细胞浸润,肺泡结构不规则,间质有出血现象,血管周围出现脂肪变态反应;DC高组支气管四周有明显炎细胞浸润,管壁纤维排列紊乱呈锯齿状增生,血管壁出现纤维淀粉样变性,肺泡结构不规则,肺泡腔明显缩小,肺泡壁增厚,有出血现象.DC高组较DC低组病理评分显著升高(p<0.01),见图5.
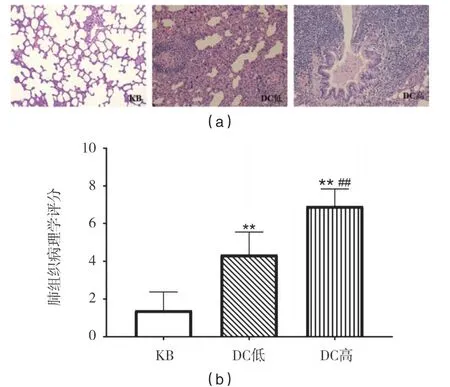
图5 各组大鼠肺组织HE染色(×200)和病理学评分
2.9 对各组大鼠肺组织中ICAM-1阳性表达水平的影响
当机体内出现炎性症状时,ICAM−1以在细胞膜及细胞浆表达为主,镜下观察呈棕黄色颗粒.与KB组相比,DC高组、DC低组ICAM−1阳性表达极显著性增多(p<0.01).与DC低组相比,DC高组ICAM−1阳性表达也极显著性增加(p<0.01).见图6.
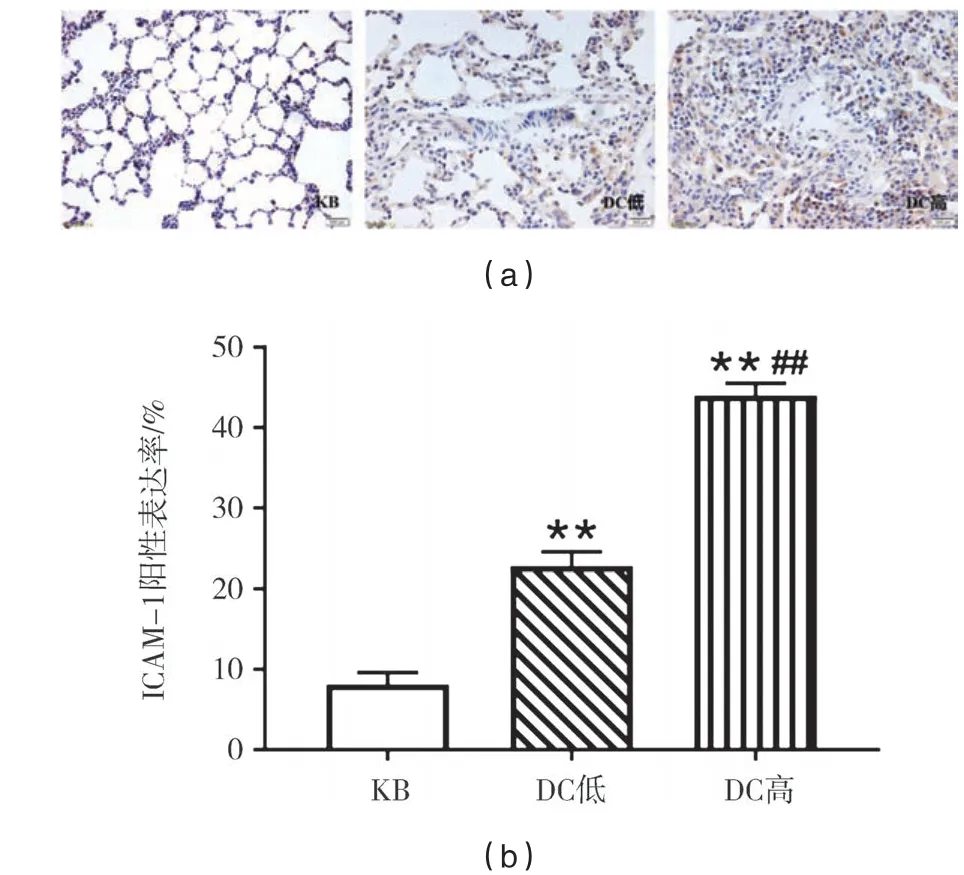
图6 各组大鼠肺组织ICAM-1阳性表达(×200)及表达率
2.10 对各组大鼠肺组织中Nrf2/HO-1蛋白表达的影响
与KB组相比,DC低组HO−1蛋白表达量显著性下降(p<0.05),Nrf2蛋白表达极显著性下降(p<0.01),DC高组Nrf2和HO−1蛋白表达量均极显著性下降(p<0.01).与DC低组相比,DC高组Nrf2和HO−1蛋白表达量极显著性下降(p<0.01),见图7.
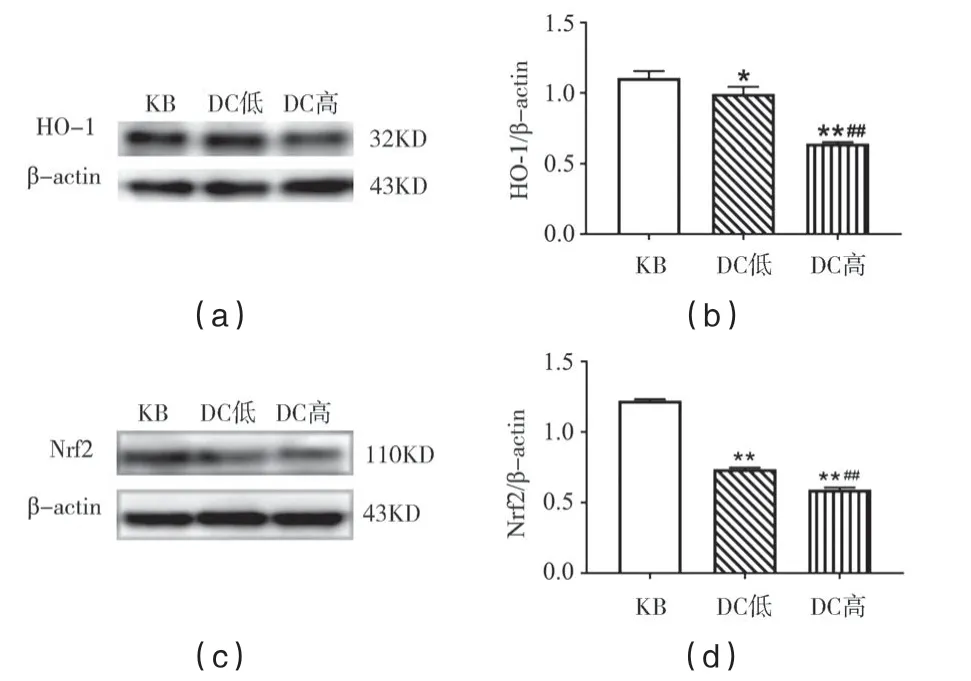
图7 各组大鼠肺组织中HO-1/Nrf2表达
3 讨论与结论
MDA可导致细胞异常坏死,具有细胞毒性[12],能反应细胞对自由基的清除程度与细胞膜脂质过氧化损伤的程度[13].GSH是机体抗氧化剂和细胞保护剂,可清除自由基的同时抗脂质过氧化损伤[14].SOD可转化超氧自由基为过氧化物,过氧化物进一步被CAT分解,形成抗氧化防御系统,起到减轻损伤的作用[15].当SOD含量降低时,细胞清除自由基能力减弱,此时细胞处于过氧化损伤状态[16].CAT和SOD为机体内的保护酶,其含量变化常被用作判断损伤程度的指标[17].本实验中,及己地上部分醇提取物能使肺匀浆中SOD、GSH和CAT含量明显下降,MDA含量明显上升,且DC高组比DC低组变化程度更大.可初步判断及己地上部分醇提取物引起的肺毒性与氧化应激有关,且DC高组影响的水平要高于DC低组,这可能和剂量有一定的相关性.
ICAM−1可辅助机体进行免疫防御调整,促进炎症部位的黏连,使白细胞到达炎症部位,增强炎症细胞与内皮细胞的黏附作用.在肺组织有炎性症状时,其含量明显增加,是肺组织细胞是否受损的判断指标之一[18].本实验中,及己地上部分醇提取物能上调ICAM−1的阳性表达,且DC高组上调ICAM−1的表达比DC低组更明显,说明DC高组的肺毒性要高于DC低组.
Nrf2/HO−1参与机体抗氧化的调整,在生理条件下,Nrf2以结合物形式存在,没有活性;但受到氧化应激刺激,Nrf2解离且核转位增多,启动多种抗氧化基因的表达,增强抗氧化作用,并减轻自由基所导致的脏器损伤[19].HO−1具有抗氧化、消炎、抑制细胞凋亡等作用,在机体受到有害刺激时起到保护细胞免受损伤的作用[20].当机体受到氧化应激等刺激时会增强HO−1蛋白表达水平来保护自身,但长时间受有毒物质刺激时,机体内HO−1表达水平会降低[21].本实验中,与KB组相比,DC高组、DC低组Nrf2、HO−1蛋白表达量明显下降,且DC高组下降更明显,表明及己DC高组、DC低组均给大鼠肺组织造成一定程度的氧化应激损伤,其中DC高组肺毒性尤为突出.
以上研究结果表明,及己地上部分醇提取物呈剂量依赖性地激发氧化应激,调控Nrf2/HO−1信号通路,导致肺组织损伤,表现为肺组织中的ICAM−1阳性表达升高.目前对及己根、茎、叶的醇提取物已进行体内抗炎作用及其对大鼠心、肝、肺、肾毒性的比较研究,结果发现,其中及己根的醇提取物毒性最小且抗炎效果最好[2,4].
综上可知,及己的地上部分不是较好的用药部位,及己根才是较好的用药部位,可以作为进一步开发研究的目标,有望从中提取出单体抗炎成分,为及己的合理开发利用提供理论依据.
