低剂量双酚A影响哺乳动物神经发育研究现状及争议
2021-10-26董梦琦秦占芬
吕 琳,董梦琦,秦占芬*
低剂量双酚A影响哺乳动物神经发育研究现状及争议
吕琳1,2,董梦琦1,2,秦占芬1,2*
(1.中国科学院生态环境研究中心,环境化学与生态毒理学国家重点实验室,北京 100085;2.中国科学院大学,北京 100049)
为全面认识低剂量BPA(双酚A)对哺乳动物神经发育的影响,本文从中国知网、PubMed和Web of Science 3个数据库中获取了国内外关于低剂量BPA影响哺乳动物神经发育的研究报道,并使用toxR工具对其可信度进行评估,最终筛选获得26项相关研究;从美国食品药品监督管理局(FDA)工作网站上获取最新BPA毒性报告1篇.通过比较分析这些研究,发现大部分研究报道低剂量BPA暴露导致哺乳动物神经行为、特定脑区内组织学结构和细胞特征、神经递质和激素稳态、脑中关键基因表达以及表观遗传特征发生改变.但是,就导致的神经行为的改变而言,一些研究的结果并不一致甚至有诸多矛盾之处.这些不一致的结果可能与动物实验设计的差异有关,其中神经行为测试的质量控制和统计方法中统计单元的选择对于研究结果的影响尤其值得关注.总之,从目前的文献来看,低剂量BPA对哺乳动物神经发育的影响尚待进一步的确认.
双酚A;脑发育;发育神经毒性;行为测试;质量控制
双酚A(BPA)为高产量化学品,主要用于合成聚碳酸酯、环氧树脂等高分子材料,后者用来制造各类消费品,如食品容器或者食品容器的内涂层.另外,单体的BPA在热敏纸、化妆品、个人护理品、衣物、玩具等消费品中也有应用.通过日常使用接触这些消费品、摄入被污染的食物等途径,普通人群每天持续暴露BPA,据估算BPA的日摄入量在0.01~ 4.5μg/kg体重.因此,在血液、尿液、胎盘、母乳等人体样品中普遍有BPA存在[1-3],血清中浓度甚至可达mmol水平[4].因此,BPA的毒性效应和健康影响一直受到关注.
神经毒性研究报道,哺乳动物发育过程中暴露BPA会导致其在后期出现神经行为异常,且伴随关键脑区细胞和分子特征的改变[5-7].同时,有人群流行病学调查数据显示,儿童焦虑、注意力缺陷等神经行为的异常与母亲孕期尿液中的BPA浓度相关[8],这些人群数据为动物实验结果提供了支持.为此,一些研究人员主张BPA具有神经发育毒性,应该加强监管.但是,来自化学品监管部门的数据认为,低剂量的BPA没有包括发育神经毒性在内的明显的毒性效应.当综合评估BPA毒性效应的已有文献时,监管部门依旧坚持认为,虽然有数据提示BPA具有潜在的发育神经毒性及其他毒性的风险,但同时存在不一致的结果,需要进一步的研究[9].尽管如此,本着预防的原则,目前加拿大、美国、欧盟等一些国家或地区已经禁止了BPA在婴儿奶瓶中使用,但更多的产品中仍然有BPA的大量使用.
为全面认识BPA发育神经毒性研究现状,探讨科学界、监管界关于BPA安全性争议的原因,有必要对相关文献进行系统分析.本文在中国知网、PubMed及Web of Science数据库中,以“双酚A& 神经发育毒性/脑/行为”或“bisphenol A & Developmental neurotoxicity/brain/behavior”为关键词进行检索,以美国食品药品监督管理局(FDA)规定的每日容许摄入量(ADI)50μg/kg·bw/天为标准[10],筛选关注该剂量或低于该剂量的BPA哺乳动物神经发育毒性相关文献.为了确定所得文献的可信度,使用ToxR工具[11]对所得文献进行评估,最终获得26篇符合标准的文献(见表1).其中,有6篇文献缺少对实验动物只数的表述,但在综合评估其文献内容后,认为其结果较为可信,可以用于文分析讨论.此外,从美国食品药品监督管理局(FDA)工作网站上获取最新BPA毒性报告1篇.在此基础上,本文综述BPA对哺乳动物行为、脑组织中细胞行为、脑中关键效应分子、脑中关键基因表达以及表观遗传修饰的影响相关报道,并对部分研究结果存在差异的原因进行讨论.
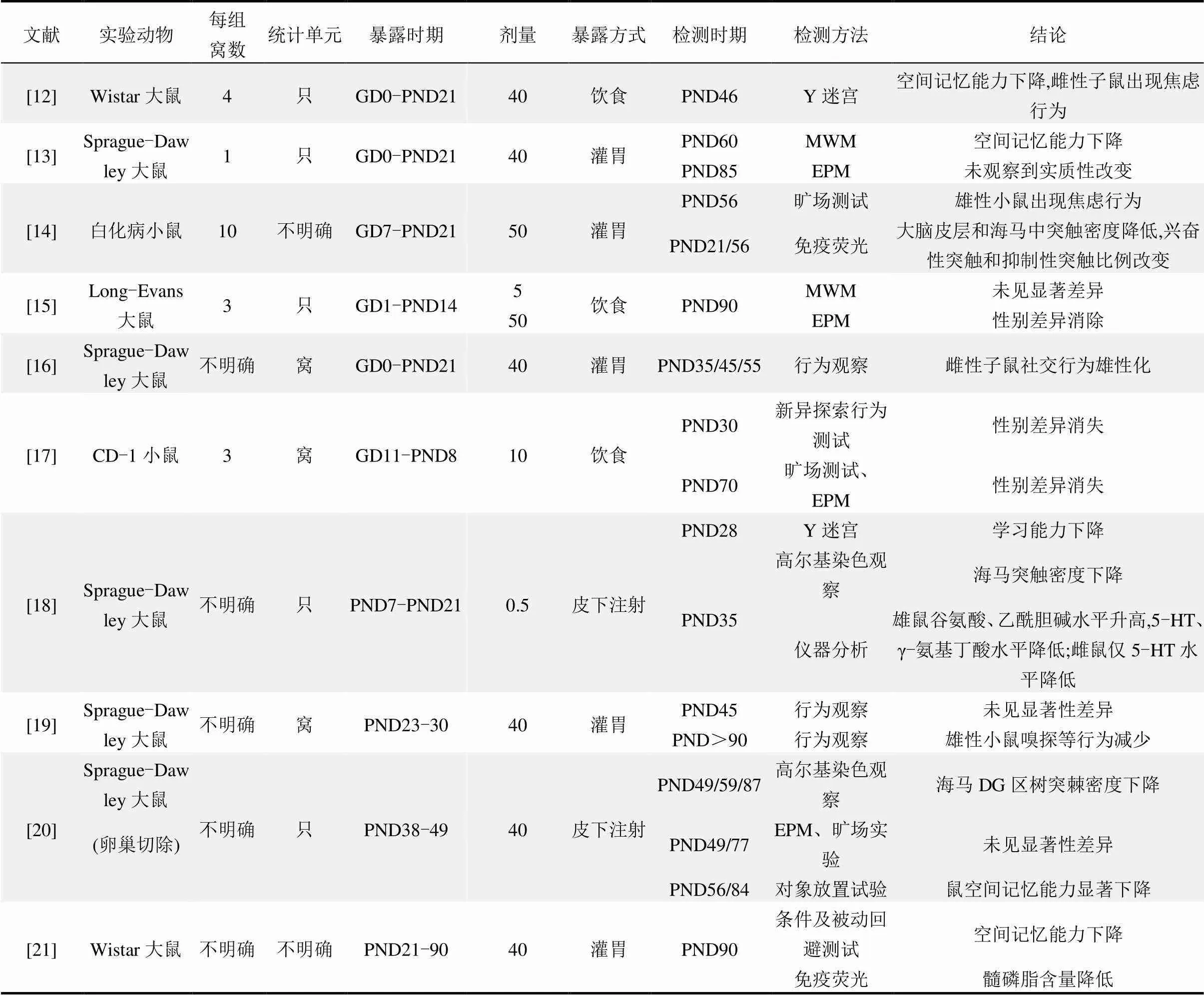
表1 低剂量双酚A暴露对哺乳动物神经发育的影响

续表1
注:表中暴露剂量单位均为μg/(kg·d);GD表示妊娠天数,PND表示产后天数.
1 低剂量BPA哺乳动物发育神经毒性研究现状
1.1 低剂量BPA对哺乳动物神经行为的影响
神经行为异常是化学品神经发育毒性的直观效应之一.一些动物研究显示,发育过程中接触低剂量BPA会导致动物行为学指标发生改变.孕期-哺乳期是哺乳动物脑发育的关键时期,所以几个研究集中在这一时期对孕鼠进行低剂量BPA持续暴露,待子鼠进入青春期或成年后对其进行行为学测试. Change及其团队通过灌胃方式对Sprague- Dawley大鼠进行了40μg/(kg·d) BPA暴露,将其子鼠饲养至成年,发现BPA暴露组的子鼠在莫里斯水迷宫试验(MWM)中逃脱时间增长,指示子鼠空间记忆能力受损[12].Poimenova等[13]则令Wistar大鼠在这一时期通过饮食途径摄入相同剂量BPA,对子鼠进行Y迷宫训练试验,发现其进入新异臂的次数显著减少,这同样指示了空间记忆能力的损伤.除此之外,Chang的团队还发现雌性子鼠同时出现了焦虑样行为,这表明BPA还使动物出现了情绪异常[12].类似地,Kumar等人对小鼠进行50μg/(kg·d)剂量的BPA灌胃,在旷场试验中发现雄性子鼠出现焦虑样行为,雌性子鼠却未出现明显的焦虑反应[14].Jones等[15]则在Long-Evans大鼠的食物中加入BPA,使其摄入剂量为5μg/(kg·d),然后在高架迷宫(EPM)中分别观察雌性子鼠和雄性子鼠的表现,发现BPA消除了两性子鼠在EPM中表现的性别差异,这可能指示了BPA对动物焦虑反应性别差异的影响.另外,Dessi- Fulgheri等[16]还观察到了雌性子鼠社交等行为的雄性化.这些研究均认为,孕期-哺乳期持续接触BPA会导致子鼠出现神经行为的异常,且部分影响可能是性别相关的.
除孕期-哺乳期持续暴露外,仅在发育过程中某一阶段接触BPA的子鼠也出现了行为学指标的改变.Gioiosa等[17]在围产期通过饮食途径对母鼠进行10μg/(kg·d)的BPA暴露,发现其子鼠在新异性探索行为测试、旷场测试以及EPM中的性别差异消失. Zhang等[18]则在哺乳期对母鼠进行了0.5μg/(kg·d)的BPA皮下注射后,同样观察到子鼠在Y迷宫中表现出空间记忆能力的下降.另外,有四项研究分别在青春期对子鼠进行了40μg/(kg·d) BPA暴露.其中, Della Seta等[19]观察了雄性子鼠性成熟后的生殖行为,发现其嗅探行为减少,Bowman团队[20]通过对象放置试验发现子鼠的空间记忆能力下降,Tandon等[21]通过条件及被动回避测试得到了同样的结论. Xu等[22]则在旷场试验、EPM和MWM中观察到了子鼠多种行为的性别差异消除[22].这些研究均显示,BPA在关键发育阶段暴露对动物神经行为产生了影响.
值得注意的是,尽管上述研究中都出现了某些行为学测试的阳性结果,但是也存在某些阴性的结果,尤其在这些研究之间,存在诸多矛盾之处(表2).Ferguson等[23]在孕期哺乳期对母鼠进行了一系列浓度的BPA灌胃,在旷场试验、迷宫试验中均未观察到BPA对子鼠行为产生任何显著影响;Rebuli团队[24]以同样的方案进行暴露,在EPM中也未观察到BPA的影响.同样使用MWM和EPM进行测试时,使用灌胃方法进行暴露的Chang团队[13]观察到BPA影响了鼠在MWM中的表现,但未影响其在EPM中的行为,而使用饮食暴露的Jones[15]却观察到了完全相反的现象.Poimenova等[12]的实验中,雌性小鼠出现焦虑样行为,Kumar等[14]的研究却显示雄性小鼠出现焦虑、雌性小鼠无显著性差异.另外, Xu报道了青春期BPA暴露会导致鼠出现社交行为改变[22],但Della Seta等[19]却未观察到这一现象.
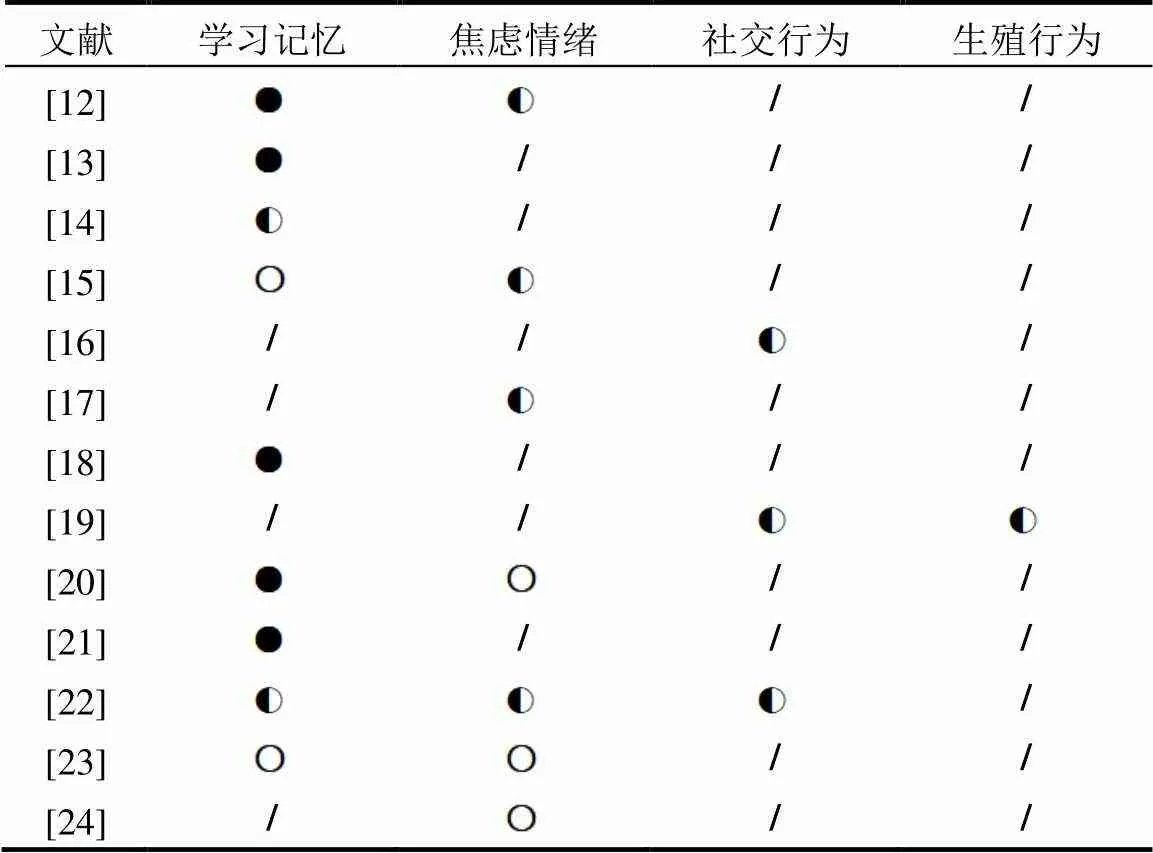
表2 低剂量BPA暴露对哺乳动物行为影响的实验结果差异

总体来说,已有研究显示BPA对动物神经行为存在潜在的影响,但目前并未得到一致的结论,其具体效应仍需进一步研究.
1.2 BPA对哺乳动物特定脑区内组织学结构和细胞特征的影响
除神经行为学指标外,脑组织形态以及其中细胞特征也是指示脑发育的重要指标.神经元突触是神经系统中的功能单位,其数量与形态的正常与否指示了脑发育过程是否受到干扰.海马是脑中负责记忆、学习功能的主要结构,其中神经元形态是评价化学品神经发育毒性的指标之一.Kimura等[25]在GD8-18对孕鼠进行40μg/(kg·d) BPA暴露后,观察到子鼠海马中突触密度下降、分支减少,且这一改变在其成年后依然存在.如前所述,Zhang等[18]通过行为学测试观察到BPA损伤鼠的空间记忆能力,与此同时,该研究也观察到了海马中突触密度的改变[18]. Bowman等[20]报道了类似的发现,并认为这二者是相关的.
神经干细胞(NSCs)的增殖及分化异常可能说明脑发育过程受到了干扰.一些研究使用BrdU、Ki67等标记正在增殖的NSCs,结果显示,发育过程中低剂量BPA暴露会抑制脑中神经干细胞的增殖[26-29],Nakamura等[29]的研究显示这种抑制出现在子鼠接触药物一段时间后.BPA还可能影响NSCs的命运决定,Tiwari的团队进行了两项研究,发现BPA造成子鼠海马和脑室下区(SVZ)中神经源性标记物含量降低,认为BPA抑制了NSCs向神经谱系的分化[26-27].Tandon等[21]通过标记髓磷脂等髓鞘标记物发现,BPA干扰了海马中髓鞘形成过程.Kumar等[14]则通过标记不同类型神经突触发现,BPA造成子鼠大脑皮层中兴奋性和抑制性突触比例改变,他们认为这是子鼠出现焦虑样行为的原因.
从已有研究来看,低剂量BPA在组织、细胞层面影响脑发育过程,主要表现为突触形成改变和NSCs增殖及分化受到干扰.
1.3 BPA对哺乳动物神经递质和激素的影响
神经递质的合成及代谢稳态是评估脑功能的指标之一,有研究报道了BPA对这一过程产生了干扰.几项研究分别对处于重要发育时期的鼠进行低剂量BPA暴露后,在其青春期或成年后检测了其血清或脑组织中几种重要神经递质的水平,发现BPA会影响动物体内的神经递质水平,例如多巴胺[30]、5-羟色胺[18,31]、谷氨酸[18]、乙酰胆碱[18]等.部分研究还发现,这种递质水平的变化同时伴随着其与其代谢产物比例的改变,因此,BPA可能干扰了脑中神经递质的代谢稳态[30-31].另外,也有研究显示了这种干扰的性别相关性[18].
目前,BPA被认为具有内分泌干扰作用,其对脑中重要激素的作用也是神经发育毒性关注的指标.Fahrenkopf和Wagner的研究显示,孕期BPA暴露会以ER依赖的方式诱导小鼠大脑视前内侧核中细胞的孕激素受体表达,说明BPA干扰了脑中雌激素的作用过程[32].Fernandez等[33]则发现BPA会影响子鼠血清中的甲状腺素(T4)水平,但对三碘甲状腺原氨酸(T3)水平无显著影响.
1.4 BPA对哺乳动物脑中关键基因表达及重要信号通路的影响
有研究在孕期及哺乳期对孕鼠进行环境剂量BPA暴露后将其子鼠饲养至成年,然后检测脑中关键基因的表达水平.据报道,BPA对多种基因的表达水平产生了干扰.Malloy等[34]发现小鼠在孕期-哺乳期通过饮食摄入BPA后,其大脑中关键基因如钾电压门控通道蛋白Kcnq1、DNA甲基转移酶Dnmt1、tet甲基胞嘧啶双加氧酶Tet1/2的表达水平上调,而这些基因的表达水平可能与胶质细胞分化相关. Tandon及其团队对大鼠进行BPA灌胃后检查了其大脑基因表达水平,发现其中少突胶质细胞标记物PLP、Olig1、MBP等分子表达水平降低[21].除大脑外,Cao等[35-36]还发现BPA对下丘脑雌激素受体相关基因表达水平产生影响.
发育过程中,不同时空位置、不同种类的细胞中的基因表达受到多种信号通路的调节.在脑发育过程中,较为重要的信号通路包括Wnt、Notch、BMP等.研究人员推测,如果这些信号通路受到干扰,脑发育就可能受到影响.Tiwari团队[26-27]的研究显示,BPA对脑中的Wnt信号通路产生干扰,改变了其靶基因的表达水平,且这种干扰并非只是分子层面的,其最终造成了海马神经干细胞的异常增殖;当使用外源物质逆转这种干扰时,这种异常增殖也随之消失;研究认为,BPA确实影响了脑细胞中的Wnt信号通路,并由此干扰了脑的发育.Tandon等[21]则在观察到BPA影响鼠行为以及髓鞘形成的同时发现, BPA改变了大脑中Notch信号通路相关基因的表达水平,如Notch受体Notch1、配体Jagged1、靶基因Hes1等,这说明BPA干扰了脑中的Notch信号通路.
综合来看,在基因表达调控层面,BPA对脑发育产生了一定的影响.
1.5 BPA对哺乳动物脑细胞中表观遗传修饰的影响
脑发育过程中,DNA甲基化、组蛋白修饰等表观遗传修饰机制能够影响神经干细胞命运决定等过程[37],还参与了脑的性二态分化[38].Yaoi等[39]对鼠进行低剂量BPA暴露后对其脑细胞进行了限制性标记基因组扫描(RLGS),发现其中多个基因启动子CpG岛甲基化水平改变.Kumar等[40]也关注了BPA对大脑表观遗传修饰的改变,发现BPA不仅降低了大脑皮层和海马中的DNA甲基化水平,还升高了组蛋白乙酰化水平.由此可见,发育过程中的BPA接触会导致动物脑中表观遗传修饰水平改变.
综上所述,现有低剂量BPA神经发育毒性研究显示,特定脑区内组织学结构和细胞特征、神经递质和激素稳态、脑中关键基因表达以及表观遗传特征等非经典神经毒性指标均受到BPA影响.但是,经典的神经毒性指标,即神经行为的相关研究所得结论存在较大分歧.因此从目前的文献来看,低剂量BPA对神经发育的影响仍需进一步研究明确.
2 BPA研究结果的不一致性分析
尽管众多科学研究均报道了BPA对动物的脑发育过程具有干扰作用,但这一观点并未完全被化学品监管部门认可.欧盟化学品管理局(ECHA)、美国食品药品监督管理局(FDA)等化学品监管机构分别综合审查了BPA神经发育毒性的相关研究报道后,在BPA毒性报告中都陈述了其潜在的神经发育毒性风险,但并未因此提升BPA的管控力度.目前,FDA在官方网站上标称BPA是“安全(SAFE)”的.这与大部分科学研究得到的结论相反.化学品监管机构得出这一结论的主要原因是,现有的BPA神经发育毒性研究结果之间存在分歧.很多因素可能会导致这种差异性结果的出现,具体分析如下:
第一,实验动物品系可能是影响因素之一.首先,不同品系的鼠之间认知能力存在差异,这导致其在迷宫试验等行为学测试中的表现差异较大,会影响神经毒理学实验的结果[41].另外,不同品系鼠的脑发育过程对于不同物质的敏感性也有所不同.例如,美国国家环境健康科学研究所(NIEHS)和FDA共同发起了“学术界和监管机构对双酚A毒性的联合研究”(CLARITY-BPA)项目,并与毒理学研究人员开展了合作研究.与先前的研究不同,这些研究未观察到BPA对动物非生殖行为产生影响.但同时,他们也未在所设置的对照组中观察到预期的性别差异[42].经过分析,研究人员认为美国国家毒理学中心(NCTR)供给的Sprague-Dawley大鼠在行为学上与其他品系大鼠存在差异,其可能对性别相关的干扰不敏感.可见,动物品系的选择会影响得到的结果[42-43].在本文综述的26篇低剂量BPA神经发育毒性相关研究中,有16篇使用大鼠作为研究对象[11-12,14-15,17-20,22-23,25,27,31-32,34-35],10篇使用小鼠进行研究[13,16,21,24,28-30,33,38-39],大鼠、小鼠分别包含不同的品系,这可能带来结果的分歧.
第二,不同的暴露方式可能会影响毒理学实验的结果.本文综述研究中,有8篇[17,19,28-30,32,34,38]采取皮下注射的方式进行暴露,而有18篇通过口服途径进行暴露.这两种不同的暴露途径可能导致实际摄入BPA的量不同.因此,即使暴露相同剂量的BPA,动物脑组织最终的BPA及其代谢产物水平可能不一致,这可能导致动物受到的影响产生差异.在口服暴露的研究中,使用灌胃方法[12-13,15,18,20-25,27,35,39]的研究有13项,通过饮食暴露[11,14,16,31,33]的有5项.这3种方法中,食物暴露和饮水暴露不易确定动物实际接触的药物量,可能会导致结果受到影响.而灌胃暴露已经被证明会给动物造成强大的压力,这种压力对动物行为的影响甚至可能超过BPA的影响[43-44].这可能是采用该种暴露方式的研究报道阴性结果的原因之一.
第三,在毒理学研究中,对不同处理组的动物进行指标检测及数据统计时应以“窝”为单位,并在同一处理组保证足够的窝数,以此排除遗传背景带来的误差.但是,在现有的BPA神经发育毒性研究中,仅有11项明确统计单元为“窝”[15-16,18,22-23,30-32,34-35,38],其余研究均以“只”[11-12,14,17,19,21,24,28-29]为单元或描述不清[13,20,25,27,39].不同遗传背景的动物可能在行为学测试中表现不同,不合适的统计方法可能会造成假阳性或是假阴性的结果出现.
第四,本文在综述现有相关研究后发现,即使是不存在上述问题的研究得到的结果依然存在差异,尤其是行为学测试的结果.这可能是由于行为学测试受到的影响因素较为复杂,本身就不易得到高度一致的重复.现有研究显示,动物饲养条件的细微不同、实验时环境噪音的不同、实验人员数量及相对位置的不同均会影响动物在行为学测试中的表现.这些细节一般不会在研究报告中完整体现,而两项实验设计看似完全相同的研究可能因此得到不同的结果[42].另外,现有的行为学测试往往被认为指示了动物的某一项认知功能.例如,鼠在莫里斯水迷宫中的逃生时间增加被认为是空间记忆能力损害的表现.但事实上,这些测试中的指标并非仅由一项认知功能决定.Tanila在综合评估鼠的行为学试验报道后发现,在莫里斯水迷宫试验中,如果鼠出现焦虑情绪,其游泳速度会加快、逃生时间变短,而这可能被误认为是空间记忆能力较好的表现[42].一些非认知功能受到影响也会影响鼠在行为学试验中的表现,例如嗅觉、运动能力等.Karl等人在综述了鼠神经毒理学相关研究后认为,毒理学中不一致的行为测试结果可能来自未被关注到的健康指标[44].
总体来说,现有的发育神经毒性测试方法受到的影响因素非常复杂,包括动物品系、暴露方式、统计方式等,行为学测试本身易受干扰的特点也是因素之一.这些都可能是BPA神经发育毒性研究结论不一致的原因.
3 结论与展望
3.1 结论
大部分研究显示,发育过程中低剂量BPA暴露会导致哺乳动物神经发育受损,但其中行为学结果存在差异,其可能与实验设计的差异相关,尤其是统计单元的选择和行为学测试质量控制.
3.2 展望
目前,低剂量BPA神经发育毒性仍需进一步明确.未来,在研究BPA对神经系统发育的影响时应着重关注实验设计,例如使用“窝”为统计单元以排除遗传背景的影响,使用饮食途径等对动物行为影响较小的暴露方式等,以明确低剂量BPA对脑发育的不良效应及其产生效应的浓度.在进行行为学测试时,应尽量使用自动化设备以排除实验人员的影响,并综合评估包括动物本身健康状况在内的多项指标以得出更准确的结论.
[1] Michałowicz J. Bisphenol A – Sources, toxicity and biotransformation [J]. Environmental Toxicology and Pharmacology, 2014,37(2):738- 758.
[2] Vandenberg L N, Hauser R, Marcus M, et al. Human exposure to bisphenol A (BPA) [J]. Reproductive Toxicology, 2007,24(2):139-177.
[3] Andra S S, Charisiadis P, Arora M, et al. Biomonitoring of human exposures to chlorinated derivatives and structural analogs of bisphenol A [J]. 2015,85:352-379.
[4] Yang J, Wang H, Du H, et al. Serum Bisphenol A, glucose homeostasis, and gestational diabetes mellitus in Chinese pregnant women: A prospective study [J]. Environmental Science and Pollution Research, 2020.https://doi.org/10.1007/s11356-020-11263-4.
[5] Itoh K, Yaoi T, Fushiki S. Bisphenol A, an endocrine-disrupting chemical, and brain development [J]. Neuropathology, 2012,32(4): 447-457.
[6] Mhaouty-Kodja S, Belzunces L P, Canivenc M-C, et al. Impairment of learning and memory performances induced by BPA: Evidences from the literature of a MoA mediated through an ED [J]. Molecular and Cellular Endocrinology, 2018,475:54-73.
[7] Wolstenholme J T, Rissman E F, Connelly J J. The role of bisphenol A in shaping the brain, epigenome and behavior [J]. Hormones and Behavior, 2011,59(3):296-305.
[8] Grohs M N, Reynolds J E, Liu J, et al. Prenatal maternal and childhood bisphenol a exposure and brain structure and behavior of young children [J]. Environmental Health, 2019,18(1):85.
[9] FDA. Updated Review of Literature and Data on Bisphenol A [R/OL]. https://www.fda.gov/food/food-additives-petitions/bisphenol-bpa, 2021.
[10] Beronius A, Johansson N, Ruden C, et al. The influence of study design and sex-differences on results from developmental neurotoxicity studies of bisphenol A, implications for toxicity testing [J]. Toxicology, 2013,311(1/2):13-26.
[11] Segal D, Makris S L, Kraft A D, et al. Evaluation of the ToxRTool's ability to rate the reliability of toxicological data for human health hazard assessments [J]. Regulatory Toxicology and Pharmacology, 2015,72(1):94-101.
[12] Chang H, Wang M, Xia W, et al. Perinatal exposure to low-dose bisphenol A disrupts learning/memory and DNA methylation of estrogen receptor alpha in the hippocampus [J]. Toxicology Research, 2016,5(3):828-835.
[13] Poimenova A, Markaki E, Rahiotis C, et al. Corticosterone-regulated actions in the rat brain are affected by perinatal exposure to low dose of bisphenol A [J]. Neuroscience, 2010,167(3):741-749.
[14] Kumar D, Thakur M K. Anxiety like behavior due to perinatal exposure to Bisphenol-A is associated with decrease in excitatory to inhibitory synaptic density of male mouse brain [J]. Toxicology, 2017, 378:107-113.
[15] Jones B A, Watson N V. Perinatal BPA exposure demasculinizes males in measures of affect but has no effect on water maze learning in adulthood [J]. Hormones and Behavior, 2012,61(4):605-610.
[16] Dessi-Fulgheri F, Porrini S, Farabollini F. Effects of perinatal exposure to bisphenol A on play behavior of female and male juvenile rats [J]. Environmental Health Perspectives, 2002,110:403-407.
[17] Gioiosa L, Fissore E, Ghirardelli G, et al. Developmental exposure to low-dose estrogenic endocrine disruptors alters sex differences in exploration and emotional responses in mice [J]. Hormones and Behavior, 2007,52(3):307-316.
[18] Zhang H, Kuang H, Luo Y, et al. Low-dose bisphenol A exposure impairs learning and memory ability with alterations of neuromorphology and neurotransmitters in rats [J]. Science of the Total Environment, 2019,697:134036.
[19] Della Seta D, Minder I, Belloni V, et al. Pubertal exposure to estrogenic chemicals affects behavior in juvenile and adult male rats [J]. Hormones and Behavior, 2006,50(2):301-307.
[20] Bowman R E, Hagedorn J, Madden E, et al. Effects of adolescent Bisphenol-A exposure on memory and spine density in for ovariectomized female rats: Adolescence vs adulthood [J]. Hormones and Behavior, 2019,107:26-34.
[21] Tandon A, Singh S J, Gupta M, et al. Notch pathway up-regulation via curcumin mitigates bisphenol-A (BPA) induced alterations in hippocampal oligodendrogenesis [J]. Journal of Hazardous Materials, 2020,392:122052.
[22] Xu X, Tian D, Hong X, et al. Sex-specific influence of exposure to bisphenol-A between adolescence and young adulthood on mouse behaviors [J]. Neuropharmacology, 2011,61(4):565-573.
[23] Ferguson S A, Law C D, Jr., Abshire J S. Developmental treatment with bisphenol A or ethinyl estradiol causes few alterations on early preweaning measures [J]. Toxicological Sciences, 2011,124(1):149- 160.
[24] Rebuli M E, Camacho L, Adonay M E, et al. Impact of low-dose oral exposure to bisphenol A (BPA) on juvenile and adult rat exploratory and anxiety behavior: A CLARITY-BPA Consortium Study [J]. Toxicological Sciences, 2015,148(2):341-354.
[25] Kimura E, Matsuyoshi C, Miyazaki W, et al. Prenatal exposure to bisphenol A impacts neuronal morphology in the hippocampal CA1region in developing and aged mice [J]. Archives of Toxicology, 2016,90(3):691-700.
[26] Tiwari S K, Agarwal S, Seth B, et al. Inhibitory effects of bisphenol-A on neural stem cells proliferation and differentiation in the rat brain are dependent on Wnt/beta-catenin pathway [J]. Molecular Neurobiology, 2015,52(3):1735-1757.
[27] Tiwari S K, Agarwal S, Tripathi A, et al. Bisphenol-A mediated inhibition of hippocampal neurogenesis attenuated by curcumin via canonical Wnt pathway [J]. Molecular Neurobiology, 2016,53(5): 3010-3029.
[28] Agarwal S, Yadav A, Tiwari S K, et al. Dynamin-related Protein 1Inhibition Mitigates Bisphenol A-mediated Alterations in Mitochondrial Dynamics and Neural Stem Cell Proliferation and Differentiation [J]. Journal of Biological Chemistry, 2016,291(31): 15923-15939.
[29] Nakamura K, Itoh K, Yaoi T, et al. Murine neocortical histogenesis is perturbed by prenatal exposure to low doses of bisphenol A [J]. Journal of Neuroscience Research, 2006,84(6):1197-1205.
[30] Yao J, Wang J, Wu L, et al. Perinatal exposure to bisphenol A causes a disturbance of neurotransmitter metabolic pathways in female mouse offspring: A focus on the tryptophan and dopamine pathways [J]. Chemosphere, 2020,254:126715.
[31] Matsuda S, Matsuzawa D, Ishii D, et al. Perinatal exposure to bisphenol A enhances contextual fear memory and affects the serotoninergic system in juvenile female mice [J]. Hormones and Behavior, 2013,63(5):709-716.
[32] Fernandez M O, Bourguignon N S, Arocena P, et al. Neonatal exposure to bisphenol A alters the hypothalamic-pituitary-thyroid axis in female rats [J]. Toxicology Letters, 2018,285:81-86.
[33] Fernandez M O, Bourguignon N S, Arocena P, et al. Neonatal exposure to bisphenol A alters the hypothalamic-pituitary-thyroid axis in female rats [J]. Toxicology Letters, 2018,285:81-86.
[34] Malloy M A, Kochmanski J J, Jones T R, et al. Perinatal bisphenol A exposure and reprogramming of imprinted gene expression in the adult mouse brain [J]. Frontiers in Genetics, 2019:10.
[35] Cao J, Mickens J A, Mccaffrey K A, et al. Neonatal Bisphenol A exposure alters sexually dimorphic gene expression in the postnatal rat hypothalamus [J]. Neurotoxicology, 2012,33(1):23-36.
[36] Cao J, Rebuli M E, Rogers J, et al. Prenatal bisphenol A exposure alters sex-specific estrogen receptor expression in the neonatal rat hypothalamus and amygdala [J]. Toxicological Sciences, 2013,133(1): 157-173.
[37] Miller F D, Gauthier A S. Timing is everything: Making neurons versus glia in the developing cortex [J]. Neuron, 2007,54(3):357-369.
[38] Westberry J M, Trout A L, Wilson M E. Epigenetic regulation of estrogen receptor alpha gene expression in the mouse cortex during early postnatal development [J]. Endocrinology, 2010,151(2):731-740.
[39] Yaoi T, Itoh K, Nakamura K, et al. Genome-wide analysis of epigenomic alterations in fetal mouse forebrain after exposure to low doses of bisphenol A [J]. Biochemical and Biophysical Research Communications, 2008,376(3):563-567.
[40] Kumar D, Thakur M K. Effect of perinatal exposure to Bisphenol-A on DNA methylation and histone acetylation in cerebral cortex and hippocampus of postnatal male mice [J]. Journal of Toxicological Sciences, 2017,42(3):281-289.
[41] Tanila H. Testing cognitive functions in rodent disease models: Present pitfalls and future perspectives [J]. Behavioural Brain Research, 2018, 352:23-27.
[42] Patisaul H B. Achieving CLARITY on bisphenol A, brain and behaviour [J]. Journal of Neuroendocrinology, 2020,32(1):e12730.
[43] Prins G S, Patisaul H B, Belcher S M, et al. CLARITY-BPA academic laboratory studies identify consistent low-dose Bisphenol A effects on multiple organ systems [J]. Basic & Clinical Pharmacology & Toxicology, 2019,125:14-31.
[44] Karl T, Pabst R, Von Horsten S. Behavioral phenotyping of mice in pharmacological and toxicological research [J]. Experimental and Toxicologic Pathology, 2003,55(1):69-83.
Research progress and controversy of low dose bisphenol A on neurodevelopment in mammals.
LÜ Lin1,2, DONG Meng-qi1,2, QIN Zhan -fen1,2*
(1.State Key Laboratory of Environmental Chemistry and Ecotoxicology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China;2.University of Chinese Academy of Sciences, Beijing 100049, China)., 2021,41(10):4864~4871
Bisphenol A (BPA) is a high-production volume chemical and ubiquitous in both the environment and the human body. Nowadays, a large number of animal studies have shown that BPA can affect brain development, along with epidemiological data supporting the results from animals. However, other studies, especially from regulatory agencies reported no significant developmental neurotoxicity of low doses of BPA. In order to develop a more comprehensive understanding of the effects of low-dose BPA on mammalian neurodevelopment, we obtained research reports on the effects of low-dose BPA on mammalian neurodevelopment from the three databases of CNKI, PubMed and Web of Science, and used the toxR tool to evaluate its credibility, and finally screened 26 relevant studies; obtained 1 latest BPA toxicity report from the U.S. Food and Drug Administration (FDA) work website. The major studies reported that BPA caused abnormalities in neurobehaviors, histological structure and cellular features in certain specific brain regions, neurotransmitters and hormones, brain key gene expression, and epigenetic modifications in mammals. In terms of neurobehavioral alterations, however, some results were inconsistent and even contradictory, which may be due to some differences in experimental design, especial the quality control of neurobehavioral tests and the choose of statistical unit. Overall, further research is needed to clarify the effects of BPA on neurodevelopment in mammals.
bisphenol A;brain development;developmental neurotoxicity;behavioral test;quality control
X503
A
1000-6923(2021)10-4864-08
吕 琳(1998-),女,北京人,中国科学院生态环境研究中心硕士研究生,主要从事环境毒理学研究.
2021-02-25
国家重点研发计划(2018YFA0901103);国家自然科学基金资助项目(21876196)
* 责任作者, 研究员, qinzhanfen@rcees.ac.cn
