左旋紫草素对ConA诱导小鼠免疫性肝损伤的保护作用
2021-10-26努力比亚阿不都克尤木胡利萍秦冬梅鲁晓擘
努力比亚·阿不都克尤木, 胡利萍, 秦冬梅, 鲁晓擘*
(1.新疆医科大学第一附属医院感染科,新疆 乌鲁木齐 830000;2.石河子大学药学院,新疆 石河子 832002)
免疫性肝损伤(immunological liver injury,ILI)是一种较为常见的自身免疫性疾病,主要表现为肝脏组织内出现大量的炎症细胞浸润,同时转氨酶、炎症因子水平大幅度升高等[5],是肝纤维化、肝硬化以及肝脏肿瘤等发生的重要因素,也是肝脏疾病发展的重要过程。近年来,国内外对紫草的研究表明,紫草素具有良好的抗炎、抑菌、抗肿瘤和增强免疫功能等多种功效[6]。鲁明霞等[7]研究表明紫草素可下调四氯化碳诱导的肝纤维化大鼠肝组织中TGF-β1的表达,从而抑制大鼠肝纤维化的发生。但是紫草素毒性较强,而其药理作用又不具特异性,因而在临床上未能推广应用。左旋紫草素与紫草素互为旋光异构体,其在药理作用方面有着许多相似之处,但是左旋紫草素的保肝作用研究却相对较少,药理毒性也知之甚少,因此本研究利用刀豆蛋白A (concanavalin A,ConA)诱导小鼠模拟免疫性肝损伤模型,研究左旋紫草素对小鼠免疫性肝损伤的保护作用,为紫草的药用价值开发提供理论依据。
1 材料
1.1 仪器 5426XG离心机、Galaxy-170S型CO2恒温培养箱(德国Eppendorf公司);3001全波长扫描多功能读数仪(美国Thermo Fisher Scientific公司);BP211D分析天平(德国Sartorius公司);电热水浴锅(北京市永光明医疗仪器有限公司);BCD-272AY容声冰箱(广东海信家电集团股份有限公司);SW-CJ-2FD超净工作台(苏州安泰空气技术有限公司)。
1.2 药物、细胞与试剂 左旋紫草素(含量≥98%,批号200506)购自中国食品药品检定研究院。甘草酸二铵胶囊(批号180327302)购自江苏正大天晴药业集团股份有限公司。小鼠巨噬细胞株(RAW264.7)由新疆医科大学保存。DMEM培养基(批号8118344)、胎牛血清(批号1828728)均购自赛默飞世尔(苏州)仪器有限公司;青链霉素(批号SV30010)、胰酶(批号SH3004201)均购自美国HyClone公司;DMSO(批号D8371)购自北京索莱宝科技有限公司;刀豆蛋白A(ConA)(批号C2272)购自美国Sigma公司;MDA(批号20170105)、T-SOD(批号20170105)、AST(批号20170112)、ALT(批号20170112)、AKP(批号20170115)、GST(批号20161211)、考马斯亮蓝(批号20160112)试剂盒均购自南京建成生物工程研究所;小鼠白介素1β(IL-1β,批号20170117)、小鼠肿瘤坏死因子α(TNF-α,批号20161205)、小鼠γ干扰素(IFN-γ,批号20170115)试剂盒均购自上海雅吉生物科技有限公司。
1.3 动物 昆明种小鼠60只,雌雄各半,体质量(20±2) g,购自新疆维吾尔自治区疾病预防控制中心,实验动物生产许可证号SCXK(新)2016-0001,自由饮水,适应饲养2 d准备实验。
2 方法
2.1 细胞培养 RAW 264.7细胞加到含10%胎牛血清、1%青链霉素的DMEM 培养基中,在37 ℃、5% CO2下常规培养,每2~3 d传代1次。
2.2 MTT法检测左旋紫草素对RAW 264.7细胞的毒性 将细胞以每孔1×105个密度接种在96孔板中孵育过夜,加入含不同浓度左旋紫草素的培养基溶液处理24 h,小心吸去培养液,加入含10% MTT溶液的新鲜培养基继续培养4 h,吸去上清,每孔加入110 μL Formazan 溶解液,置摇床上低速振荡10 min,酶标仪在490 nm 波长处测量各孔光密度(OD)值,计算细胞存活率,公式为细胞存活率=(OD1/OD0)×100%(OD1为各处理组,OD0为正常培养细胞)。
2.3 左旋紫草素对LPS诱导RAW 264.7细胞产生NO的影响 将细胞以每孔1×105个密度接种在96孔板中孵育过夜,用合适浓度的左旋紫草素预处理30 min,每孔加入LPS(1 μg/mL)继续培养24 h,取100 μL细胞培养上清液,与等体积Griess试剂混合,5 min内使用酶标仪在550 nm波长处测量每孔OD值[8]。
2.4 分组及给药 将小鼠随机分为正常组,模型组,阳性药组(100 mg/kg甘草酸二铵胶囊),左旋紫草素低、中、高剂量组(0.4、0.8、1.6 mg/kg),每组10只,雌雄各半,正常组、模型组小鼠每天同一时间灌胃生理盐水0.5 mL/只,阳性药组、左旋紫草素高、中、低剂量组每天灌胃相应药物1次,连续7 d。最后1次给药后1 h,除正常组外其余各组小鼠尾静脉注射ConA(18 mg/kg)形成急性免疫性肝损伤模型,正常组小鼠注射等量生理盐水,禁食不禁水,8 h后处死取材,并检测各项指标。
环境承载力(ELR)是指经济投入能值加上不可更新资源能值(F+T+N)与可更新环境资源能值(R)的比率,该数值不仅可以反映生态经济系统运转对环境系统的压力,而且可以反映其农业生产对自然资源的充分利用程度。2010年河南省环境承载力为4.44,低于发达国家平均水平,说明河南省的农业生产对环境压力的较小,且具有较大的发展潜力。
2.5 取材 造模结束后8 h,称定小鼠体质量,眼眶取血,3 000 r/min离心10 min分离血清,在4 ℃下保存,用于检测肝脏指标[9]。再将小鼠颈椎脱臼处死,取部分肝脏组织,10%福尔马林固定以制备病理切片,再取肝脏右叶相同部位小块组织约0.5 g,4 ℃冷生理盐水冲洗浮血,加10倍量冰冷生理盐水研磨匀浆,置于冷冻离心机中,4 ℃、3 000 r/min离心10 min,取上清液,在4 ℃下保存[10]。
2.6 指标检测
2.6.1 肝脏、脾脏指数 将小鼠肝脏、脾脏置于生理盐水中清洗,滤纸吸干血水后置于称量纸上,电子天平称定质量,计算肝脏、脾脏指数[11],公式分别为肝脏指数=(肝脏质量/小鼠体质量)×100%、脾脏指数=(脾脏质量/小鼠体质量)×100%。
2.6.2 血清和肝脏组织匀浆炎症因子、转氨酶水平 将小鼠肝脏组织匀浆,检测蛋白浓度,采用硫代巴比妥酸比色法检测丙二醛(MDA)水平,黄嘌呤氧化酶法检测总超氧化物歧化酶(T-SOD)活性,血清AST、ALT、AKP、GST水平检测严格按说明书进行,ELISA法检测肝脏组织匀浆IFN-γ、TNF-α、IL-1β水平。
2.6.3 肝脏组织病理学 处死小鼠后取肝脏组织,置于福尔马林中固定48 h,石蜡包埋切片,用HE、VG染色,在光学显微镜下进行组织病理学观察。

3 结果
3.1 左旋紫草素对RAW 264.7细胞存活率、NO水平的影响 如图1所示,左旋紫草素浓度小于200 μmol/L时细胞存活率大于90%,而在250、300、400 μmol/L时均表现出细胞毒性,细胞存活率分别为54.8%、31.6%、25.0%,故本实验采用50、100、200 μmol/L左旋紫草素进行研究。与对照组(0 μmol/L左旋紫草素,1 μg/mL LPS)比较,100、200 μmol/L左旋紫草素均能降低由LPS刺激产生的NO水平(P<0.01)。
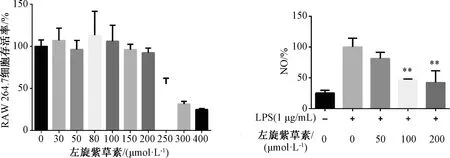
注:与对照组(0 μmol/L左旋紫草素,1 μg/mL LPS)比较,**P<0.01。
3.2 左旋紫草素对小鼠肝脏、脾脏指数的影响 如表1所示,与正常组比较,模型组小鼠肝脏、脾脏系数均升高(P<0.01);与模型组比较,阳性药组、左旋紫草素高剂量组小鼠肝脏、脾脏指数均下降(P<0.05,P<0.01),而中、低剂量组两者无明显变化(P>0.05)。
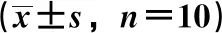
表1 左旋紫草素对小鼠肝脏、脾脏指数的影响
3.3 左旋紫草素对小鼠血清转氨酶水平的影响 如图2所示,与正常组比较,模型组小鼠血清AST、ALT、GST、AKP水平均升高(P<0.05,P<0.01);与模型组比较,阳性药组、左旋紫草素高剂量组均能降低AST、ALT、GST、AKP水平(P<0.05,P<0.01),中剂量组仅能降低AST水平(P<0.05),低剂量组AST、ALT、GST、AKP水平无明显变化(P>0.05)。

注:与正常组比较,▲P<0.05,▲▲P<0.01;与模型组比较,*P<0.05,**P<0.01。
3.4 左旋紫草素对小鼠肝脏组织匀浆T-SOD活性及MDA、白蛋白水平的影响 如图3所示,与正常组比较,模型组小鼠T-SOD活性、白蛋白水平降低(P<0.05,P<0.01),MDA水平升高(P<0.05);与模型组比较,阳性药组、左旋紫草素高剂量组均能增加T-SOD活性(P<0.05),降低MDA水平(P<0.05),升高白蛋白水平(P<0.01),而中、低剂量组无明显变化(P>0.05)。

注:与正常组比较,▲P<0.05,▲▲P<0.01;与模型组比较,*P<0.05,**P<0.01。
3.5 左旋紫草素对小鼠血清IFN-γ、TNF-α、IL-1β水平的影响 如图4所示,与正常组比较,模型组小鼠血清TNF-α、IL-1β、IFN-γ水平均升高(P<0.05);与模型组比较,阳性药组能降低TNF-α、IL-1β、IFN-γ水平(P<0.05),左旋紫草素高剂量组能降低IFN-γ水平(P<0.05),各剂量组均能降低TNF-α水平(P<0.01),虽然有降低IL-1β水平的趋势,但均无统计学意义(P>0.05)。
注:与正常组比较,▲P<0.05,▲▲P<0.01;与模型组比较,*P<0.05,**P<0.01。
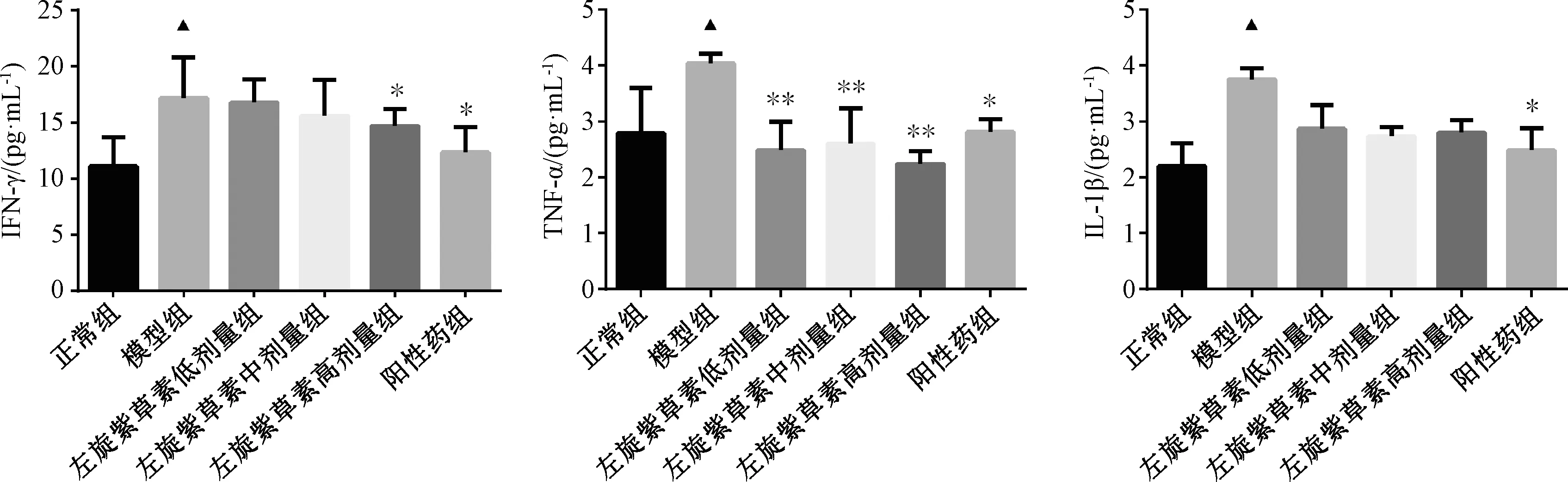
3.6 左旋紫草素对免疫性肝损伤小鼠肝脏病理的影响 图5~6显示,正常组小鼠肝脏结构清晰,肝索分布规律,肝细胞形态正常无变性且排列有序,炎症细胞浸润较少[12];模型组小鼠肝组织结构出现破坏,形成纤维纵隔和假小叶,肝索排列紊乱,很多肝细胞变性,呈现肿胀坏死,边界模糊,肝细胞胞浆发生红染;与模型组比较,阳性药组小鼠肝脏组织有所改善,肝细胞排列比较规则,肝细胞间隔变窄,肝细胞的胞质均匀,炎性浸润程度减轻;左旋紫草素各剂量组均可不同程度减轻小鼠肝组织病变,以高剂量组最明显,肝小叶可见,炎性浸润减轻,肝细胞形态较为正常,肝细胞索排列较为有序。
图5 各组小鼠肝组织病理组织学变化(HE,×200)
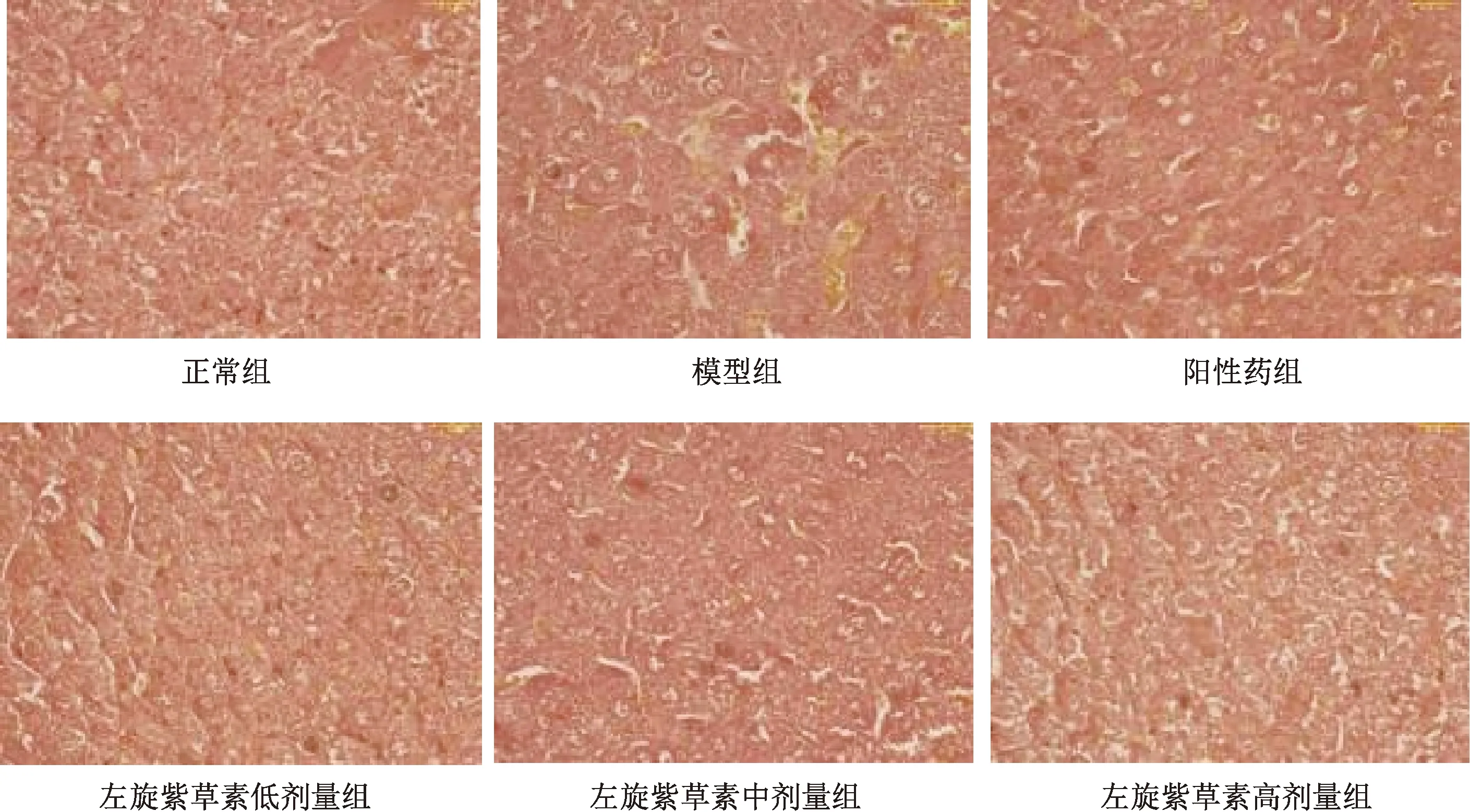
图6 各组小鼠肝组织病理组织学变化(VG,×400)
4 讨论
机体免疫应答反应介导的肝损伤是许多肝脏疾病发生发展的重要原因之一,研究表明自由基、酶以及脂质过氧化等均可引起肝脏免疫反应,导致肝细胞坏死[13]。 ConA诱导的小鼠急性免疫性肝损伤是近年来较为理想的免疫性肝损伤模型,具有操作简单、易重复、模型成功率高等优点,经常作为研究保肝药物的模型[14]。本实验采用尾静脉注射ConA的方法建立小鼠免疫性肝损伤模型,实验中模型组AST、ALT水平等均升高,病理组织学显示肝细胞严重坏死,证明肝功能损伤严重,造模成功。
现代研究发现,紫草具有抗炎、抗病毒、抗菌、抗肿瘤等作用[15-16]。其富含的萘醌类化合物具有较好的保肝降酶作用,有望成为治疗肝炎的有效药物[17]。本实验首先利用RAW264.7巨噬细胞进行左旋紫草素体外抗炎活性初筛。炎症是伴随肝脏疾病的一种常见病理反应,RAW264.7细胞是主要的炎性细胞,也是免疫反应的效应细胞,在机体免疫系统中起着重要的作用。研究发现,体内过量的NO会促进炎症性疾病的发生和发展[18],因此,抑制NO的释放可能是缓解炎症反应的重要途径[19-20]。本实验中左旋紫草素可以降低由LPS刺激RAW264.7细胞产生的NO相对水平,初步说明左旋紫草素体外具有一定的抗炎活性。
体内采用ConA诱导建立的小鼠免疫性肝损伤模型,与模型组比较,左旋紫草素能改善小鼠肝脏转氨酶水平,同时升高T-SOD活性,降低MDA水平(P<0.05)。MDA 是机体发生脂质过氧化反应的最终代谢产物,其水平可以反映细胞或组织受氧化损伤的严重程度,SOD具有消除单线态氧的作用,是体内抗氧化防御系统的第一道防线,可以阻断脂质过氧化反应的发生[21-22],该结果表明左旋紫草素的保肝作用与其抗氧化作用相关。进一步研究发现,左旋紫草素能降低小鼠血清IFN-γ(P<0.05)、TNF-α(P<0.01)的水平。TNF-α主要由单核巨噬细胞分泌,它在血清的浓度与机体的炎症严重程度呈正相关,是检测炎症细胞的关键指标[23]。炎性因子的过度表达也是造成肝损伤的原因之一,有报道称抑制TNF-α的生成,在减轻肝损伤,缓解肝纤维化中具有重要意义[24],因此进一步证明左旋紫草素在体内也具有抗炎活性,并且与体外实验结果相结合表明左旋紫草素的保肝作用与其抗炎作用相关。
综上所述,左旋紫草素在无细胞毒性的情况下能通过降低转氨酶水平、减少炎症因子的释放等作用保护由ConA引起的小鼠免疫性肝损伤。
