复方黑骨藤有效组分抗类风湿性关节炎作用及分子机制
2021-10-26李佳俊李克娟
李佳俊, 张 宏,2, 李克娟, 陈 秀, 李 琪,2*
(1.四川师范大学生命科学学院,四川 成都 610101;2.四川师范大学植物功能基因组及生物信息学研究中心,四川 成都 610101)
类风湿性关节炎(rheumatoid arthritis,RA)是一种以关节滑膜炎为主要特征的自身免疫疾病,其病理学改变包括滑膜增生、软骨破坏及血管翳形成等。该病病程较长,可发生在各个年龄段,并以女性多见[1],其高致残性严重影响了患者的正常生活。复方黑骨藤由黑骨藤、秦艽、延胡索3味中药组成,具有清热解毒、活血化瘀之功效,是民间用于治疗RA的经典方剂。目前对于复方黑骨藤治疗RA的药理研究大多集中在粗提物层面,难以阐明药物发挥治疗作用的物质基础和作用模式。本课题组在前期实验已分别筛选出黑骨藤、秦艽、延胡索各单味药的抗炎有效部位,并测定了各抗炎有效部位的纯度,均在45%以上[2-4]。在此基础上,结合中药复方有效成分组学[5]的研究思路,本实验将该复方中各单味药有效部位以适当比例重新混合为复方黑骨藤有效组分(the effective components ofPeriplocaforrestiiSchltr. Compound,EC-PFSC),拟通过小鼠耳肿胀和足肿胀两种急性炎症模型进行EC-PFSC最优抗炎剂量筛选,再选用与人类RA病理变化高度相似的胶原诱导性关节炎(collagen-induced arthritis,CIA)动物模型[6],观察其治疗作用并结合丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)信号通路中关键蛋白及相关炎症介质的表达,进一步探讨EC-PFSC抗RA的可能分子作用机制,为该药物的深入开发和临床应用提供理论依据。
1 材料
1.1 药材与药物 黑骨藤于2017年购于西昌药材市场,秦艽(批号20180527)、延胡索(批号20180629)购于北京同仁堂,经四川师范大学严伟教授鉴定均为正品。雷公藤多苷片(批号20180501,10 mg/片,远大医药黄石飞云制药有限公司)。
1.2 试剂 对照品新绿原酸、绿原酸、延胡索乙素、异绿原酸C、脱氢紫堇碱、延胡索甲素、原阿片碱均购于成都瑞芬思生物科技有限公司,隐绿原酸、原花青素A1、原花青素A2均购于深圳市斯坦德合成有限公司,马钱苷酸、6′-O-β-D-葡萄糖基龙胆苦苷、龙胆苦苷、杠柳毒苷均购于成都普思生物科技有限公司。二甲苯(成都市科龙化工试剂厂,批号20150125);角叉菜胶(批号22049-5G-F)、弗氏完全佐剂(F5881)均购于美国Sigma公司;PBS缓冲液(批号ZLI-9062)、生物素化山羊抗兔IgG二抗(货号SP-9001)均购于北京中杉金桥生物技术有限公司;前列腺素E2(prostaglandin E2,PGE2)试剂盒(上海邦奕生物科技有限公司,批号201903);一氧化氮(nitric oxide,NO)试剂盒(南京建成生物工程研究所,批号20190327);牛Ⅱ型胶原蛋白(上海源叶生物科技有限公司,批号S12008);兔多克隆诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗体(武汉爱博泰克生物科技有限公司,货号A0312);兔多克隆抗体caspase3(批号GB11009-1)、β-actin(货号GB12001)、兔多克隆环氧合酶-2(cyclooxygenase-2,COX-2)抗体(货号GB11077-2)、HRP标记山羊抗兔(货号GB23303)、HRP标记山羊抗小鼠(货号GB23301)、5×蛋白上样缓冲液(货号G2013)、磷酸化蛋白酶抑制剂(货号G2007)、RNA提取液(货号G3013)、SYBR® Green Fast qPCR Mix(货号G3008)均购于武汉赛维尔生物科技有限公司;RevertAid First Strand cDNA Synthesis Kit(货号#K1622)、蛋白Marker(货号26616)均购于美国Thermo公司;磷酸化细胞外信号调节激酶(phosphorylated extracellular signal-regulated kinase,P-ERK)抗体(货号4370)、磷酸化p38(phosphorylated p38,P-p38)抗体(货号4511)均购于美国CST公司;D-101大孔树脂(天津市光复精细化工研究所)。甲醇为色谱纯;乙醇、磷酸为分析纯。
1.3 动物 SPF级昆明种小鼠,雌雄各半,体质量(18±2)g,4周龄;SPF级Wistar大鼠,雄性,体质量(120±10)g,5周龄,购自成都达硕实验动物有限公司,实验动物生产许可证号SCXK(川)2015-030。分笼饲养,室温(22±2)℃,相对湿度60%~65%,定时换气,自由进食饮水。
1.4 仪器 M01000101游标卡尺(成都量具刃具股份有限公司);Model 680酶标仪(美国Bio-Rad公司);RM2016转轮式切片机(德国徕卡公司);TSJ-Ⅱ全自动封闭式组织脱水机、PHY-Ⅲ病理组织漂烘仪(常州市中威电子仪器有限公司);BMJ-Ⅲ包埋机(常州郊区中威电子仪器厂);BA400Digital数码三目摄像显微镜(麦克奥迪实业集团有限公司);Stepone plus荧光定量PCR仪(美国ABI公司);ACQUITY H-Class超高相液相色谱仪(美国Waters公司);YRE-201D旋转蒸发仪(予华仪器有限责任公司);VIRTIS冷冻干燥机(美国Virtis公司)。
2 方法
2.1 药物制备 分别取黑骨藤、秦艽、延胡索药材适量,各采用50 ℃超声、80 ℃回流、75 ℃超声以1∶20、1∶20、1∶25的料液比加入50%乙醇提取,重复3次,每次1 h,再分别合并各提取液,过滤,浓缩,后分别上样于D101大孔吸附树脂,黑骨藤收集10个柱体积20%乙醇洗脱液,秦艽收集15个柱体积10%乙醇洗脱液,延胡索先收集10个柱体积30%乙醇洗脱液,再收集10个柱体积95%乙醇洗脱液,各药物洗脱液分别减压浓缩,冷冻干燥,即得黑骨藤有效部位干粉(得率4%)、秦艽有效部位干粉(得率9.94%)、延胡索有效部位干粉(得率2.51%)。参照课题组前期所筛选的最佳抗炎药液质量浓度[黑骨藤有效部位(4.57 mg/mL)、秦艽有效部位(50 mg/mL)、延胡索有效部位(0.96 mg/mL)],将黑骨藤、秦艽、延胡索各有效部位干粉以4.8∶52.1∶1的质量比用蒸馏水配制成EC-PFSC高剂量组药液(55.53 mg/mL),即3种有效部位的终质量浓度均为其最佳抗炎药液浓度,再依次用蒸馏水半倍稀释配制成中剂量(27.80 mg/mL)、低剂量(14.05 mg/mL)组药液,4 ℃冰箱保存备用。将黑骨藤、秦艽、延胡索以2.5∶1∶1的比例混匀,打磨成粉,过筛,50%乙醇80 ℃回流提取3次(料液比1∶40),每次1 h,合并提取液,减压浓缩,冷冻干燥,即得传统复方黑骨藤提取物干粉。称取适量用蒸馏水配制成给药所需浓度的传统复方黑骨藤药液,4 ℃冰箱保存备用。另取雷公藤多苷片适量,加蒸馏水配制成4.0 mg/mL药液,于4 ℃冰箱中保存备用。
2.2 EC-PFSC剂量筛选
2.2.1 对二甲苯致小鼠耳肿胀的作用 取小鼠84只,雌雄各半,适应性饲养5 d后,将动物随机分为空白组、模型组、雷公藤组(40.0 mg/kg)、传统复方黑骨藤组(322.0 mg/kg,以传统复方黑骨藤提取物干粉重量计)及EC-PFSC高、中、低剂量(555.3、278.0、140.5 mg/kg,以混合有效组分干粉重量计)组,每组12只(雌雄各半)。各给药组对应给药,空白组、模型组给予生理盐水;各组灌胃给药容量均为10 mL/kg,每天1次,连续7 d。除空白组外,末次给药1 h后,每只小鼠右耳前后两面涂50 μL二甲苯致炎,左耳作对照。30 min后将小鼠断颈处死,剪下左右耳,在同一位置用打孔器打下等大的圆形耳片,称定质量,计算耳肿胀度和耳肿胀抑制率。耳肿胀度=右耳质量-左耳质量,耳肿胀抑制率=[(模型组平均肿胀度-给药组平均肿胀度)/模型组平均肿胀度]×100%。
2.2.2 对角叉菜胶致小鼠足肿胀的作用 分组与灌胃剂量参考“2.2.1”项。除空白组外,末次给药1 h后,每只小鼠右后足中部皮下注射30 μL 1%角叉菜胶致炎。致炎4 h后,用游标卡尺测量小鼠右后足肿胀厚度,计算足肿胀率和足肿胀抑制率。足肿胀率=[(造模后右后足厚度-造模前右后足厚度)/造模前右后足厚度]×100%,足肿胀抑制率=[(模型组平均足肿胀率-给药组平均足肿胀率)/模型组平均足肿胀率]×100%。
2.2.3 ELISA法检测小鼠致炎足中PGE2和NO水平 “2.2.2”项下操作完成后,迅速剪下小鼠致炎足,剥皮、剪碎后用匀浆机粉碎,在生理盐水中浸泡1 h,离心,取上清,按照ELISA试剂盒说明书测定PGE2、NO水平。
2.3 EC-PFSC对CIA大鼠的作用
2.3.1 造模、分组及给药 取健康雄性大鼠50只,适应性饲养7 d后,随机选10只作为空白组。其余参照文献[7]建造CIA模型。造模成功的大鼠随机分为模型组、雷公藤组(40.0 mg/kg)、传统复方黑骨藤组(230.0 mg/kg,以传统复方黑骨藤提取物干粉重量计)、EC-PFSC组(194.6 mg/kg,以混合有效组分干粉重量计),每组10只,其中2个实验组剂量分别由小鼠传统复方黑骨藤组和EC-PFSC中剂量组按人和动物间体表面积换算为大鼠剂量而得。造模21 d后,各给药组对应给药,空白组、模型组给予生理盐水,各组灌胃给药容量均为10 mL/kg,每天1次,连续28 d。
2.3.2 一般指标检测 于造模前一天及造模后第7天开始,用游标卡尺测量大鼠右足趾厚度(它与左足趾厚度的差值作为肿胀度,mm),每隔7 d记录肿胀情况及体质量。
2.3.3 关节炎指数(arthritis index,AI)评分 造模后第7天开始,定期观察并记录全身关节病变程度,每4 d 1次,按5级评分法评价[8](0分,无红肿;1分,趾关节红肿;2分,趾关节和足趾肿胀;3分,趾关节以下的足爪肿胀;4分,包括踝关节在内的全部足爪肿胀),将4个关节的积分累计起来,即为每只大鼠的AI。
2.3.4 免疫组化法检测caspase3表达 于实验第49天后处死各组大鼠,无菌条件下取右踝关节,剔除多余的肌肉组织,10%甲醛固定,脱水,包埋,切片。按照免疫组化试剂盒操作步骤检测caspase3表达。免疫组化切片底色为白色,阳性表达为浅黄色或棕黄色(表达于细胞浆、细胞膜,或间质),阴性表达为蓝色。图像采集(BA200Digital 数码三目摄像显微摄像系统)为100倍下观察全部组织,400倍下选取1个视野采集图像。图像的平均光密度通过Image-Pro Plus 6.0图像分析系统测定,每张切片随机选取3个视野取其平均值。
2.3.5 Western blot法检测iNOS、COX-2、P-ERK、P-p38蛋白表达 取研碎后的大鼠右踝关节适量,加10倍组织体积裂解液匀浆,冰上裂解,4 ℃、12 000 r/min离心10 min,收集上清,BCA法测定蛋白浓度,SDS-PAGE电泳分离总蛋白,转移到PVDF膜,封闭1 h后,分别加入相应一抗,4 ℃过夜。TBST洗涤3次,每次10 min,加入二抗(1∶3 000),室温孵育30 min,TBST洗涤3次,每次10 min,加入ECL,使膜与显色液充分接触反应1~2 min,凝胶成像系统拍照分析。Alpha软件处理系统分析目标带的光密度值,结果以目的蛋白与内参蛋白灰度值的比值表示。
2.3.6 RT-qPCR法检测caspase3、iNOS、COX-2 mRNA表达 取研碎后的大鼠右踝关节100 mg,Trizol法提取总RNA,并测定其浓度与纯度,取纯度好的样品按照说明书进行逆转录与PCR扩增试验。PCR反应体系为25 μL,扩增条件为预变性95 ℃,10 min;循环(40次)95 ℃,15 s~60 ℃,60 s;熔解曲线60 ℃~95 ℃,每15 s升温0.3 ℃,结果以β-actin基因作为内参,采用2-ΔΔCT法对基因表达进行相对定量分析。引物序列见表1。

表1 荧光定量PCR引物序列
2.4 UPLC法测定EC-PFSC中14种有效化合物
2.4.1 供试品溶液制备 分别称取“2.1”项下黑骨藤、秦艽、延胡索各有效部位和传统复方黑骨藤提取物干粉适量,50%甲醇各定容于10 mL量瓶,摇匀,过0.22 μm微孔滤膜,取续滤液,即得EC-PFSC组分溶液(1.10 mg/mL)和传统复方黑骨藤提取物溶液(1.75 mg/mL)。
2.4.2 对照品溶液制备 精密称取新绿原酸、绿原酸、隐绿原酸、马钱苷酸、6′-O-β-D-葡萄糖基龙胆苦苷、原花青素A1、原花青素A2、原阿片碱、延胡索乙素、异绿原酸C、脱氢紫堇碱、延胡索甲素、杠柳毒苷、龙胆苦苷对照品适量,加甲醇制成每1 mL分别含0.430、0.346、0.224、0.184、0.285、0.295、0.320、0.143、0.353、0.243、0.223、0.183、0.354、2.462 mg的溶液,摇匀,即得。
2.4.3 色谱条件 ACQUITY UPLC® BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);流动相磷酸(pH=3.0)(A)-甲醇(B),梯度洗脱(0~10 min,95%~75%A;10~25 min,75%~60%A;25~30 min,60%~40%A;30~40 min,40%~0A);体积流量0.3 mL/min;柱温45 ℃;检测波长221 nm;进样量1 μL。

3 结果
3.1 EC-PFSC不同剂量对小鼠耳肿胀的影响 表2显示,与模型组比较,雷公藤组、传统复方黑骨藤组和EC-PFSC高、中剂量组均可降低小鼠耳肿胀度(P<0.01),其中EC-PFSC高、中剂量组耳肿胀抑制率分别为30.46%和32.32%,与传统复方黑骨藤组(31.90%)接近。
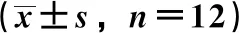
表2 EC-PFSC对二甲苯致小鼠耳肿胀的影响
3.2 EC-PFSC不同剂量对小鼠足肿胀的影响 表3显示,与模型组比较,其他各组均可抑制小鼠足肿胀度(P<0.05,P<0.01),其中EC-PFSC中剂量组抑制作用较好,肿胀抑制率可达29.42%,高于EC-PFSC高剂量组(19.62%)和传统复方黑骨藤组(18.94%)。
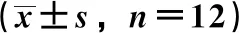
表3 EC-PFSC对角叉菜胶致小鼠足肿胀的影响
3.3 EC-PFSC不同剂量对小鼠致炎足中PGE2、NO水平的影响 图1显示,与空白组比较,模型组和传统复方黑骨藤组小鼠肿胀足组织中PGE2、NO水平均增加(P<0.05,P<0.01),表明炎症反应剧烈;与模型组和传统复方黑骨藤组比较,EC-PFSC高、中剂量组小鼠肿胀足组织中PGE2、NO水平均降低(P<0.01),其中EC-PFSC中剂量组PGE2、NO降低率分别为40%和20%,与雷公藤组PGE2、NO降低率相当。以上结果提示EC-PFSC中剂量组抗炎药效最优,因此选择278.0 mg/kg作为后续实验剂量。
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与传统复方黑骨藤组比较,△△P<0.01。
3.4 EC-PFSC对CIA大鼠体质量、足肿胀度、AI的影响 图2显示,二次致炎(第7天)前,各组大鼠体质量无明显差异(P>0.05),二次致炎(第7天)后至灌胃给药(第21天)前,与空白组比较,各造模组大鼠体质量下降(P<0.01),足肿胀度和AI评分升高(P<0.01),表明造模成功。灌胃给药(第21天)后,与模型组比较,传统复方黑骨藤组和EC-PFSC组随着给药时间的增加均可在一定程度上缓解大鼠体质量的减轻、抑制足肿胀度的增加及降低AI评分,在第49天时,与传统复方黑骨藤组比较,EC-PFSC组大鼠足肿胀度和AI评分降低(P<0.05)。以上分析结果提示EC-PFSC对CIA大鼠的关节炎有一定抑制效果,而且不良反应较小。
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与传统复方黑骨藤组比较,△P<0.05。
3.5 EC-PFSC对CIA大鼠踝关节中caspase3蛋白和mRNA表达的影响 图3显示,与空白组比较,模型组大鼠踝关节中caspase3蛋白和mRNA表达均降低(P<0.01);与模型组比较,EC-PFSC组大鼠踝关节中caspase3蛋白和mRNA表达升高(P<0.01),其平均光密度值可达0.307,与空白组相当,且与传统复方黑骨藤组比较,EC-PFSC组大鼠踝关节中caspase3蛋白和mRNA表达均升高(P<0.01),提示EC-PFSC可升高CIA大鼠踝关节中caspase3蛋白和mRNA的表达。图4显示,各组CIA大鼠免疫组化切片可见caspase3阳性表达为黄色,阴性表达为蓝色;空白组caspase3表达最高,其次是EC-PFSC组,而模型组表达明显降低。变化规律与图3A基本一致。
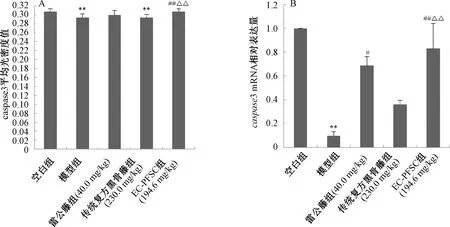
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与传统复方黑骨藤组比较,△△P<0.01。
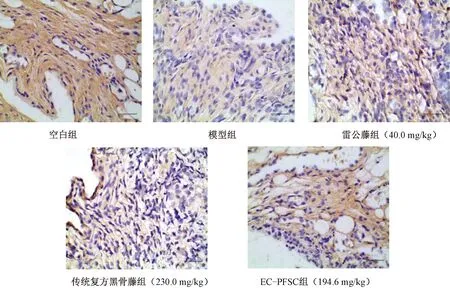
图4 各组大鼠踝关节caspase3免疫组化染色(×400)
3.6 EC-PFSC对CIA大鼠踝关节中P-ERK、P-p38蛋白表达的影响 图5显示,与空白组比较,模型组大鼠踝关节中P-ERK、P-p38蛋白表达升高(P<0.01);与模型组比较,EC-PFSC组、传统复方黑骨藤组和雷公藤组大鼠踝关节中P-ERK、P-p38蛋白表达均降低(P<0.05,P<0.01),其中EC-PFSC组大鼠踝关节中P-ERK、P-p38降低率分别达89%和47%,提示EC-PFSC可使CIA大鼠踝关节中过表达的P-ERK、P-p38蛋白水平得到有效恢复。
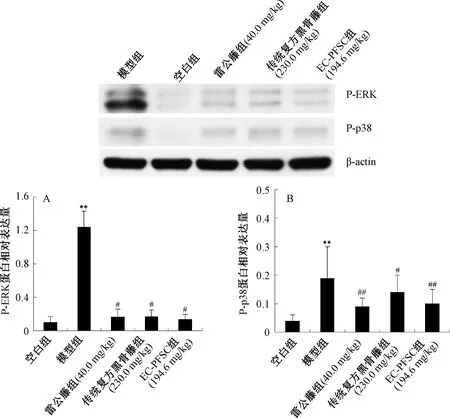
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
3.7 EC-PFSC对CIA大鼠踝关节中iNOS、COX-2蛋白和mRNA表达的影响 图6显示,与空白组比较,模型组大鼠踝关节中iNOS、COX-2蛋白和mRNA表达升高(P<0.01);与模型组比较,EC-PFSC组、传统复方黑骨藤组和雷公藤组大鼠踝关节中iNOS、COX-2蛋白和mRNA表达均降低(P<0.05,P<0.01),且与传统复方黑骨藤组比较,EC-PFSC组大鼠踝关节中iNOS、COX-2蛋白表达均降低(P<0.05,P<0.01),提示EC-PFSC可有效抑制CIA大鼠踝关节中iNOS、COX-2蛋白和mRNA的表达。
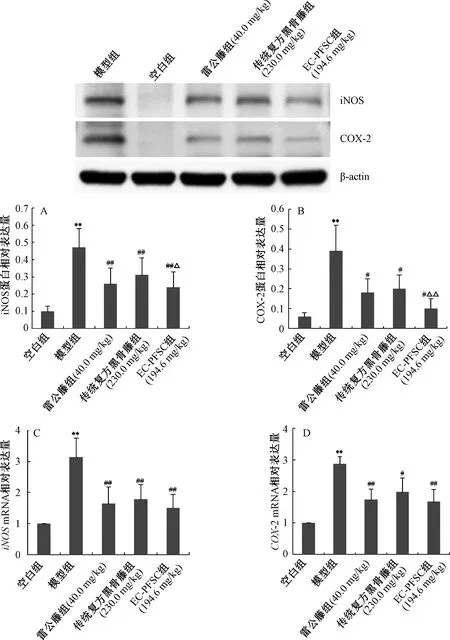
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与传统复方黑骨藤组比较,△P<0.05,△△P<0.01。
3.8 UPLC检测分析结果 图7显示,在221 nm波长处,色谱峰杂质干扰较少,体现的信息最完整,分离效果最好。根据14种有效化合物最大吸收光谱,在不同波长条件下测定其峰面积,外标法计算含量。表4显示,与传统复方黑骨藤提取物比较,EC-PFSC组分中有效化合物总含量明显升高,达49.03%,提示EC-PFSC组分达到了富集效果,其中环烯醚帖类化合物含量占比达40.73%。
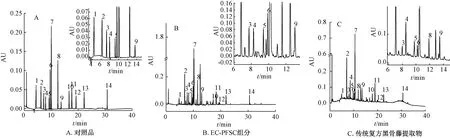
1.新绿原酸 2.绿原酸 3.隐绿原酸 4.马钱苷酸 5.6′-O-β-D-葡萄糖基龙胆苦苷 6.原花青素A1 7.龙胆苦苷 8.原花青素A2 9.原阿片碱 10.延胡索乙素 11.异绿原酸C 12.脱氢紫堇碱 13.延胡索甲素 14.杠柳毒苷

表4 样品中14种有效化合物总含量
4 讨论
二甲苯致小鼠耳肿胀和角叉菜胶致小鼠足肿胀是两种经典急性炎症动物模型,常用以评价中药抗炎活性,故本研究首先选用这两种模型筛选EC-PFSC抗炎最佳剂量,该两项实验结果显示EC-PFSC中剂量组减轻小鼠耳肿胀和足肿胀程度较明显。PGE2可促进组织的红、肿、热、痛,具有血管扩张剂和增加血管通透性的作用[9],是急性炎症早期的典型病理改变[10],NO过表达会引起组织和细胞损伤,加重炎症反应[11]。因此,选择PGE2、NO作为抗炎药效筛选的评价指标,具有一定的代表意义。ELISA实验结果显示,EC-PFSC能抑制炎症介质NO和PGE2的释放,且EC-PFSC中剂量组协同增效作用最佳,这与前面小鼠耳肿胀和足肿胀实验结果一致,故后续实验选定EC-PFSC中剂量(278.0 mg/kg)进行抗RA机制研究。
caspase3通常以非活性酶原形式存在于细胞质中,在转录、翻译等水平调控细胞凋亡,然而炎症的发生与凋亡息息相关。当巨噬细胞吞噬、消化凋亡过程中形成的凋亡小体后,凋亡小体内容物则不会外溢,进而减轻炎症反应[12]。免疫组化和RT-qPCR实验结果显示,EC-PFSC组caspase3蛋白和mRNA表达升高,且药效优于传统复方黑骨藤组,说明EC-PFSC可上调caspase3表达,促进细胞凋亡,从而起到炎症保护作用。
MAPKs信号通路是细胞内信号转导的关键途径之一,活化后可介导胞外信号刺激传入胞内,参与调节炎症、凋亡、增殖和分化等多种重要生理过程[13]。ERK、p38和JNK是参与炎症反应的主要MAPKs家族成员[14],其中ERK和p38在真核细胞中主要以磷酸化形式存在,近年来作为RA潜在的重要信号分子受到关注。Western blot实验结果显示,EC-PFSC组P-ERK和P-p38蛋白表达下调,说明EC-PFSC可抑制ERK和p38的过度磷酸化,从而抑制MAPKs信号通路的激活,达到减缓炎症发展的效果。
有毒介质NO的水平与炎症疾病的发生密切相关,其表达受iNOS的调控,因此iNOS是炎症过程中的关键酶[15],炎症反应检测的一个重要指标[16]。COX-2一般在正常组织中活性较低,受到外界刺激时可快速应答一些促炎因子(如PGE2),因此被认为是炎症发生过程中的重要角色[17]。Western blot和RT-qPCR实验结果显示,EC-PFSC组可抑制iNOS、COX-2蛋白和mRNA的过表达,且EC-PFSC组对iNOS、COX-2蛋白表达的抑制作用优于传统复方黑骨藤组,说明EC-PFSC可通过下调炎症介质iNOS、COX-2的表达,以抑制炎性因子的产生,从而发挥抗炎作用。
相关药理研究表明,绿原酸类、黄酮类、环烯醚帖类、生物碱类等有效成分对抗RA有促进作用[18-21],且UPLC检测结果发现EC-PFSC组分中14种有效化合物总含量高于传统复方黑骨藤提取物,进一步验证了富集之后的EC-PFSC对比传统复方黑骨藤有更为显著的抗炎药效。
综上,复方黑骨藤有效组分(EC-PFSC)对类风湿性关节炎有一定的治疗作用,其作用机制可能与抑制MAPKs信号通路中ERK和p38的过度磷酸化,进而抑制下游分子iNOS、COX-2的高表达,降低炎症因子的过量分泌,同时激活凋亡因子caspase3的表达,平衡细胞增殖与凋亡有关。
