白杨素磷脂复合物固体分散体的制备及其体内药动学研究
2021-10-26李开言王聪颖
庞 榕, 李开言, 王聪颖
(1.黄河科技学院医学院,河南 郑州 450005;2.河南省中医药研究院,河南 郑州 450004)
白杨素是蜂胶主要有效成分,也可从紫葳科植物木蝴蝶中提取得到,具有抗菌、抗肿瘤、降血脂、抗糖尿病、预防心脑血管疾病等作用[1-2],研发价值较高,但由于该成分水溶性和脂溶性较差,口服生物利用度较低,导致临床应用受到很大限制[3]。崔晓鸽等[3]采用磷脂复合物技术,在一定程度上提高了白杨素体内吸收,但其疏水性较强,从而影响了药物溶解度和溶出度[4-8],故需要联合其他制剂技术以进一步提高其口服吸收生物利用度。
固体分散体是指通过熔融法、溶剂挥发法等制剂技术,将药物分散于亲水载体(如PVP K30等)中的一种固体粉末,有助于增加亲水性,改善溶解度,提高溶出速率和溶出度,也可进一步促进药物口服吸收[9-12]。因此,本实验采用聚乙烯吡咯烷酮 K30(PVP K30)将白杨素磷脂复合物进一步制成固体分散体,对其存在状态、溶解度、体外溶出等进行了研究,并考察了其体内药动学。
1 材料
1.1 仪器 UW220H型电子分析天平(日本岛津公司);U3000型高效液相色谱仪(美国戴安公司); YSCL-3A型集热式加热磁力搅拌器(上海秋佐科技设备有限公司);TR6120-AT型溶出试验仪(配置自动取样仪,深圳市锐拓仪器设备有限公司);HT-110X50型恒温振荡器(上海赫田科学仪器有限公司);SPR-DT12A-12型智能药物溶出仪(天津赛普瑞实验设备有限公司);D8 ADV型X射线粉末衍射仪(德国Bruker公司)。
1.2 试剂与药物 白杨素对照品(纯度99.1%,批号111701-201501,中国食品药品检定研究院);白杨素原料药(纯度>98.5%,批号171213P,西安一品生物科技有限公司)。大豆磷脂(批号191005,辅必成医药科技有限公司);聚乙烯吡咯烷酮K30(PVP K30,批号201548234-3,德国巴斯夫公司)。四氢呋喃为色谱纯(德国Merck公司);正辛醇(批号190915)、无水乙醇(批号191110)(国药集团化学试剂有限公司)。
1.3 动物 清洁级SD大鼠,雌雄兼用,体质量(280±20)g,购自河南省动物实验中心,动物生产许可证号SCXK-2016-0001,饲养于相对湿度40%~55%、温度20~25 ℃环境下。
2 方法与结果
2.1 白杨素含量测定
2.1.1 色谱条件 ZORBAX SB C18色谱柱(250 mm×4.6 mm,5 μm);流动相乙腈-0.1%磷酸(55∶45);体积流量1.0 mL/min;柱温30 ℃;检测波长268 nm;进样量20 μL。
2.1.2 线性关系、方法学考察 精密称取白杨素对照品20 mg,溶于100 mL乙腈中,作为贮备液(0.2 mg/mL),精密量取适量,“2.1.1”项下流动相稀释至10.0、5.0、2.5、1.0、0.5 μg/mL,在“2.1.1”项色谱条件下进样测定。以白杨素质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程为Y=19.481 4X-2.159 1(r=0.999 6),在0.5~10.0 μg/mL范围内线性关系良好。
取10.0、5.0、0.5 μg/mL上述溶液各3份,在“2.1.1”项色谱条件下进样测定,测得日内精密度RSD分别为0.12%、0.16%、0.24%,日间精密度RSD分别为0.51%、0.47%、0.83%。取约10 mg白杨素磷脂复合物固体分散体至100 mL量瓶中,流动相溶解定容,过滤后取续滤液5 mL至10 mL量瓶中,流动相定容,作为供试品溶液,于0、2、4、6、8、12、24 h在“2.1.1”项色谱条件下进样测定,测得白杨素峰面积RSD为1.06%,表明溶液在24 h内稳定性良好。取白杨素含量已知的磷脂复合物10 mg,分别加入贮备液1、1.5、2.0 mL,同法制备供试品溶液各3份,在“2.1.1”项色谱条件下进样测定,测得白杨素平均加样回收率分别为100.14%、99.83%、99.69%,RSD分别为1.06%、0.83%、1.34%。取对照品溶液适量,流动相逐步稀释,分别以信噪比(S/N)10、3为定量限、检测限,测得两者分别为10、5 ng/mL。
2.2 白杨素磷脂复合物及其固体分散体制备 称取白杨素25.4 mg、磷脂93.6 mg(摩尔比为1∶1.2),加入四氢呋喃后密封,置于45 ℃水浴中磁力搅拌4 h,减压旋蒸,即得磷脂复合物,为浅黄色半固体状的残留物,置于干燥器中保存。同法制备3批,参考文献[3]报道测得其复合率均接近100%。
取白杨素磷脂复合物、PVP K30 适量,加入无水乙醇得混悬液,密封,置于45 ℃水浴中磁力搅拌至溶液澄清,减压旋蒸得残留物,即得固体分散体,粉碎,过60目筛,保存于干燥器中备用。
2.3 体外释放研究 取白杨素磷脂复合物及不同载体比例的固体分散体(以白杨素计,含量均为15 mg),加入3 mL空白溶出介质配制混悬液,转入透析袋中并扎紧[12](截留分子量为8 000~14 000 Da),设定仪器温度、转速分别为37 ℃、100 r/min,溶出介质为0.5%SDS溶液,体积为900 mL,于0、15、30、60、90、120、240、360、480、720 min各取样3 mL,补加3 mL空白溶出介质,维持总体积不变,6 000 r/min离心10 min,取上清液进样分析。
2.4 磷脂复合物与载体比例筛选 图1显示,原料药720 min内累积溶出度仅为20.92%,而磷脂复合物提高至43.51%;磷脂复合物与载体PVP K30比例为1∶2、1∶4、1∶6、1∶8时,均可提高白杨素溶出速率和溶出度,而且随着后者用量增加更明显,综合考虑溶出速率、溶出度、固体分散体中药物含量等因素,最终确定两者比例为1∶6。

图1 白杨素体外溶出曲线
2.5 X射线粉末衍射(XRPD)分析 取原料药、物理混合物(白杨素+磷脂+PVP K30)、磷脂复合物、固体分散体适量,置于玻璃内槽中,玻璃片压制平整后进行XRPD扫描,设定条件为Cu-Kα靶,电压40 kV,范围(2θ)3°~45°,速度8°/min,结果见图2。由此可知,原料药图谱中可见特征晶型峰,并且在物理混合物图谱中仍存在;虽然磷脂XRPD图谱中也有晶型峰[3],但本实验在物理混合物图谱中未发现,这与PVP K30用量远大于磷脂用量有关,导致后者XRPD被掩盖;磷脂复合物图谱中无白杨素特征晶型峰,表明该成分以无定型状态存在;在固体分散体图谱中也未发现白杨素特征晶型峰,表明该成分仍以无定型状态存在。

注:A~E分别为白杨素、PVP K30+磷脂、物理混合物、白杨素磷脂复合物、白杨素磷脂复合物固体分散体。
2.6 溶解性研究 取过量原料药、磷脂复合物、固体分散体适量,置于三角瓶中,加入适量正辛醇或蒸馏水,25 ℃水浴中磁力搅拌12 h,取上层混悬液,6 000 r/min离心5 min,取上清液过滤,在“2.1.1”项色谱条件下进样测定,结果见表1。由此可知,将白杨素制成磷脂复合物后,在水、正辛醇中表观溶解度分别提高至3.21、11.11倍(P<0.01);将磷脂复合物进一步制成固体分散体后,在正辛醇中表观溶解度无明显变化(P>0.05),而在水中提高了3.53倍(P<0.01),表明将磷脂复合物制成固体分散体后可大大提高前者水溶性,而且对脂溶性无影响。
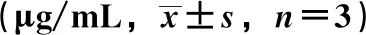
表1 白杨素表观溶解度测定结果
2.7 体内药动学研究
2.7.1 药液制备 取原料药、磷脂复合物、固体分散体适量,0.5%CMC-Na溶液制成含2 mg/mL白杨素的混悬液,即得。
2.7.2 分组、给药与采血 取大鼠18只,给药前禁食12 h,随机分为3组,分别灌胃给予“2.7.1”项下3种药液,剂量均为20 mg/kg。参考文献[3]报道及预实验结果,乙醚麻醉大鼠后于0.167、0.5、1、1.5、2、2.5、3、4、8、12 h迅速眼眶采血0.2~0.3 mL,置于肝素抗凝处理的离心管中,手动振荡,2 500 r/min离心20 min,取血浆,密封,保存在冰箱冷冻层。
2.7.3 血浆样品处理 量取正己烷100 mL、二氯甲烷50 mL、异丙醇10 mL,混匀后超声提取5 min,作为血浆样品提取液,室温解冻后取100 μL至离心管中,加入内标溶液(称取柚皮素对照品10 mg,溶于25 mL乙腈中,即得,质量浓度为400 ng/mL)80 μL、提取液3 mL,于通风橱中涡旋混合5 min,静置30 min,转移有机相至空白离心管中,45 ℃氮气吹干(注意控制氮气体积流量),加入100 μL流动相复溶,8 000 r/min离心5 min后进样分析。
2.7.4 血浆对照品溶液制备及线性关系考察 取“2.1.2”项下白杨素对照品贮备液,乙腈逐步稀释至20、50、100、500、1 000、1 500 ng/mL,各取500 μL,45 ℃氮气吹干后加入500 μL大鼠空白血浆,即得质量浓度为20、50、100、500、1 000、1 500 ng/mL的血浆对照品溶液,在“2.1.1”项色谱条件下进样测定。以白杨素、内标(柚皮素)峰面积比值为纵坐标(Y),白杨素质量浓度为横坐标(X)进行回归,得方程为Y=0.168 3X+0.101 2(r=0.993 4),在20~1 500 ng/mL范围内线性关系良好。
2.7.5 方法学考察 取20、500、1 500 ng/mL血浆对照品溶液,在“2.1.1”项色谱条件下各进样测定6次,测得日内精密度RSD分别为2.16%、1.95%、2.00%,6 d内日间精密度RSD分别为10.14%、8.43%、5.69%,表明该方法精密度良好。取血浆样品,按 “2.7.3”项下方法处理,于0、4、8、12、24、48 h在“2.1.1”项色谱条件下进样测定,测得白杨素、内标峰面积比值RSD为9.18%,表明样品稳定性良好。取1只大鼠,按20 mg/kg剂量灌胃给予白杨素混悬液,1.5 h后眼眶采血约3.5 mL,处死,取血浆,分为6份,按“2.7.3”项下方法处理,在“2.1.1”项色谱条件下进样测定,测得白杨素、内标峰面积比值RSD为10.83%,表明该方法重复性良好。取大鼠空白血浆,配制低(20 ng/mL)、中(500 ng/mL)、高(1 500 ng/mL)质量浓度样品溶液,按“2.7.3”项下方法处理,在“2.1.1”项色谱条件下进样测定,测得平均加样回收率在87.19%~97.46%之间。取20 ng/mL血浆对照品溶液,逐步稀释后在“2.1.1”项色谱条件下进样测定,测得检测限约为2.0 ng/mL,定量限约为5.0 ng/mL。
2.7.6 结果分析 血药浓度-时间曲线见图3,再采用3P97程序统计矩模型计算药动学参数,结果见表2。由此可知,与原料药比较,磷脂复合物Cmax、AUC0~t升高(P<0.05,P<0.01),与文献[3]报道基本一致;与磷脂复合物比较,固体分散体tmax缩短(P<0.05),Cmax、AUC0~t升高(P<0.01)。另外,磷脂复合物、固体分散体相对生物利用度分别增加至1.44、2.16倍。

图3 白杨素血药浓度-时间曲线(n=6)

表2 白杨素主要药动学参数
3 讨论
磷脂分子中2条长脂肪链包裹白杨素分子,同时通过氢键、范德华力等作用力结合在一起而形成磷脂复合物[11],它继承了磷脂既亲水又亲脂的特性,从而使白杨素水溶性、脂溶性均有所提高,但前者幅度一般不大,这是因为磷脂是一种疏水性物质,而且磷脂复合物一般以半固体形式存在,分散性差,在一定程度上影响了药物体外溶出度,不利于其生物利用度的提高[13]。
本实验结果显示,固体分散体可提高白杨素磷脂复合物的水溶性及体外溶出度,可能是由于亲水性材料PVP K30包裹了磷脂复合物,从而增强了其亲水性,而且PVP K30用量是磷脂复合物的6倍,可使后者高度分散于载体材料中,有助于提高其水溶性、溶出速率、溶出度,促进药物吸收。目前,已有关于白杨素口服纳米制剂的报道[14-15],但其包封率、载药量均不高,制备工艺复杂;本实验报道的白杨素磷脂复合物固体分散体制备工艺更为简单,适合国内中药制药公司的实际生产水平。
综上所述,将白杨素磷脂复合物制成固体分散体后,可解决其水溶性差、溶出速率及累积溶出度低的问题,并能进一步促进药物吸收[16-17]。但药物经胃肠道吸收进入血液循环的过程较为复杂,与其水溶性、脂溶性、酶降解作用等因素均有很大关系,而现有制剂技术无法解决药物所有的吸收瓶颈,导致口服生物利用度的改善情况也会受到影响,今后将作进一步研究。
