芦荟大黄素抑制肝癌细胞增殖与迁移的机制
2021-10-26谭章斌徐由财丁文俊邓穗晖张竞之
谭章斌, 徐由财, 丁文俊, 邓穗晖, 刘 彬, 张竞之
(广州医科大学附属第二医院中医科,广东 广州 510260)
肝癌是最普遍和最具侵略性的恶性肿瘤之一,大多数患者确诊时已处于中晚期,并发生局部入侵或远处转移,失去了根治性手术的机会[1]。靶向药物是治疗中晚期肝癌的主要临床疗法,但目前由于其严重的不良反应和耐药性限制了其应用,故急需开发新型治疗药物。Src激酶是一种位于细胞内的非受体酪氨酸激酶,参与肿瘤生成,与肿瘤细胞增殖、抗凋亡、入侵和转移等活动行为密切相关[2]。芦荟大黄素是一种从大黄、芦荟等植物中提取出的化合物,具有多种药理活性,包括显著的抗肿瘤作用[3]。本研将考察芦荟大黄素对肝癌细胞增殖与迁移的影响,以及Src/信号转导及转录激活因子3(STAT3)信号通路在该成分抗肝癌中的作用。
1 材料与方法
1.1 试剂 芦荟大黄素购自成都曼斯特生物科技有限公司,二甲基亚砜(DMSO, 美国Cell Signaling Technology公司)溶解,本研究以DMSO为溶剂对照组。DMEM、PBS、胎牛血清均购自美国Gibco公司;c-Myc(#9402)、p-Src(#6943)、Src(#2109)、STAT3(#12640)、GAPDH(#5174)一抗均购自美国Cell Signaling Technology公司;p-STAT3(ab76315)、Cyclin D1(ab134175)、MMP-2(ab97779)、MMP-9(ab76003)一抗均购自英国Abcam公司;MTS(G3582)购自美国Promega公司;EdU染色试剂盒(C10310-3)购自广州市锐博生物科技有限公司;结晶紫染色试剂盒(KGA229)购自江苏凯基生物技术股份有限公司。
1.2 细胞 人SMMC-7721、Hep3B肝癌细胞购自中国科学院上海细胞库,用DMEM培养,添加10%胎牛血清、1%青霉素-链霉素溶液,置于5%CO2、37 ℃加湿细胞培养箱中常规培养。
1.3 细胞活性评价 采用MTS法。收集SMMC-7721和Hep3B肝癌细胞,以5×103/mL密度接种到96孔板,细胞贴壁生长后给予不同浓度的芦荟大黄素,培养24 h后弃培养基,加入MTS和DMEM混合溶液(MTS∶DMEM=1∶5)100 μL,在37 ℃下孵育1 h。使用酶标仪读取器读取490 nm吸光度,计算细胞活性。
1.4 平板克隆形成 收集培养至对数生长期的SMMC-7721和Hep3B肝癌细胞,调整为每皿300个,并在60 mm皿中重新接种。细胞每3 d用10、20、40 μmol/L芦荟大黄素干预1次,在37 ℃细胞培养箱培养14 d。形成肉眼可见的细胞集落后弃培养基,4%多聚甲醛固定10 min,结晶紫染色10 min,洗净后晾干、拍照。
1.5 EdU染色 收集SMMC-7721和Hep3B肝癌细胞,在96 孔板(每孔5× 103个)中培养,第2天加入10、20、40 μmol/L芦荟大黄素继续培养24 h。根据试剂盒说明书弃培养基,加入A液2 h标记细胞,PBS洗涤细胞3次,4%多聚甲醛固定10 min,Apollo染色液和Hochest 33342染色液依次孵育30 min,荧光显微镜进行观察拍照,计算EdU阳性细胞数。EdU阳性细胞数=[EdU阳性细胞(红色)/细胞总数(蓝色)]×100%。
1.6 Transwell细胞迁移实验 细胞迁移实验使用24孔板及孔径为8.0 μm的小室进行,5×105个SMMC-7721肝癌细胞悬浮于无血清DMEM中,播种到上腔室,给予不同浓度芦荟大黄素,下腔中加入含有10%胎牛血清的DMEM。孵育20 h后,4%多聚甲醛固定细胞,结晶紫对迁移至下室的肝癌细胞染色,在正置显微镜下观察,计算细胞迁移数。
1.7 蛋白印迹(Western blot) SMMC-7721肝癌细胞在100 mm培养皿中培养48 h后,10、20、40 μmol/L芦荟大黄素处理24 h,预先在RIPA裂解液中添加蛋白酶抑制剂和磷酸酶抑制剂,冷PBS洗涤2次,裂解液收集处理后的肝癌细胞蛋白,定量后将等量蛋白通过SDS-PAGE凝胶分离,转移到聚氯酰胺氟化物(PVDF)膜,用含5% BSA的TBST封闭2 h后,一抗、二抗依次对膜进行孵育,通过增强型化学发光试剂盒进行检测。
1.8 分子对接与分子动力学 采用Autodock Vina(美国Scripps研究所)软件[4]分析Src(PDB ID 1YOL)与芦荟大黄素(CID 10207)之间的结合相互作用,通过去除水分子和结合的配体来制备Src的分子对接模拟蛋白,使用YASARA进行配体的能量最小化。本研究中Src的抑制剂结合结构域对应于Src的蛋白质-配体结合位点,采用YASARA软件[5]执行分子动力学模拟,模拟退火最小化的起始时间设置为298 K,每10步速度将速度降低0.9,持续5 ps,最小化能量后,使用Berendsen温控器调节系统温度,以最大程度地降低温度控制的影响,最后以2 fs速率进行100 ns的MD模拟,每10 ps保存坐标。
1.9 表面等离子共振 使用PlexArray HT系统(美国Plexera)进行表面等离子共振筛选以确定芦荟大黄素和Src的结合,将Src蛋白打印在3D传感器芯片上,并通过光穿越反应将其固定,在25 ℃下,以2 μL/s 体积流量流动样品进行300 s缔合,在运行缓冲液中进行300 s解离,以3 μL/s 体积流量运行200 s的再生缓冲液,获得典型的结合曲线(为了获得结合亲和力,至少用3个浓度流动相依次洗脱)。在折射率变化已知(1 200 RU)的运行缓冲液中,1%甘油校准每个斑点,将所有结合信号转换为标准折射单位(RU),使用SPRi分析软件(Plexera SPR数据分析模型)收集分析测定数据。

2 结果
2.1 芦荟大黄素对SMMC-7721和Hep3B肝癌细胞增殖的影响 如图1A所示,10、40 μmol/L芦荟大黄素处理后,SMMC-7721和Hep3B肝癌细胞的生存率分别降低到79.52%、88.19%和47.49%、61.29%,并呈浓度依赖性(P<0.05),作用24 h后两者IC50分别为37.55、52.58 μmol/L。如图1B所示,10、20、40 μmol/L芦荟大黄素可浓度依赖性地抑制肝癌细胞克隆形成。如图1C所示,10、20、40 μmol/L芦荟大黄素处理24 h后,可呈剂量依赖性的方式抑制SMMC-7721和Hep3B肝癌细胞增殖能力,EdU阳性细胞数分别为15.32%、23.30%,11.19%、18.45%,6.08%、12.56%,低于对照组的34.27%、39.46%(P<0.05)。由于与Hep3B肝癌细胞比较,SMMC-7721肝癌细胞对芦荟大黄素更为敏感,故本实验选用SMMC-7721肝癌细胞探索该成分抗肝癌作用。
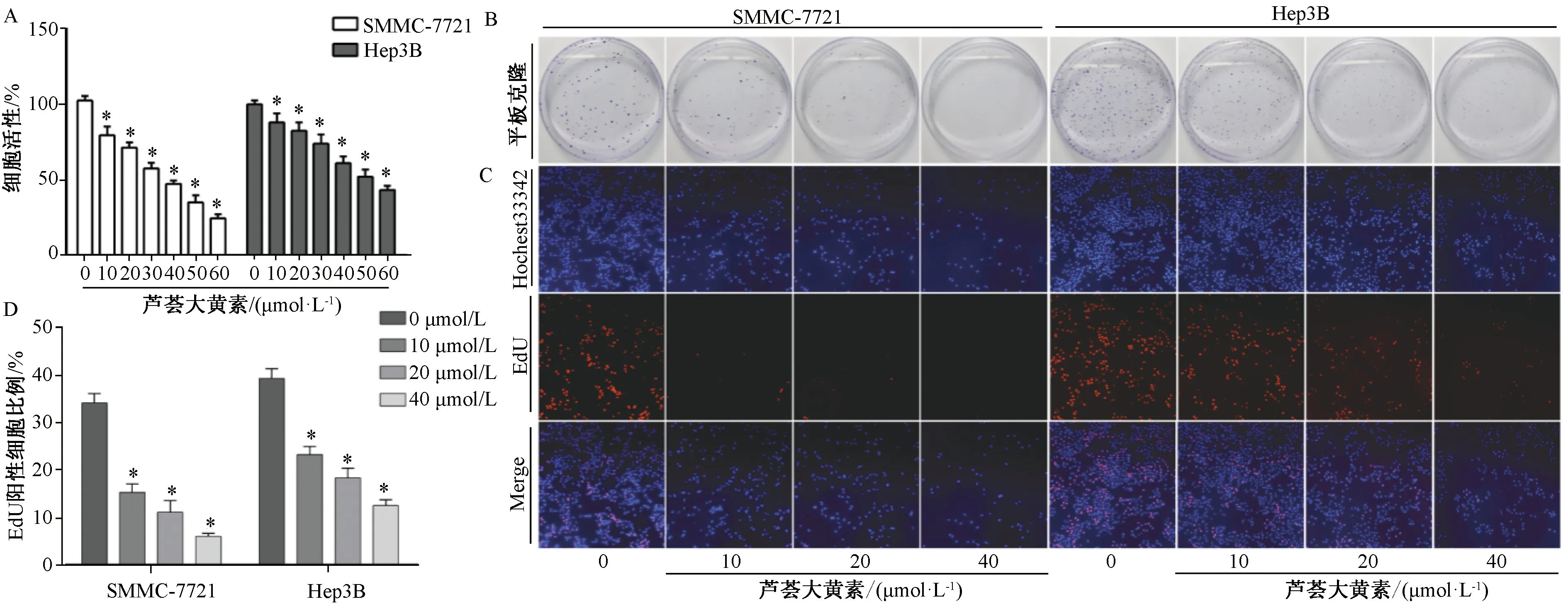
注:A为大黄对肝癌细胞活性的影响,B为10、20、40 μmol/L芦荟大黄素对肝癌细胞平板克隆形成的影响,C为芦荟大黄素对肝癌细胞增殖的影响,D为EdU阳性细胞数比例。与对照组比较,*P<0.05。
2.2 芦荟大黄素对SMMC-7721肝癌细胞迁移的影响 如图2所示,芦荟大黄素减少了SMMC-7721肝癌细胞中迁移细胞的数量,并呈浓度依赖性;10、20、40 μmol/L芦荟大黄素组的迁移细胞数分别为每个视野178.3、136.3、85.6个,低于对照组的每个视野452.6个(P<0.05)。
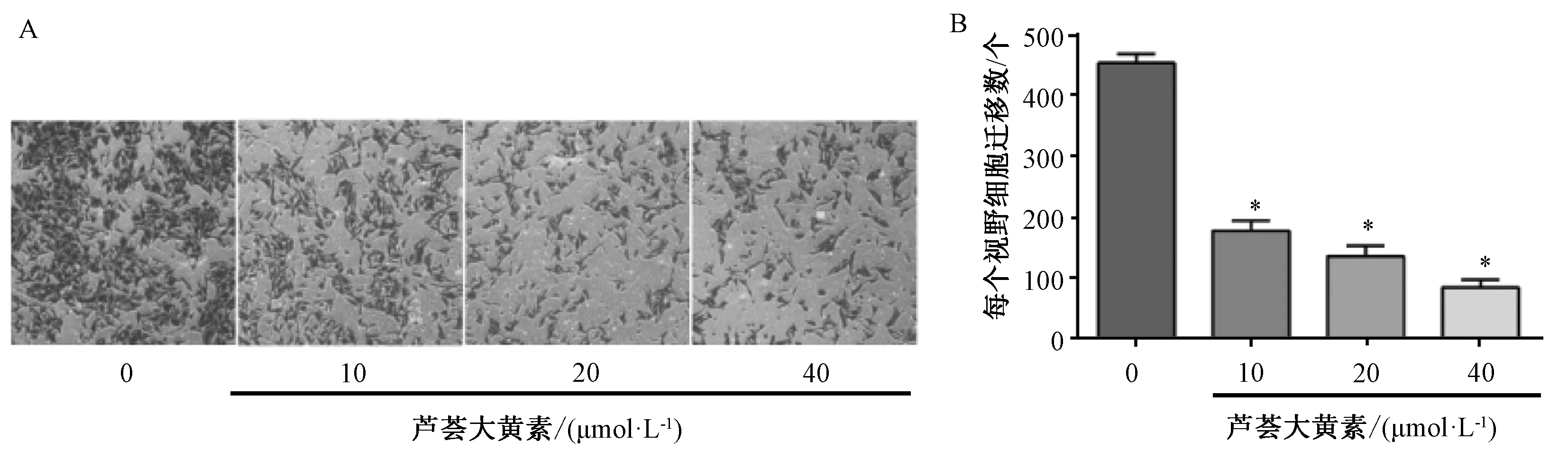
注:A为肝癌细胞迁移情况,B为肝癌细胞迁移数。与对照组比较,*P<0.05。
2.3 芦荟大黄素对肝癌细胞Src/STAT3信号通路的调控 如图3所示,芦荟大黄素能浓度依赖性地抑制SMMC-7721肝癌细胞中Src和STAT3的磷酸化水平,而相应的总蛋白表达不变,也以浓度依赖性的方式抑制Cyclin D1、c-Myc、MMP-2、MMP-9表达,表明Src/STAT3信号通路在芦荟大黄素抑制 SMMC-7721肝癌细胞增殖和迁移中发挥重要作用。
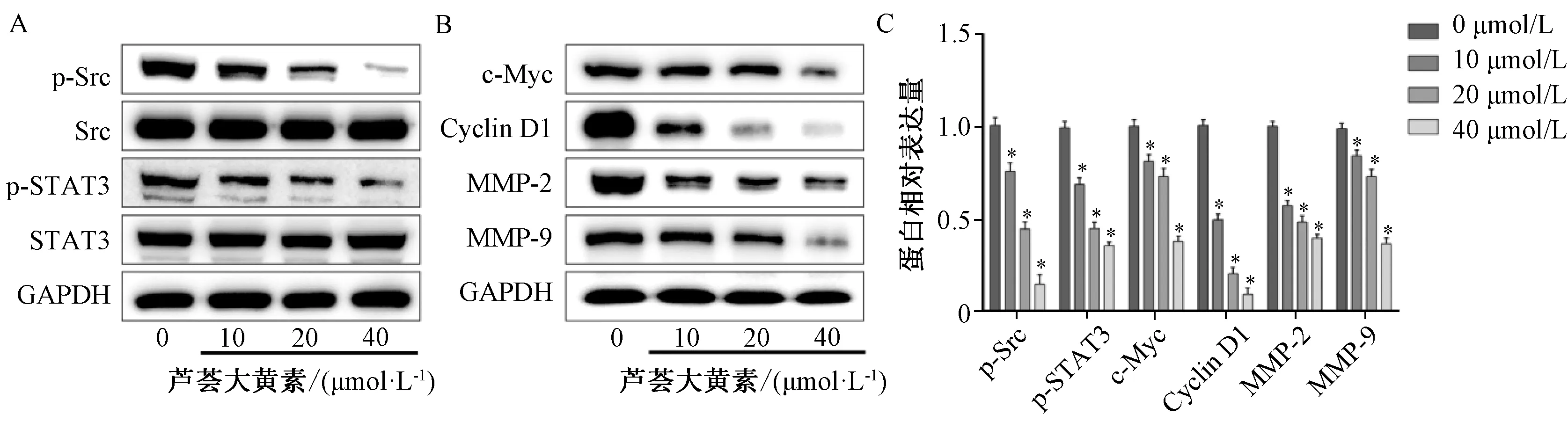
注:A为芦荟大黄素对Src/STAT3信号通路激活的影响,B为芦荟大黄素对Src/STAT3信号通路下游增殖和迁移相关靶蛋白的影响,C为蛋白相对表达量。与对照组比较,*P<0.05。
2.4 Src与芦荟大黄素的潜在结合作用 目前研究表明,芦荟大黄素抑制了Src的磷酸化水平,因此推测芦荟大黄素可能直接与Src蛋白结合,是潜在的Src蛋白抑制剂。本实验首先采用分子对接技术进行分析,Src和芦荟大黄素之间的结合能为-8.772 kcal/mol。Src-芦荟大黄素络合物三维晶体结构如图4A所示,可知芦荟大黄素和Src的ASP-406、GLU-341、GLU-312 之间形成了3个氢键。通过分子动力学模拟,进一步研究了Src-芦荟大黄素蛋白复合物的稳定性。Src-芦荟大黄素络合物在0、100 ns处的表面可视化模型如图4C所示,可知Src稳定地呈现在Src结合位点的中心,直到分子动力学模拟结束。在最初的20 ns内,Src蛋白的均方根偏差(RMSD)从0.5 Å(1 Å=1.0×10-10m)增加到3 Å,并围绕着3 Å波动(图4B,红色线),而芦荟大黄素的RMSD则稳定在0.5 Å波动(图4B,蓝色线)。此外,表面等离子共振分析表明芦荟大黄素以浓度依赖方式快速结合Src,平衡解离常数(KD)值为3.66×10-7mol/L,表明该成分对Src具有很强的亲和力,能与后者直接结合。
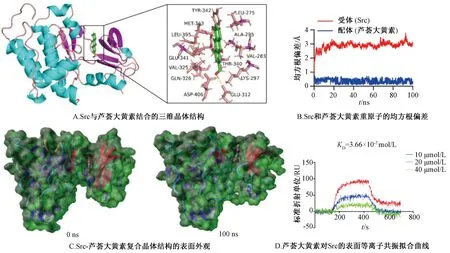
图4 Src和芦荟大黄素结构之间的相互作用
3 讨论
在过去70年中,获得FDA批准用于癌症治疗的小分子化合物中,约有一半是天然药物或天然药物的直接衍生物[6-7]。芦荟大黄素是从中药大黄中提取的天然化合物,具有抗炎、抗菌、神经保护和肝保护等多种药理作用[8]。此外,芦荟大黄素在肝癌、肺癌、胃癌及黑色素瘤细胞等不同肿瘤细胞上表现出显著的抗肿瘤活性[3]。杜雪峰等[9]发现芦荟大黄素通过促进凋亡相关蛋白Bax、caspase-3的表达诱导SMMC-7721肝癌细胞发生自噬和凋亡。王晓辉等[10]发现芦荟大黄素能够减少HepG2肝癌细胞中微丝形成,抑制细胞增殖与迁移,其机制可能与芦荟大黄素上调NF-κB表达,降低e-NOS活性有关。本研究中采用SMMC-7721和Hep3B肝癌细胞探索芦荟大黄素抗肝癌作用及其机制。MTS和平板克隆形成实验结果提示芦荟大黄素能够抑制肝癌细胞的活性。EdU染色和Transwell迁移实验提示芦荟大黄素抑制肝癌细胞的增殖和迁移能力。最后采用蛋白印迹探索芦荟大黄素抗肝癌的作用机制,发现芦荟大黄素能够抑制肝癌细胞中Src/STAT3信号通路的激活,以及抑制下游增殖和迁移相关靶蛋白的表达。
Src是非受体蛋白酪氨酸激酶,能被多种受体蛋白激活,通过级联反应调节一系列下游基因表达,以控制细胞形态、增殖、粘附、分化和迁移等细胞过程[11]。STAT3是Src级联的重要下游之一。Src激酶在恶性肿瘤中异常持续激活,随后将STAT3磷酸化,激活的STAT3转入核内与DNA结合,促进增殖、抗凋亡,迁移与侵袭等相关目标基因的转录,这些基因与多种类型肿瘤的发生与进展密切有关[12]。江雪梅[13]通过收集153肝癌患者术后标本,发现激活的Src水平与肝癌的不良预后密切相关。研究发现使用慢病毒载体抑制肿瘤细胞内Src的表达能够抑制细胞增殖、迁移与侵袭[14]。Finn等[15]使用Src激酶小分子抑制剂达沙替尼作用于多种肝癌细胞系,发现达沙替尼能够阻断细胞周期,诱导肝癌细胞凋亡。陈建新等[16]通过分子对接技术发现中药单体10-姜酚能与Src结合,从而抑制Src/STAT3信号通路的激活,抑制HepG2肝癌细胞增殖。本研究发现芦荟大黄素能抑制肝癌细胞Src与STAT3的磷酸化表达,并抑制STAT3下游增殖相关蛋白Cyclin D1、c-Myc以及迁移相关蛋白MMP-2、MMP-9的蛋白表达,芦荟大黄素抑制肝癌细胞增殖与迁移的作用可能是通过抑制Src/STAT3信号通路。
Western blot结果发现芦荟大黄素抑制磷酸化Src的激活,而不抑制总Src蛋白的表达,提示芦荟大黄素可能直接靶向Src。本研究通过分子对接和分子动力学模拟,以确定芦荟大黄素能否结合Src的蛋白激酶域。分子对接和分子动力学模拟常用于分析生物活性分子与靶蛋白或受体之间的潜在相互作用形式,并了解他们的结合模式[17-18]。芦荟大黄素与Src的对接研究表明芦荟大黄素-Src复合物的结合能为-8.772 kcal/mol,表明二者具有很强的结合能力。此外,分子动力学模拟结果表明,芦荟大黄素-Src结合构象稳定。表面等离子共振分析是一种新型的生物分析工具,用于分析蛋白质、DNA、酶和其他生物分子之间的相互作用[19]。表面等离子共振分析发现芦荟大黄素与Src之间具有很强的亲和力。以上结果提示芦荟大黄素能与Src直接结合,是一个潜在的Src抑制剂。
综上所述,芦荟大黄素通过抑制Src/STAT3信号通路抑制肝癌细胞增殖与迁移,从而发挥其抗肝癌作用,是治疗肝癌的有效药物。
