β-细辛醚联合左旋多巴对帕金森病大鼠单胺类神经递质的影响
2021-10-26黄丽平周中流宁百乐张芹欣邓敏贞
黄丽平, 周中流, 宁百乐, 张芹欣, 邓敏贞*
(1.岭南师范学院,广东 湛江 524048;2.广东省中医院,广东省中医药科学院,广州中医药大学第二临床医学院,广东 广州 510120)
帕金森病(Parkinson’s disease,PD)是常见的神经退行性疾病,临床表现为静止性震颤、肌强直、运动迟缓、姿势不稳,其主要病理特点为中脑黑质多巴胺能神经元严重缺失和纹状体多巴胺(DA)神经递质的急剧下降[1],发病前期可用左旋多巴(L-dopa)治疗,但在2~5年后疗效逐渐不明显,并且后期会出现症状波动与异动症,是相关治疗的最大难题[2]。研究表明,石菖蒲挥发油有效成分β-细辛醚具有一定的神经药理作用[3],课题组前期发现该成分联合L-dopa后可改善帕金森病大鼠行为障碍[4],还能调节血脑屏障相关蛋白表达[5],但联合用药作用机制尚不明确。因此,本实验着重探讨β-细辛醚联合L-dopa用药对帕金森病大鼠单胺类神经递质水平的影响。
1 材料与方法
1.1 试剂与药物 石菖蒲购自广州中医药大学第一附属医院中药房,经广州中医药大学第一附属医院药学部唐洪梅主任鉴定为正品。左旋多巴片(批号19130501,上海福达制药有限公司);美多巴(批号SH1609,上海罗氏制药有限公司);6-羟基多巴(6-OHDA)(批号H116)、阿扑吗啡(APO)(批号100839-20060)(美国Sigma公司)。酪氨酸羟化酶(TH)、儿茶酚氧位甲基转移酶(COMT)ELISA试剂盒(批号12/2018)(上海继锦化学科技有限公司);DDC抗体(货号ab3905)、GAPDH抗体(货号ab8245)(英国Abcam公司);羊抗兔抗体(货号CW0114)、羊抗鼠抗体(货号CW0113)(北京康为世纪生物科技有限公司);ECL试剂盒(美国Bio-Rad公司)。
1.2 仪器 Multiskan MK3 酶标仪(美国Thermo Fisher Scientific公司); AE-200型电子分析天平[梅特勒-托利多仪器(上海)有限公司];Waters-200型高效液相色谱仪(美国Waters公司);ZB-200 疲劳转棒仪(成都泰盟科技有限公司);脑立体定位仪(美国Stoelting公司);ARATHON牙科钻(韩国Saeyang公司);电泳装置和转膜装置(美国Bio-Rad公司)。
1.3 动物 无特定病原体级SD大鼠,100只,雌雄各半,体质量220~250 g,购自广州中医药大学,实验动物生产许可证号SCXK(粤)2008-0020,适应环境3 d后进行实验。
1.4 β-细辛醚制备 按照2015年版《中国药典》一部附录挥发油提取方法提取石菖蒲挥发油,得率大于1%,采用冷冻结晶法将其进行纯分,得到白色晶体,即为β-细辛醚,通过GC-MS检测证实其纯度在99%以上[6]。
1.5 造模 大鼠腹腔注射10%水合氯醛(350 mg/kg)麻醉,将其头部固定于脑立体定位仪上,定位于大鼠左脑的前脑内侧束(MFB)(AP-4.4 mm,ML-1.2 mm,DV-7.8 mm),注射6 μL 6-OHDA(4 mg/mL),注射速度为0.5 μL/min,注射完毕留针15 min,缓慢取出微量注射器,假手术组同法注射含0.02%抗坏血酸的生理盐水。造模1个月后,大鼠腹腔注射0.5 mg/kg阿扑吗啡,以向健侧旋转数大于7圈/min为造模成功。
1.6 分组 将70只造模大鼠随机分为7组,每组10只,雌雄各半,分别为模型组,美多巴组(75 mg/kg),L-dopa组(60 mg/kg),β-细辛醚组(15 mg/kg),联合低、中、高剂量组[L-dopa 60 mg/kg+ β-细辛醚(7.5、15、30 mg/kg)],灌胃给药,正常组、模型组大鼠按0.5 mL/kg剂量灌胃给予蒸馏水,每天2次,持续30 d。
1.7 指标检测
1.7.1 大鼠脑组织和血浆中单胺类神经递质水平 各组大鼠腹腔注射10%水合氯醛(350 mg/kg)麻醉后打开腹腔,分离腹主动脉,一次性注射器取动脉血,置于相应编号含肝素钠的采血管中,3 500 r/min离心20 min,取上清液(血浆)置于相应编号的离心管中,在-20 ℃下保存。打开大鼠胸腔,0.9%生理盐水灌注心脏至肺完全变白为止,开颅取脑,分离造模侧的纹状体,置于相应编号的离心管中,在-80 ℃下保存备用。
取血浆500 μL至相应编号的离心管中,按1∶1比例加入500 μL 5%高氯酸,涡旋混匀,离心(14 000 r/min,4 ℃)10 min,上清液过滤后置于相应编号的样品瓶中,在4 ℃下待测。将造模侧的纹状体按1∶5比例加入5%高氯酸,电动匀浆,离心(14 000 r/min,4 ℃)10 min,上清液过滤后置于相应编号的样品瓶中,在4 ℃下待测。分析条件为ODS2色谱柱(150 mm×4.6 mm,5 μm);流动相0.1 mol/L KH2PO4-甲醇(80∶20);体积流量1.0 mL/min;柱温30 ℃,检测L-dopa、多巴胺(DA)、高香草酸(HVA)、3,4-二羟基苯乙酸(DOPAC)、5-羟色胺(5-HT)水平。
1.7.2 ELISA检测纹状体和血浆中酪氨酸羟化酶(TH)、儿茶酚氧位甲基转移酶(COMT)活性 将大鼠纹状体按1∶5比例加入0.9%生理盐水,电动匀浆,离心(14 000 r/min,4 ℃),上清液过滤后置于相应编号的样品瓶中,在4 ℃下待测。严格按照ELISA说明书操作步骤,检测大鼠纹状体和血浆中TH、COMT水平。
1.7.3 Western blot法检测DDC表达 大鼠纹状体组织冷冻匀浆后,4 ℃、14 000 r/min离心一段时间,上清液经BCA法定量,上样量为50 μg,电泳条件为110 V、60 min,湿法转膜,条件为200 mA、60 min,DDC一抗浓度1∶1 000,二抗浓度1∶2 000,其他操作步骤同常规Western blot法,采用ECL试剂盒在化学发光检测器中检测,采用Image-pro软件分析。

2 结果
2.1 大鼠纹状体中单胺类神经递质水平 与假手术组比较,模型组L-dopa、DA、DOPAC、HVA、5-HT水平降低(P<0.05,P<0.01);与模型组比较,美多巴组、联合各剂量组L-dopa、DA、DOPAC、HVA、5-HT水平升高(P<0.05,P<0.01),L-dopa组、β-细辛醚组DA、DOPAC、HVA、5-HT水平亦然(P<0.05);与L-dopa组比较,美多巴组、联合高剂量组L-dopa、DA、DOPAC、HVA、5-HT水平升高(P<0.05,P<0.01),β-细辛醚组DA、DOPAC、HVA水平降低(P<0.05),联合低、中剂量组L-dopa水平升高(P<0.01);与美多巴组比较,β-细辛醚组L-dopa、DA、DOPAC、HVA、5-HT水平降低(P<0.05,P<0.01);联合低剂量组L-dopa、DA、DOPAC、HVA及联合中剂量组L-dopa、DOPAC、HVA水平降低(P<0.05,P<0.01),联合高剂量组L-dopa水平亦然(P<0.01),见表1。
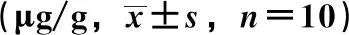
表1 各组大鼠纹状体中单胺类神经递质水平
2.2 大鼠血浆中单胺类神经递质水平 与假手术组比较,模型组L-dopa、DA、DOPAC、HVA、5-HT水平降低(P<0.05,P<0.01);与模型组比较,美多巴组、L-dopa组、β-细辛醚组、联合各剂量组L-dopa、DA、DOPAC、HVA、5-HT水平升高(P<0.05,P<0.01);与L-dopa组比较,美多巴组L-dopa、DA、DOPAC、HVA、5-HT水平升高(P<0.05,P<0.01),β-细辛醚组L-dopa、DA、DOPAC、HVA、5-HT水平降低(P<0.05,P<0.01)。联合各剂量组L-dopa、DOPAC、HVA水平降低(P<0.05,P<0.01),而DA、5-HT水平升高(P<0.05);与美多巴组比较,β-细辛醚组L-dopa、DA、DOPAC、HVA、5-HT水平降低(P<0.05,P<0.01),联合各剂量组L-dopa、DOPAC、HVA水平亦然(P<0.05,P<0.01),而DA水平升高(P<0.05),见表2。
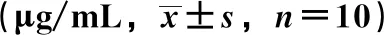
表2 各组大鼠血浆中单胺类神经递质水平
2.3 大鼠纹状体和血浆中相关酶活性
2.3.1 纹状体 与假手术组比较,模型组COMT、TH活性降低(P<0.01);与模型组比较,各给药组COMT、TH活性升高(P<0.05,P<0.01);与L-dopa组比较,美多巴组和联合中、高剂量组COMT、TH活性升高(P<0.05),β-细辛醚组TH活性亦然(P<0.01);与美多巴组比较,β-细辛醚组、联合低剂量组COMT、TH活性降低(P<0.05),见表3。
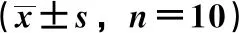
表3 各组大鼠纹状体和血浆中相关酶活性
2.3.2 血浆 与假手术组比较,模型组COMT、TH活性降低(P<0.05);与模型组比较,各给药组COMT、TH活性均升高(P<0.05,P<0.01);与L-dopa组比较,美多巴组、联合中高剂量组COMT、TH活性升高(P<0.05),而β-细辛醚组COMT活性降低(P<0.05);与美多巴组比较,β-细辛醚组、联合低剂量组TH活性降低(P<0.05),见表3。
2.4 大鼠纹状体中DDC表达 与假手术组比较,模型组DDC表达降低(P<0.05);与模型组比较,各给药组DDC表达升高(P<0.05);与美多巴组、L-dopa组比较,β-细辛醚组、联合用药各剂量组DDC表达升高(P<0.05),见图1。

注:A为假手术组,B为模型组,C为美多巴组,D为左旋多巴组,E为β-细辛醚组,F为联合低剂量组,G为联合中剂量组,H为联合高剂量组。与假手术组比较,@@P<0.01;与模型组比较,*P<0.05,**P<0.01;与L-dopa组比较,#P<0.05,##P<0.01;与美多巴组比较,&P<0.05,&&P<0.01。
3 讨论
多巴胺替代疗法可改善帕金森病症状但不能阻止这种神经退化的进程[7]。目前,DA的前体药物L-dopa是DA替代疗法的典型代表药物,是帕金森病治疗最有效的药物,可以改善PD患者的生活质量[8]。但长期单一应用L-dopa在帕金森治疗中会产生严重不良反应[9]。美多巴(L-dopa+苄丝肼)被称为“黄金标准”在帕金森病治疗,可提高脑中L-dopa水平,从而提高DA水平[10]。然而,美多巴也会产生运动障碍等副作用[11]。前期研究发现β-细辛醚容易透过血脑屏障和广泛分布在大脑[12]。它具有中枢神经药理作用[13]。它还可以减弱自噬的调节物p-JNK、Bcl-2和Beclin-1,减少6-OHDA所致的脑损伤[14]。这提示β-细辛醚可能有助于PD减轻多巴胺能神经元损伤。
美多巴依赖于L-dopa来维持纹状体DA水平从而治疗帕金森[15]。关键是苄丝肼可以抑制L-dopa在外周血脱羧和促进L-dopa部分传递到BBB的过程[16]。本研究结果表明,联合各剂量组纹状体的L-dopa水平远低于美多巴组,但联合高剂量组纹状体DA水平与美多巴组相当。L-dopa转化为DA只有通过DDC酶的脱羧作用[17]。此外,β-细辛醚组和联合各剂量组纹状体中DDC的表达高于其他治疗组。因此,推断β-细辛醚可能增强DDC的活性。TH是儿茶酚胺类神经递质如DA生物合成过程所需的限速酶,也是多巴胺能神经元的标志酶,催化酪氨酸的羟化而生成多巴,而COMT是促进DA代谢的主要相关酶之一。而纹状体中美多巴组和联合中和高剂量组TH和COMT水平相近,这一结果表明美多巴组和联合中和高剂量组对DA代谢程度影响相近。以上结果提示,联合用药可能是通过增强DDC活性来提高纹状体DA水平,其相关机制可能与美多巴治疗帕金森病的机制不同。此外,美多巴组和联合高剂量组纹状体中DOPAC和HVA含量相似,即美多巴组与联合高剂量组对多巴胺代谢影响区别不大。
在血浆中,美多巴组L-dopa最高,L-dopa的含量高于联合各剂量组,而DA水平刚好与之相反。重要的是,联合各剂量组DDC表达均高于其他治疗组,呈一定的剂量依赖性。结果表明β-细辛醚可加速L-dopa脱羧过程。此外,联合各剂量组和美多巴组COMT水平相近。联合各剂量组DOPAC和HVA水平高于模型组。联合高剂量组HVA与美多巴组相近。结果表明联合用药同时促进DA的代谢和提高COMT的活性。
除此之外,研究发现5-HT激活的障碍已经涉及帕金森病的精神障碍[18]。6-OHDA损伤的帕金森病大鼠可能诱发类似焦虑行为[19]。有研究发现帕金森病大鼠纹状体DA和5-HT没有明显的相关性[20]。结果表明联合各剂量组和美多巴组5-HT在血浆和纹状体显示无统计学意义。因此,联合用药治疗帕金森病大鼠对纹状体的5-HT影响不明显。
综上所述,β-细辛醚和L-dopa联合用药可提高纹状体DA水平,可能是通过调节DA相关酶(DDC、COMT和TH)作用从而促进L-dopa转化,大大提高L-dopa在大脑内的使用程度,避免其在外周的代谢,将大大减少L-dopa的使用剂量和副作用。因此,β-细辛醚和L-dopa联合应用可能是一种潜在治疗帕金森的有效方案。
