大黄酸抗肿瘤机制的研究进展
2021-10-26蒋兰,杨毅
蒋 兰, 杨 毅
(1.重庆三峡医药高等专科学校,重庆 404120;2.重庆市抗肿瘤天然药物工程技术研究中心,重庆 404120;3.三峡库区道地药材开发利用重庆市重点实验室,重庆 404000;4.重庆大学附属三峡医院,重庆 404000)
大黄酸(化学结构式见图1)主要分布于蓼科植物(如大黄、何首乌、芦荟等)中,药理作用十分广泛,包括抗菌、抗炎、利尿、治疗糖尿病和肾病等[1-2]。近年来,关于大黄酸抗肿瘤的报道日益增多,对肝癌、乳腺癌、肺癌、舌癌、胃癌等均有抑制作用,能通过调节促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、磷酸肌醇3激酶(phosphatidylinositide 3-kinase,PI3K)、蛋白激酶C(protein kinase C,PKC)和核转录因子(nuclear transcription factor-κB,NF-κB)等多种分子及多种信号通路[如Ras/Raf/MEK(MAPK)/ERK和PTEN/PI3K/Akt/mTOR等]来抑制细胞增殖,诱导细胞凋亡并防止转移,从而发挥抗肿瘤的作用[3-6]。本文就近年来大黄酸抗肿瘤机制进行综述,以期为该成分相关基础研究及临床用药提供参考。
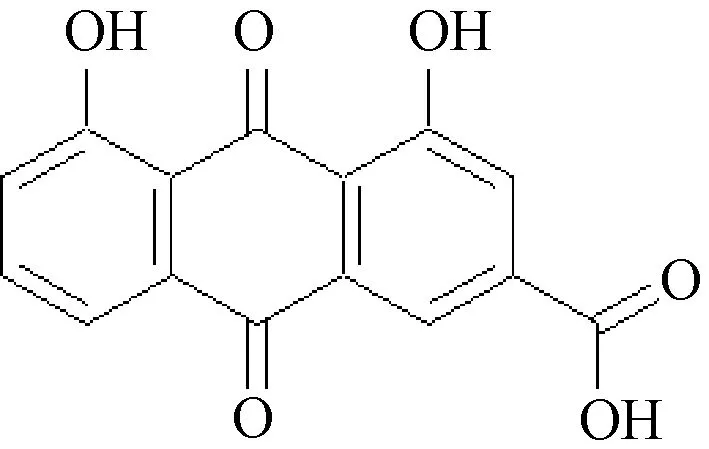
图1 大黄酸化学结构式
1 抑制肿瘤细胞增殖
恶性肿瘤细胞与正常细胞最突出的区别,就是前者不受正常生长调控系统的控制[7]。Tang等[8]研究了大黄酸对大鼠F98胶质瘤细胞的抗癌潜力,结果表明各成分能显著抑制F98胶质瘤细胞中细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK1/2)激活,停滞细胞周期。β-连环蛋白及其下游靶标的过度表达会促进癌细胞的增殖、侵袭等,而大黄酸在肝癌HepG2细胞和宫颈癌HeLa细胞中均可诱导β-连环蛋白降解,原癌基因c-Myc、周期蛋白cyclin D1表达均降低,细胞周期停滞于S期,从而抑制细胞增殖[9]。
2 促进肿瘤细胞凋亡
细胞凋亡指的是细胞自主有序死亡,以维持内环境的稳定,它会呈现出如细胞皱缩、染色质凝集、凋亡小体形成、细胞骨架解体等特征性形态学变化,如果凋亡的自然进程被阻断或抑制,就易形成肿瘤。凋亡的发生是由许多相互关联的过程控制的,主要包括死亡受体介导的外在途径和线粒体介导的内在途径,前者由细胞表面的死亡受体、肿瘤坏死因子受体家族介导;后者主要由非受体刺激激活,例如DNA损伤、代谢应激、紫外线辐射等,细胞凋亡受到B淋巴细胞瘤-2(Bcl-2)家族蛋白调控(抗凋亡作用如Bcl-2、Bcl-xL、Bcl-w等,促凋亡作用如Bax、Bak、Bad、Bim等),它们通过活化胱天蛋白酶或调节细胞色素c的释放发挥作用。大量研究证明,大黄酸是一种有效的凋亡诱导剂,尤其是作用于线粒体介导的内在途径[10-12]。
Li等[13]研究大黄酸对人胃癌SGC-7901细胞作用时,发现大黄酸可增加Bax/Bcl-2比率,降低Bcl-xL、caspase-3蛋白表达,通过线粒体途径介导细胞凋亡。Du等[14]在研究大黄酸作用肝癌HepG2细胞时,发现该成分能直接作用于线粒体,导致线粒体通透性转换,Ca2+、细胞色素c释放到胞浆中,并触发caspase 3的激活和随后的凋亡过程。Wang等[15]同样研究了大黄酸对肝癌HepG2细胞和Huh7的潜在抗癌能力,发现大黄酸处理后癌细胞活力明显受到抑制,可通过诱导活性氧(reactive oxygen species,ROS)产生和激活JNK/Jun/caspase-3信号通路而诱导细胞凋亡。信号转导和转录激活子3(Signal transducer and activator of transcription 3,STAT3)作为一种转录因子,在肿瘤的增殖、转移过程中发挥了十分重要的作用。Yang等[16]发现,大黄酸可通过抑制STAT3途径上调Bax表达、下调Bcl-2表达来诱导非小细胞肺癌(non-small cell lung cancer,NSCLC)凋亡。
除此以外,大黄酸还可通过内质网应激(endoplasmic reticulum stress,ER应激)诱导凋亡,ER应激是由内质网腔内折叠错误或未折叠的蛋白堆积造成,并诱导适应性细胞反应,称为未折叠蛋白反应(unfolded protein response,UPR),钙稳态和UPR失衡等许多因素均可诱发ER应激,最终会导致细胞凋亡。大黄酸处理乳腺癌细胞时,可促进细胞蛋白质的错误折叠以及ER应激,最终引起细胞凋亡[17]。Hsia等[18]在研究大黄酸对人肺癌A-549细胞的作用机理时发现,大黄酸可引起ER应激,其反应标志物葡萄糖调节蛋白78、ROS、Ca2 +水平升高,细胞色素c的释放增加,最终导致凋亡。
3 减少肿瘤细胞血管生成、抑制侵袭转移
肿瘤血管是肿瘤生长转移的前提,新生血管为后者提供了氧气等必备条件,故可通过抑制血管生成来抑制肿瘤的发展。研究表明,大黄酸在常氧和低氧条件下可通过调节PI3K/Akt/ERK途径抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)表达,从而抑制血管形成[19]。
恶性肿瘤的主要特点之一是侵袭转移,患者在发病初期通常症状不明显,很难查觉,等到确诊时往往发生了多处转移。基质金属蛋白酶(matrix metalloprotein,MMP)在肿瘤转移过程中发挥了重要作用,它可破坏细胞外基质和血管的基底膜等组织学屏障。Ren等[20]研究发现,大黄酸以剂量依赖方式抑制卵巢癌细胞的增殖和迁移,主要是通过下调MMP-1、MMP-2、MMP-9的表达实现抗肿瘤作用。Zhou等[21]同样发现,大黄酸能抑制卵巢癌侵袭及转移,其作用机制与抑制Rac1/ROS/MMPs信号转导通路中氨基末端激酶(c-Jun N-terminal kinase,JNK)、转录激活因子1蛋白磷酸化,下调MMP活性有关。此外,大黄酸还可通过调节NF-κB等途径来抑制MMP-9、VEGF的表达,从而抑制人鼻咽癌NPC细胞、人舌癌SCC-4细胞的侵袭和迁移[22-23]。
4 免疫调节
肿瘤细胞在其周边通常会形成一个免疫抑制的微环境,使得转移细胞免受机体免疫的攻击,这种免疫抑制微环境与其瘤内的低氧水平关系紧密,在低氧环境中多种免疫抑制分子[如环氧合酶-2(Cyclooxygenase-2,COX-2)、程序性死亡配体1(Programmed cell death ligand 1,PD-L1)及VEGF等]表达会上调,而缺氧诱发因子-1α((hypoxia inducible factor-1α,HIF-1α)作为低氧环境的关键响应分子可直接调控其表达。HIF-1α在正常细胞中无法检测到,但癌细胞经常表达以支持其生长,促进血管生成和高糖酵解(也称为瓦博格效应)[24]。胡立娟[25]发现,大黄酸能阻断PI3K/Akt、MAPK/ERK信号通路,下调HIF-1α、VEGF表达,进而改善胰腺癌细胞的瓦博格效应及诱发的恶病质。Yuan等[26-27]研究证实,大黄酸可在缺氧条件下诱导免疫调节作用,下调结直肠癌CRC细胞中HIF-1α和免疫抑制分子,淋巴细胞对人结直肠癌CRC肿瘤细胞的毒性增强,有望与效应淋巴细胞联合用于CRC治疗。
5 联合其他抗肿瘤药物,减毒增效
目前,癌症的治疗效果欠佳,部分原因是由于肿瘤细胞会产生耐药性。研究发现,大黄酸与化疗药物联合使用时可逆转耐药性,增加放化疗功效。
阿霉素(Doxorubicin,DOX)抗瘤谱较广,是一种周期非特异性药物,对多种肿瘤细胞都有抑制作用,但是由于本身的严重不良反应和耐药性,其临床效果有限。Wu等[28-29]发现,大黄酸和DOX在肝癌细胞中具有协同抗肿瘤作用,通过与线粒体上的电压依赖性离子通道、腺嘌呤核苷酸转位酶等的结合,诱导线粒体通透性转换孔开放,抑制肝癌SMMC-7721细胞的线粒体能量代谢,降低细胞ATP和ADP水平,从而逆转肝癌细胞对阿霉素的耐药性。纳米颗粒作为化疗药物的载体系统,因其对肿瘤的特异性、较少的不良反应而受到越来越多的关注。Han等[30]制备了DOX和大黄酸(RHE)共载聚合物胶束(纳米DOX/RHE),表现出较好的肿瘤靶向性,纳米颗粒使得药物释的速率变慢,导致血浆药物浓度升高,并且大黄酸在降低卵巢癌细胞耐药性的同时,可提高DOX的治疗作用。
PD-L1与程序性细胞死亡受体1(programmed cell death protein 1,PD-1)结合时,会产生抑制性信号,同时CD8+T淋巴细胞激活信号被抑制,导致肿瘤免疫逃逸。阿特珠单抗作为一种PD-L1抑制剂可阻断PD-1/PD-L1信号通路,从而重新激活T细胞,击杀癌细胞。Shen等[31]探讨了大黄酸和阿特珠单抗联合使用对乳腺癌的影响,发现在联合疗法下脾脏和肿瘤中CD8+T细胞比例、血清中肿瘤坏死因子和白细胞介素6、各种凋亡因子水平均明显高于其他治疗组,乳腺肿瘤生长得到有效抑制,提示大黄酸可增强阿特珠单抗治疗乳腺癌作用。
Bu等[32]将大黄酸与培美曲塞(Pemetrexed,PTX)联合治疗肺癌A549细胞,发现前者通过调节PI3K/Akt/mTOR途径和癌细胞中的Bcl-2蛋白家族、影响自噬和凋亡来增强后者抗肿瘤活性。
表皮生长因子受体(Epidermal growth factor receptor,EGFR)信号通路在多种癌细胞的增殖、血管生成、转移等方面发挥作用,其靶向治疗在临床上已得到广泛应用,但随着该类药物的广泛使用,耐药问题也随之而来。在多种耐药细胞中发现,STAT3的反馈性激活是EGFR抑制剂产生耐药的原因之一[33],而大黄酸可抑制其磷酸化,诱导胰腺癌PC细胞凋亡,与EGFR抑制剂厄洛替尼联用时有助于克服胰腺癌细胞对后者的耐药性,协同促进细胞凋亡,抑制细胞增殖,从而增强抗肿瘤效果[34]。Zhuang等[35]同样发现,大黄酸与EGFR抑制剂联用可促进人结直肠癌CRC细胞的凋亡,协同发挥抗肿瘤作用,并能将CRC阻滞G2/M期,抑制细胞周期相关蛋白的表达。
6 大黄酸衍生物研究
对天然产物进行结构改造是现代药物研发的一个主要途径,大黄酸虽然具有良好的抗肿瘤功效,但其特有的三环骨架结构导致水溶性较差,生物利用率不高,在很大程度上限制了临床应用。大黄酸和其他蒽醌类化合物的主要区别就在于前者具有1个游离的羧基,许多学者着手对该基团进行结构改造,以期提高其生物活性[36-38]。
林雅军[39]将大黄酸与赖氨酸反应合成,得到了赖氨酰大黄酸(Rhein lysinate,RHL),它在水中的溶解度大大增加,并且在抑制肿瘤细胞增殖方面与先导化合物相似。Zhen等[40]将赖氨酰大黄酸和紫杉醇联合用于H460、A549非小细胞肺癌的治疗,发现联合治疗后NSCLC细胞系增殖明显减少,Bcl-2、NF-κB蛋白下调,增强了紫杉醇在NSCLC细胞中的抑制生长作用。纪春梅等又研究了赖氨酰大黄酸与顺铂联用对人肺癌A549细胞的影响,发现两药合用后Bax上调,Bcl-2表达下调,可增强顺铂抗肿瘤作用,诱导肿瘤细胞凋亡。另外,赖氨酰大黄酸对宫颈癌HeLa细胞、人胶质瘤U87裸鼠移植瘤生长也具有良好的抑制作用[41-44]。
张汪伟等[45]将大黄酸通过不同连接基团与生物素、叶酸偶联,得到了10个化合物,抗肿瘤实验表明部分化合物的活性强于阳性对照氟尿嘧啶。黄骏凯等[46]将大黄酸与硝酸酯类供体相连,得到5个大黄酸硝酸酯类化合物,均显示出一定的抗肿瘤活性,而且显著高于先导化合物大黄酸。郝长波等[47]将大黄素进行乙酰化、氧化等一系列反应,合成了11个结构新颖的6-烷氧基-大黄酸-氨基酸化合物(2-7aa~2-7ee),并考察它们对4株癌细胞的体外抑制活性,发现2-7ea 对四者均有一定抑制活性。
7 展望
大黄酸作为一种广泛存在于中草药中的蒽醌类化合物,具有多种药理活性,近年来发现该成分可通过调控多种分子、信号途径来发挥抗肿瘤的作用。目前,对癌症的治疗效果欠佳原因之一就是肿瘤细胞会产生耐药性,而大黄酸与化疗药物联合使用时可逆转该特性,增强疗效,但该成分具有三环骨架结构,导致其水溶性较差,在很大程度上限制了临床应用。近年来,随着化学合成技术的发展,通过结构修饰来提高生物活性已成为目前热点,相信随着未来研究的开展,大黄酸及其衍生物有望成为新一代临床抗肿瘤新药。
