三七总皂苷对血管生成影响的研究进展
2021-10-26鲍嘉敏宋永嘉张立创梁倩倩王拥军
鲍嘉敏, 宋永嘉, 张立创, 梁倩倩, 王拥军*
(1.上海中医药大学附属龙华医院脊柱病研究所,教育部筋骨理论与治法重点实验室,石筱山伤科学术研究中心,施杞名中医工作室,上海 200032;2.上海中医药大学康复医学院,上海 201203;3.上海中医药大学附属光华医院,上海 200052)
三七总皂苷(PanaxNotoginsengSaponins, PNS)是从中药三七中分离提取出的混合物,包含多种单体皂苷。三七总皂苷含有三七皂苷R1和人参皂苷Rg1、Rb1、Re等11种单体皂苷[1]。目前三七总皂苷和其单体皂苷在心脑血管系统疾病、伤口愈合和肿瘤等疾病中得到广泛应用[2]。血管生成是人体重要的组织脏器生长和修复过程,在生理状态中,如生长发育、伤口愈合,或病理状况下的缺血性疾病、癌症中承担着重要角色[3]。血管生成的失衡是众多疾病的病因之一,因而可开辟一条通过促进或抑制血管生成干预疾病的新途径[4]。近年来的多项研究表明,三七总皂苷既能够促进血管生成,又具有抑制血管生成的作用。因此,本文从三七总皂苷及其单体皂苷在不同状态下对血管生成的双向调节角度出发,试论述三七总皂苷的药理作用,为三七总皂苷通过调节血管生成治疗疾病的作用机制提供参考。
1 促进血管生成对疾病的治疗作用
血管生成不足是缺血性心脏病和慢性伤口等疾病的主要病理原因之一,而治疗性的血管生成旨在通过促进新血管生成对疾病进行干预[5]。三七的活性成分三七总皂苷可有效治疗血管生成不足的相关疾病。它们或许是通过促进血管生成发挥治疗疾病的作用。
血管内皮生长因子(VEGF)是血管生成过程中最重要的细胞因子,具有刺激细胞增殖、迁移和血管生成的功能[6],而该因子正是血管生成过程中的重要指标[7],刺激VEGF及其受体的大量表达,能够促进血管生成。除此之外,PI3K/Akt通路的激活也可刺激内皮细胞的增殖和迁移,一氧化氮与其内皮型一氧化氮合酶(eNOS)同样也是血管生成过程中的基本因素[8]。Hong等[9]研究表明,三七总皂苷以剂量依赖的方式诱导人脐静脉内皮细胞(HUVEC)的增殖、迁移和成管功能,在100 μg/mL质量浓度下作用达到最大。但在加入VEGF受体(VEGFR2)抑制剂、磷脂酰肌醇3-激酶(PI3K)抑制剂或eNOS抑制剂(L-NAME)后,这些促进效果就会被逆转。在斑马鱼的卵黄囊中,注射三七总皂苷或VEGF后,出现相似的肠下血管生成现象。因此得出,三七总皂苷可通过VEGF/VEGFR2和PI3K/Akt/eNOS途径促进血管生成。此外,三七皂苷R1[10]、人参皂苷Rg1[11-13]和Re[14]相关的体外或体内研究也具有相同结果。
除VEGF外,还有许多生长因子也参与血管生成,如纤维细胞生长因子、肝细胞生长因子,它们或直接诱导新血管的生成,或通过上调VEGF的表达,再促进血管生成。在体外实验中多次证明三七总皂苷能调节这些因子,如Rg1被证明,能够调节HUVEC肝细胞生长因子受体蛋白的表达[15];Rg1与Re通过调节碱性成纤维细胞生长因子的产生来影响HUVEC的血管生成作用[16-17]。
以下列疾病为例,探究在血管生成增强相关疾病的微系统中,三七总皂苷是否能通过促进血管生成发挥治疗疾病的作用及其具体机制。
1.1 心肌梗死 心肌梗死的主要治疗原则是尽早恢复心肌的血液灌注、增加局部心肌血流量并减轻局部梗死部位的炎症反应和心肌细胞凋亡[18]。目前常用于恢复梗死部位心肌血运的治疗方法有直接冠状动脉介入治疗、溶栓治疗以及心肌血液供应的再平衡治疗,如扩张侧枝血管、增加缺血区血流量等[19],旨在疏通狭窄甚至闭塞的血管,以改善梗死部位的血液灌注。因此,促进血管生成将会是极具潜力的候选治疗方案。
在心肌梗死相关大鼠模型中,心肌梗死周围的血管密度与VEGF表达呈现正相关,模型组VEGF表达呈现先增高后降低的趋势[20-22],而TNF-α和Ⅰ型胶原以及p-p38表达异常增高[22]。阿得力·艾山[20]、樊清波等[21]研究显示,加入三七总皂苷的干预后能持续上调心肌梗死病变部位的VEGF表达,促进梗死部位周围的血管生成,增加梗死区血管密度,改善梗死部分的心肌功能,减少梗死面积。人参皂苷Rg1干预,可降低心肌梗死病理微环境周围TNF-α和Ⅰ型胶原表达水平,增加VEGF表达,激活PI3K/Akt和抑制p38 MAPK信号通路,这些因子的变化促进了大鼠梗死区域的新毛细血管生成,使心肌侧支血流增加,从而增强心肌灌注,同时减轻心肌的纤维化,尽可能的保留心脏梗死部位的生理结构和功能[22-23]。
骨髓间充质干细胞不仅能分化成为血管内皮细胞和平滑肌细胞,还可以产生血管生成相关的细胞因子如VEGF、转化生长因子β及基质细胞衍生因子-1,通过调节这些细胞因子和其受体的表达,发挥促进血管生成的作用[24]。将骨髓间充质干细胞移入到心肌梗死小鼠心脏部位,可改善其心功能[25]。在Zheng等[26]的研究中显示,三七总皂苷在体外可以通过VEGF及其受体途径诱导骨髓间充质干细胞内皮化;在体内三七总皂苷和骨髓间充质干细胞同时干预能够促进更多的血管生成。在这些研究的基础上,金丹丹等[27]采用三七总皂苷联合骨髓间充质干细胞移植治疗干预心肌梗死大鼠模型,结果表明三七总皂苷能够增加骨髓间充质干细胞的存活率,促进骨髓间充质干细胞分泌VEGF,增加梗死周围新生血管的数量和扩张血管,进而促进心脏组织的修复,改善心功能。
三七总皂苷与其单体皂苷通过调节病理状态下异常升高TNF-α和Ⅰ型胶原等炎症或致损性因子趋于正常值,促进VEGF及其相关受体的表达增多,激活PI3K/Akt通路,并抑制p38 MAPK信号通路,维系内皮细胞正常的功能,促进血管生成,增加病理部位的血流,进而发挥治疗心肌梗死的作用。
1.2 股骨头坏死 除心血管疾病外,血管生成还与许多疾病有密切联系,如股骨头坏死。虽然股骨头坏死的具体发病机制目前仍不清楚,但最终导致坏死的原因是股骨头周围血液供应损伤甚至中断。激素性股骨头缺血性坏死兔模型中病理微环境周围的VEGF表达下降,TNF-α、IL-1β和IL-6等炎性因子升高。具有抑制炎性因子和促进血管生成作用的三七总皂苷或能治疗股骨头坏死。韩杰[28]、黄进等[29]对激素性股骨头缺血性坏死模型使用三七总皂苷治疗后,激素性股骨头缺血性坏死的病理状态得以改善,且股骨头中的VEGF和骨形态形成蛋白-2表达有所增加。在Ye等[30]研究中,人参皂苷Rb1能够通过减少股骨头中氧化应激水平,降低p65、TNF-α、IL-1β和IL-6等炎性因子的表达,使微环境恢复正常的状态,从而上调VEGF及其受体蛋白表达,以激活VEGF/VEGFR2通路,保护受损血管,间接地促进血管新生,对激素性股骨头缺血性坏死发挥积极的保护治疗作用。
1.3 伤口愈合 血管的生成增加,可以加快伤口愈合。伤口愈合常分为3个阶段,炎症、组织形成和组织重塑。炎症涉及细胞迁移、相关细胞因子的产生;组织形成和组织重塑是再上皮化的过程,与细胞生长因子表达、血管生成相关[31]。研究发现,三七总皂苷可增加大鼠拔牙创周围细胞VEGF的表达,诱导其增殖、分化,促进拔牙创周围生成形态功能成熟的新血管,从而加快大鼠拔牙创的愈合[32]。三七总皂苷能够下调病理环境中异常增高IL-1β,在Hou[33]、Kimura等[34]实验中也得到验证,人参皂苷Rb1可下调烧伤创面IL-1β的表达,通过p38 MAPK信号通路调节衰老相关分泌表型,进而促进血管生成和伤口愈合。在伤口组织的修复过程中,Rb1发挥着抑制炎性因子异常表达,调控相关信号通路,促进VEGF等因子的释放,起到促血管生成,加速皮肤伤口愈合。
在血管生成减弱相关疾病的微系统中,三七总皂苷和其单体皂苷能够抑制氧化应激和TNF-α、IL-1β等炎性因子的表达,促进VEGF、VEGFR2表达,激活VEGF/VEGFR2和PI3K/Akt相关信号通路,发挥着减轻细胞凋亡和保护受损血管的作用。三七总皂苷维持病理环境周围细胞因子表达水平的趋于正常,间接地促进疾病微系统周围形态功能成熟的血管新生。
2 抑制血管生成对疾病的治疗作用
三七总皂苷及其单体皂苷已多次被证明具有抗血管生成的作用。以人参皂苷Rb1的抗血管生成作用为例,Rb1的干预能诱导HUVEC释放色素上皮衍生因子(PEDF),从而起到抑制血管生成的作用[35-36]。为明确三七总皂苷在血管生成增强相关疾病的微系统中,是否能够清除异常增多的生长因子,缓解血管的过度新生,从而抑制血管生成相关疾病的发展。下面从三七总皂苷抑制血管生成角度出发,探讨其对动脉粥样硬化、视网膜相关病、肿瘤生长及其转移等在血管异常增生中疾病起到治疗作用的具体机制。
2.1 动脉粥样硬化 越来越多的研究证实,三七总皂苷主要通过抑制生长因子过度表达、调节脂质代谢、改善凝血系统、保护血管内皮细胞及维持粥样斑块稳定等途径,减轻动脉粥样硬化[37]。在动脉粥样硬化中,斑块易形成新毛细血管网络,但新生血管大多发育不成熟,存在功能结构的异常,常会导致红细胞泄漏、加速炎症因子进入病变部位,进而引发更频繁的斑块内出血[5, 38-39]。故血管生成是导致动脉粥样硬化和病变进一步发展的关键因素,而抑制斑块周围的血管生成则成为动脉粥样硬化潜在的治疗方法。
载脂蛋白E基因敲除(ApoE-KO)小鼠主动脉中的VEGF与NADPH氧化酶(NOX4)表达较正常组异常升高50倍左右,而VEGF会显着增加斑块进展,NOX4在促进着细胞迁移和增殖中起着重要的作用[40]。Qiao[40]和任超[41]通过三七总皂苷灌胃干预ApoE-KO小鼠的研究,从体内角度证明三七总皂苷的干预可减少动脉粥样硬化模型小鼠中VEGF及NOX4的表达,改善左心室流出道内皮细胞凋亡和病理损伤,减少斑块周围血管生成,从而缩小斑块的面积、增加斑块的稳定性。
血管内皮是血管稳态的关键因素,血管内皮的功能障碍和损伤是动脉粥样硬化发生和进展的第一步[42],但内皮细胞却又极易受到氧化应激、细胞炎症因子和粘附分子的影响。在动脉粥样硬化的初期阶段,三七总皂苷与其单体皂苷能够保护病理状态下的内皮细胞,防止其形态和功能受到损伤。如人参皂苷Rb1通过激活PI3K/Akt通路和抑制PKC途径来防止高半胱氨酸诱导的HUVEC损伤[43];通过调节VEGFR2、基质细胞衍生因子-1以维持高半胱氨酸诱导下内皮祖细胞的功能[44];减轻TNF-α诱导下HUVEC的氧化应激、炎症与改善细胞凋亡[45-46]。又因斑块血管生成是非常复杂的过程,有多种因素参与该过程,例如内皮损伤、炎症等。因此随着病理状态的逐步加重,初期的病理状态没有得到良好的控制,引发相关细胞的形态变化、功能受损,与此同时,这些病变细胞会在损伤部位释放炎症相关因子进一步恶化病理微环境,加快生长因子的异常释放,导致损伤部位无功能的异常新血管生成,加快破坏内环境的稳态。在这时期,大量增多促血管生成的因子会激活三七总皂苷及其单体皂苷对其调节作用,促进内环境趋于正常的稳定状态,进而抑制新血管生成的作用来干预动脉粥样硬化的进展。如Zhou等[45]研究结果所示,Rb1的干预能够保护TNF-a所诱导的HUVEC正常化,进而促进着所释放的VEGF表达量趋向于正常细胞水平,间接发挥着抑制血管的形成。
2.2 视网膜病变 新血管的异常增生是早产儿视网膜病变(ROP)、糖尿病视网膜病变(DR)和年龄相关性黄斑变性(AMD)等视网膜病变的共同病理特征。视网膜血管内皮细胞会迁移至受损的血管基底膜周围并进行增殖,通过分泌释放过多的VEGF信号,促进不成熟的新血管形成。然而这些新生血管因功能的缺失,会使血液和液体渗漏到视网膜中,导致瘢痕形成,破坏中央视力[47-48]。因此,具有抑制血管生成作用的三七总皂苷,可成为视网膜病变的干预手段。
相关体内研究表明,三七总皂苷可调节纤维细胞生长因子2(FGF2)表达,减少氧诱导的新生小鼠视网膜病变(OIR)模型中过度表达的FGF2外,还能够显著下调模型中过度增高的VEGF、PI3K与Akt,抑制小鼠视网膜血管生成[49-50]。姚青等[51]研究结果显示,三七总皂苷同样能通过调节病理微环境的异常表达因子水平,来缓解糖尿病大鼠视网膜病变的发生和发展。Zhou等[52]用三七皂苷R1干预二型糖尿病db/db小鼠,在28周龄之前的小鼠与对照组间视网膜没有明显的血管数目增加;在38周龄之后小鼠新生血管数目显著增加,此时R1的干预可以上调db/db小鼠异常下降的PEDF表达,以加速视网膜中的VEGF水平降低,使之趋向于对照组的表达水平,进一步抑制视网膜血管的生成,减少微血管渗漏和微血管瘤的形成。
Betts等[53]从成人视网膜色素上皮细胞角度进行报道,证明Rb1的干预能够促进其增殖。R1的预处理能维持高葡萄糖诱导下大鼠视网膜Muller细胞的活性,增加病理条件下Muller细胞表达的PEDF水平,阻碍Muller细胞其他相关细胞因子的异常分泌,减少细胞凋亡,维持细胞微环境的稳定状态,继而能够调控高糖诱导下Muller细胞的VEGF异常地释放,以此,阻止血管内皮细胞的促血管生成,避免造成更严重视网膜病变[52]。这些研究从体外细胞学,证明了三七总皂苷中的单体皂苷能够间接地抑制视网膜新血管的生成,为三七总皂苷治疗血管生成性眼部疾病提供了相关科学依据。
2.3 肿瘤 众所周知,血管能为肿瘤生长提供营养,为肿瘤转移、侵袭提供路径。在各种类型的肿瘤中,都有着血管异常增生,过多血管的生成已成为肿瘤致死的主要因素之一[54]。因此,阻断血管生成是肿瘤治疗和预防的重要方法。三七总皂苷调节血管生成的作用,或能成为下一个治疗肿瘤的药物。人参皂苷Rd在实验中被证明,可以降低Ki67(细胞增殖的标志)、CD31表达,抑制肿瘤新血管生成,降低乳腺癌小鼠肿瘤的体积和质量[55]。体外实验中,Rd被证明能够维持HUVEC的正常形态,抑制在VEGF刺激环境下细胞的增殖、迁移和成管功能,进一步下调HUVEC自身释放的VEGF水平,抑制PI3K/Akt信号通路,最终阻碍因异常VEGF所刺激的病理性血管生成[55]。虽然目前已有靶向抑制肿瘤血管生成的药物,如贝伐单抗、舒尼替尼和安罗替尼,但这些药物同样会抑制其他部位的血管生成,从而导致高血压、心肌衰竭和血栓等心血管疾病的发生或加重。此时,可利用三七总皂苷的双向调节作用,以解决单纯靶向血管生成的西药所存在的问题。例如,崔金刚等[56]建立心肌缺血复合恶性肿瘤的小鼠模型研究证明,用人参皂苷Rg1和Rb1进行干预,证明Rg1和Rb1能够促进病理环境中的相关细胞因子正常化,从而发挥减少肿瘤组织中的血管生成,抑制移植瘤的生长,同时还可增加心肌组织的血管数目,改善心肌缺血的损伤。
三七总皂苷通过调节异常变化的细胞因子,间接抑制血管新生。在血管生成增强相关疾病的微系统中,有FGF2等促生长因子过度增多的表现,三七总皂苷和其单体皂苷调节它们表达水平趋于正常,同时还可促进如PEDF等能抑制病理性血管生成的相关因子释放,帮助调节着病理微环境中异常的细胞因子。随着病理坏境的正常化,又加速VEGF水平的下调,同时还可抑制PI3K/Akt通路,最终发挥抑制病理性血管生成的作用。
3 结语
中药的双向调节指同一味药在机体亢进或低下的两种状态下,均能够调节机体从病理状态趋于正常的作用,三七是具有这一特征的代表性中药[57]。本文从三七主要活性成分三七总皂苷对血管生成促进或抑制的作用分别进行综述,试探究它的双向调节作用机制,为日后相关的基础及临床研究提供一定依据和思路。
三七总皂苷和其单体皂苷对血管生成调节作用存在令人困惑的“矛盾”,我们综合探讨了相关研究,分析各单体皂苷的调节作用,以明确是否会因不同组分之间具有相反的调节功能所发挥着双向作用。三七总皂苷中的单体皂苷Rg1、Re在相关研究中大都显示具有促进血管生成[11-14],但是也有少数研究结果表明它们能够抑制血管生成[56];R1、Rb1虽然具有抑制血管生成的作用[35-36, 52],但在伤口愈合、血管缺失模型等研究中也被证明具有促进血管生成的作用[10, 30, 33-34]。如此看来,三七总皂苷的双向调节作用并非是因各单体皂苷的功能不同导致,而是各单体皂苷或均具有双向调节的作用。
为了明确剂量与双向调节之间的联系,将不同的三七总皂苷剂量与其调节作用进行了分析,但因各实验所涉及的细胞、实验动物以及模型大都不同,难以得出定论。并且各项研究采用的剂量范围极其广泛,如Rb1在伤口处注射1 fg/wound能够促进伤口处的血管生成[34];在125 nmol/L浓度下对HUVEC没有促进其迁移和侵袭[58];在250 nmol/L浓度能诱导HUVEC释放PEDF,抑制血管生成[35]。根据现有研究结果,不能明确三七总皂苷或其单一皂苷不同剂量下的调节作用。此外,Sengupta等[58]研究表示,过量的Rb1会抑制Rg1所诱导的新血管生成,因此三七总皂苷中各单体皂苷的用量多少、使用比例也能成为日后研究的设计方向。
在不同的病理状态下发挥着不同的调节作用,三七总皂苷表现拥有双向调节功能的现象。如R1在正常状态下无法促进血管生成,在血管缺失的病理状态能够发挥促进作用,而在血管异常增生的时候又能够抑制新血管的生成[10, 52]。三七总皂苷在抑制血管生成的研究中表现出先保护病理状态下的细胞的正常生理形态和活性,调节病理部位的异常炎症反应,而后抑制病理性的新血管生成,防止无功能的代偿性变化进一步加重疾病[45, 52-53]。由此看来,机体所处的不同病理状态是导致三七总皂苷具有双向调节作用的本质原因。在不同病理状态下异常表达的细胞因子会直接或间接刺激着血管的形态和生长,如炎症因子的异常增多会破坏内皮细胞状态,使得血管受损和生成受限,从而导致血管生成减弱的微系统。而在血管生成增强相关疾病的微系统中,促生长因子的过表达刺激着细胞的过度增殖,引发血管异常生长,形成无生理的功能的新生血管。通过比较血管生成减弱与增强相关疾病的微系统中不同细胞因子的变化,得出三七总皂苷及其单体皂苷可促进不同病理状态下异常表达的细胞因子表达趋于正常水平,从而进一步调节VEGF、VEGFR2等直接影响血管生成的相关因子,甚至可激活PI3K/Akt等与血管生成有密切关联的通路,最终影响血管的新生,即三七总皂苷通过正常化病理状态下微环境的细胞因子表达,间接地调节血管生成。
如前所述,许多细胞因子在血管生成的过程中发挥着重要作用,在机体处于不同的病理状态时,异常的炎性因子、致损性分子或促生长因子会激化血管内皮细胞和VEGF/VEGFR2和PI3K/Akt等相关途径向病理状态发展。但三七总皂苷能够调节这些异常因子的表达,以维持细胞的形态和活性、减少细胞凋亡,抑制相关通路途径的病理状态等加重。在不同病理微环境中发挥着对血管生成不同的控制作用,见图1。这看似相反的双向调节作用本质,或是将不同病理微环境调节至稳态的作用,三七总皂苷通过调节异常细胞因子水平的正常化,从而促进血管生成相关的细胞因子及相关通路的正常化。
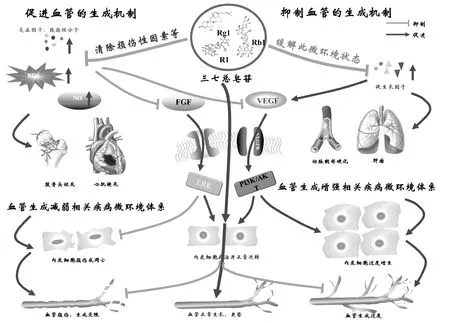
图1 三七总皂苷双向调节机制图
本文通过三七总皂苷对血管生成的作用,为药物双向调节作用提供了思考路线。但由于三七总皂苷中单体皂苷的多样性,及各单体皂苷成分之间的比例、各单一成分的具体作用机制研究尚不透彻,同时从现有研究中未能明确三七总皂苷及其各皂苷剂量与其调节作用之间的关联。因此想要更深入地探究三七总皂苷双向调节血管生成更具体的机制,有待进一步研究。
