白楸化学成分及其体外抗HBV活性
2021-10-26马健雄
曾 瑜, 王 凯, 马健雄, 陈 路*
(1.柳州市工人医院,广西 柳州 545005;2.广西壮族自治区药用植物园,广西 南宁 530023;3.广西金海堂药业有限责任公司,广西 南宁 530313)
白楸Mallotuspaniculatus(Lam.) Muell. Arg. 为大戟科野桐属植物,又名白匏子、白背桐等,主要分布于广西、海南、广东等地[1],具有活血柔肝、利湿止痛等功效,用于治疗慢性肝炎等疾病,但关于其化学成分的国内外研究报道甚少。该药材在民间应用广泛,而有效成分尚未明了,所以研究其化学成分,阐明其有效部位,对其用药安全和质量标准的完善具有十分重要的意义。在前期研究的基础上[2-3],为进一步明确白楸有效成分,本实验对该药材乙酸乙酯萃取部位进行研究,共分离鉴定出15个化合物,均为首次分离得到。此外,将分离量较大的9个化合物进行体外抗HBV活性测试,发现3个具有一定作用。
1 材料
RE-52B 型旋转蒸发仪(上海亚荣生化仪器厂);LGJ-10FD型冷冻干燥机(山东淄博森源电气有限公司);RDY-2B 型显微熔点测定仪(北京世纪科信科学仪器有限公司);Inova 500 MHz核磁共振仪(美国Thermo公司);VG Zabspec 高分辨磁质谱仪(英国Micromass公司);AE523型电子分析天平(上海舜宇恒平科学仪器有限公司);HBS-1096C型酶标仪(南京德铁实验设备有限公司);QP-80型二氧化碳孵箱(山东济南欧莱博科学仪器有限公司)。
Sephadex LH-20凝胶(上海宏真生物科技有限公司);H60硅胶(青岛海洋化工厂);HBeAg ELISA试剂盒(北京科卫临床诊断试剂有限公司, 批号201701005);HBsAg ELISA试剂盒(北京科卫临床诊断试剂有限公司, 批号201801001);DMEM 培养基(北京华迈科生物技术有限公司);拉米夫定(美国葛兰素史克公司,批号 K026520,纯度>99%);噻唑蓝(MTT,武汉卡诺斯科技有限公司);胎牛血清(上海齐一生物科技有限公司)。HepG2.2.15 细胞株(美国Mount Sinai医学中心构建,由军事医学科学院引进)。所用试剂均为分析纯。
白楸Mallotuspaniculatus(Lam.) Muell. Arg.采自南宁市郊外,由广西壮族自治区药用植物园蓝鸣生教授鉴定为正品。
2 提取与分离
取阴干后的药材(根部)适量,粉碎成粗粉,取10.5 kg至提取罐中,加入70%乙醇适量,水浴加热回流提取3次(1.5 h/次),将3次提取液进行合并,减压浓缩得浸膏967.6 g。将上述浸膏置萃取罐中,加适量水混悬,依次用石油醚、乙酸乙酯、正丁醇萃取,各部位分别萃取3次,合并萃取液,浓缩干燥后得石油醚部位83.7 g、乙酸乙酯部位103.6 g、正丁醇部位168.2 g。取乙酸乙酯部位90 g,用2倍量硅胶拌样,上硅胶柱,氯仿-甲醇(100∶0~0∶1)梯度洗脱,洗脱液用薄层色谱跟踪检测,合并相似流分,减压浓缩后共得8个组分,记为Fr.1~ Fr.8。
取Fr.3(19.6 g)经硅胶柱氯仿-甲醇(20∶1、10∶1、5∶1)梯度洗脱,薄层检测合并减压浓缩得Fr.3-1~ Fr.3-6。Fr.3-2(2.4 g)经硅胶柱氯仿-甲醇(20∶1、15∶1)梯度洗脱,合并洗脱液,减压浓缩得Fr.3-2.1~Fr.3-2.5。取Fr.3-2.2(0.4 g),经硅胶柱氯仿-甲醇(18∶1)洗脱,Sephadex LH-20柱纯化得化合物1(8.5 mg);取Fr.3-2.3(0.8 g),经硅胶柱氯仿-甲醇(16∶1)洗脱,Sephadex LH-20柱纯化得化合物2(11.8 mg);取Fr.3-2.5(0.2 g),经硅胶柱氯仿-甲醇(15∶1)洗脱,Sephadex LH-20柱纯化得化合物3(1.3 mg)。取Fr.3-5(2.8 g)经硅胶柱氯仿-甲醇(10∶1、5∶1)梯度洗脱,合并洗脱液,减压浓缩得Fr.3-5.1~Fr.3-5.6。取Fr.3-5.2(0.3 g),经硅胶柱氯仿-甲醇(10∶1)洗脱,Sephadex LH-20柱纯化得化合物4(6.2 mg);取Fr.3-5.4(0.5 g),经硅胶柱氯仿-甲醇(8∶1)洗脱,Sephadex LH-20柱纯化得化合物5(13.6 mg);取Fr.3-5.5(0.4 g),经硅胶柱氯仿-甲醇(6∶1)洗脱,Sephadex LH-20柱纯化得化合物6(17.4 mg)。
取Fr.5(21.7 g)经硅胶柱氯仿-甲醇(10∶1、5∶1、3∶1)梯度洗脱,薄层检测合并减压浓缩得Fr.5-1~ Fr.5-5。取Fr.5-3(3.9 g)经硅胶柱氯仿-甲醇(9∶1、3∶1)梯度洗脱,合并洗脱液,减压浓缩得Fr.5-3.1~Fr.5-3.6。取Fr.5-3.2(0.6 g),经硅胶柱氯仿-甲醇(6∶1)洗脱,Sephadex LH-20柱纯化得化合物7(12.9 mg);取Fr.5-3.4(0.5 g),经硅胶柱氯仿-甲醇(4∶1)洗脱,Sephadex LH-20柱纯化得化合物8(13.2 mg)。取Fr.5-4(1.8 g)经硅胶柱氯仿-甲醇(8∶1、3∶1)梯度洗脱,合并洗脱液,减压浓缩得Fr.5-4.1~Fr.5-4.5。取Fr.5-4.3(0.2 g),经硅胶柱氯仿-甲醇(6∶1)洗脱,Sephadex LH-20柱纯化得化合物9(1.2 mg);取Fr.5-4.4(0.1 g),经硅胶柱氯仿-甲醇(4∶1)洗脱,Sephadex LH-20柱纯化得化合物10(0.9 mg)。取Fr.5-5(3.2 g)经硅胶柱氯仿-甲醇(8∶1,3∶1)梯度洗脱,合并洗脱液,减压浓缩得Fr.5-5.1~Fr.5-5.7。取Fr.5-5.3(0.3 g),经硅胶柱氯仿-甲醇(6∶1)洗脱,Sephadex LH-20柱纯化得化合物11(16.6 mg);取Fr.5-5.5(0.1 g),经硅胶柱氯仿-甲醇(5∶1)洗脱,Sephadex LH-20柱纯化得化合物12(1.1 mg);取Fr.5-5.6(0.2 g),经硅胶柱氯仿-甲醇(4∶1)洗脱,Sephadex LH-20柱纯化得化合物13(1.5 mg)。
取Fr.6(30.9 g)经硅胶柱氯仿-甲醇(8∶1、5∶1、2∶1)梯度洗脱,薄层检测合并减压浓缩得Fr.6-1~ Fr.6-8。取Fr.6-1(5.7 g)经硅胶柱氯仿-甲醇(8∶1、3∶1)梯度洗脱,合并洗脱液,减压浓缩得Fr.6-1.1~Fr.6-1.5。取Fr.6-1.1(0.2 g),经硅胶柱氯仿-甲醇(7∶1)洗脱,Sephadex LH-20柱纯化得化合物14(1.3 mg);取Fr.6-1.4(0.3 g),经硅胶柱氯仿-甲醇(4∶1)洗脱,Sephadex LH-20柱纯化得化合物15(14.7 mg)。
3 结构鉴定
化合物1:无色针状结晶(丙酮);mp 158~159 ℃;ESI-MSm/z: 425.3[M+H]+, 423.2[M-H]-,推测分子量424。1H-NMR(600 MHz, CDCl3)δ: 5.23 (1H, t,J=4.3 Hz, H-12), 0.82~1.16(each 3H, s, 23~30-CH3);13C-NMR(150 MHz, CDCl3)δ: 39.6(C-1), 34.8(C-2), 216.5 (C-3), 47.8(C-4), 55.7(C-5), 20.4(C-6), 33.4(C-7), 40.2(C-8), 48.3(C-9), 37.5(C-10), 24.1(C-11), 122.9(C-12), 145.6(C-13), 42.3(C-14), 28.5(C-15), 26.7(C-16), 32.6(C-17), 47.6(C-18), 47.9 (C-19), 31.4(C-20), 35.0(C-21), 37.5(C-22), 28.0(C-23), 21.6(C-24), 15.4(C-25), 17.5(C-26), 26.3(C-27), 27.3(C-28), 33.4(C-29), 23.9(C-30)。以上数据与文献[4]基本一致,故鉴定为β-香树脂酮。
化合物2:白色针状结晶(环已烷);mp 230~231 ℃;Liebermann-Burchard 反应呈阳性。ESI-MSm/z: 485.4[M+H]+, 483.2[M-H]-,推测分子量484。1H-NMR(600 MHz, CDCl3)δ: 0.86~1.17(each 3H, s, 23~27, 29~30-CH3), 2.07(3H, s, -COCH3), 3.21(1H, d,J=10.8 Hz),3.57(1H, d,J=10.8 Hz)(28-CH2OH), 4.52 (1H, t, H-3), 5.19 (1H,m, H-12);13C-NMR(150 MHz, CDCl3)δ: 38.5(C-1), 25.6(C-2), 80.7(C-3), 37.8(C-4), 55.5(C-5), 18.4(C-6), 32.6(C-7), 39.8(C-8), 47.5(C-9), 36.8(C-10), 23.2(C-11), 122.5(C-12), 144.3(C-13), 41.8(C-14), 25.5(C-15), 22.3(C-16), 36.5(C-17), 42.6(C-18), 46.6(C-19), 30.9(C-20), 34.1(C-21), 31.3(C-22), 28.3(C-23), 15.5(C-24), 15.6(C-25), 16.9(C-26), 26.3(C-27), 70.0(C-28), 33.5(C-29), 23.9(C-30), 21.2(-COCH3), 171.1(-COCH3)。以上数据与文献[5]基本一致,故鉴定为高根二醇-3-醋酸酯。
化合物3:白色粉末;ESI-MSm/z: 427.2[M+H]+, 471.1 [M+HCOO]-,推测分子量426。1H-NMR (600 MHz, CDCl3)δ: 1.93, 1.64 (H-1), 2.37, 2.25 (H-2), 2.23 (H-4), 1.73, 1.24(H-6), 1.47, 1.36(H-7), 1.37 (H-8), 1.52 (10-H), 1.47, 1.23 (H-11), 1.32, 1.34 (H-12), 1.46, 1.25 (H-15), 1.57 (18-H), 1.39, 1.21 (H-19), 1.51, 1.28 (H-21), 1.48, 0.91 (H-22), 0.89 (23-CH3), 0.73 (24-CH3), 0.88 (25-CH3), 1.02 (26-CH3), 1.05 (27-CH3), 1.18 (28-CH3), 1.03 (29-CH3), 0.96 (30-CH3);13C-NMR (150 MHz, CDCl3): 213.4(C-3), 59.6(C-10), 58.3(C-4), 53.2(C-8), 42.8(C-18), 42.2(C-5), 41.5(C-2), 41.2(C-6), 39.8(C-13), 39.5(C-22), 38.4(C-14), 37.4(C-9), 35.8(C-16), 35.7(C-11), 35.3(C-19), 35.1(C-30), 32.8(C-15), 32.4(C-21), 32.3(C-28), 31.8(C-29), 30.5(C-12), 29.9(C-17), 28.5(C-20), 22.5(C-1), 20.6(C-26), 19.0(C-27), 18.5(C-7), 17.8(C-25), 14.9 (C-24), 7.0(C-23)。以上数据与文献[6]基本一致,故鉴定为软木三萜酮。
化合物4:黄色针状结晶(甲醇);mp 155~156 ℃;ESI-MSm/z: 439.3[M+H]+, 437.4[M-H]-,推测分子量438。1H-NMR(600 MHz, DMSO-d6)δ: 1.63(3H, d,J=6.5 Hz, H-2″), 4.81(1H, d,J=6.5 Hz, H-1″), 6.32 (1H, s, H-6), 6.65(1H, d,J=8.5 Hz, H-6‴), 6.68(1H, d,J=8.5 Hz, H-5‴), 6.72 (1H, s, H-2‴), 6.89(1H, d,J=8.5 Hz, H-5′), 7.21 (1H, s, H-6′), 7.81(1H, d,J=1.8 Hz, H-2′);13C-NMR(150 MHz, DMSO-d6)δ: 146.9(C-2), 135.3(C-3), 176.6(C-4), 158.2(C-5), 98.5(C-6), 161.3(C-7), 111.3(C-8), 154.2(C-9), 103.4(C-10), 122.3(C-1′), 115.4(C-2′), 145.5(C-3′), 147.8(C-4′), 115.2(C-5′), 119.5(C-6′), 31.9(C-1″), 17.8(C-2″), 134.9(C-1‴), 114.6(C-2‴), 142.9(C-3‴), 144.5(C-4‴), 117.4(C-5‴), 115.5(C-6‴)。以上数据与文献[7]基本一致,故鉴定为8-[1-(3,4-二羟基苯基)乙基]-槲皮素。
化合物5:黄色簇状晶体(吡啶);mp>350 ℃;ESI-MSm/z: 303.3[M+H]+,301.2[M-H]-,推测分子量302。1H-NMR(600 MHz, DMSO-d6)δ: 7.46 (2H, s, H-5, 5′);13C-NMR (150 MHz, DMSO-d6)δ: 107.9(C-1, 1′), 140.5(C-2, 2′), 130.6(C-3, 3′), 149.3(C-4, 4′), 110.7(C-5, 5′), 112.1(C-6, 6′), 159.5(C-7, 7′)。以上数据与文献[8]基本一致,故鉴定为鞣花酸。
化合物6:白色针状结晶(甲醇);mp 296~297 ℃;Liebermann-Burchard 反应呈阳性。ESI-MSm/z: 499.4[M+H]+, 497.2[M-H]-,推测分子量498。1H-NMR(600 MHz, CDCl3)δ: 0.86(3H, s, 23-CH3), 0.89(3H, s, 24-CH3), 0.93(6H, s, 2CH3), 0.95(6H, s, 2CH3), 2.06(3H, s, -COCH3), 2.28(1H, dd,J=3.2, 14.3 Hz),2.39(1H, dd,J=8.1, 14.3 Hz)(16-CH2), 4.47 (1H, t, H-3), 5.52(1H, dd, H-15);13C-NMR(150 MHz, CDCl3)δ: 37.8(C-1), 23.6(C-2), 80.9(C-3), 37.7(C-4), 55.6(C-5), 18.7(C-6), 40.8(C-7), 39.3(C-8), 49.2(C-9), 37.9(C-10), 17.5(C-11), 33.5(C-12), 37.6(C-13),160.8(C-14), 116.7(C-15), 31.4(C-16), 51.6(C-17), 41.3(C-18), 35.5(C-19), 29.7(C-20), 33.9 (C-21), 30.8(C-22), 27.6(C-23), 16.9(C-24), 15.8(C-25), 26.5(C-26), 22.3(C-27), 184.6(C-28), 32.0(C-29), 28.9(C-30), 21.3(-COCH3), 171.4(-COCH3)。以上数据与文献[9]基本一致,故鉴定为乙酰基油桐酸。
化合物7:白色固体(甲醇);mp 155~156 ℃;ESI-MSm/z: 185.2[M+H]+, 183.1[M-H]-,推测分子量184。1H-NMR (600 MHz, CD3OD)δ: 3.32 (3H, s,-OCH3), 6.91 (1H, s, H-2, 6), 8.93 (1H, s, 3-OH), 9.18 (1H, s, 3, 5-OH);13C-NMR (150 MHz, CD3OD)δ: 108.6(C-3,5),119.6(C-1),138.8(C-4), 145.9(C-2, 6), 166.5(C=O)。以上数据与文献[10]基本一致,故鉴定为4-O-甲基没食子酸。
化合物8:白色针状结晶(甲醇);mp 236~237 ℃;5%FeCl3反应呈阳性;ESI-MSm/z: 171.2[M+H]+, 169.3[M-H]-,推测分子量170。1H-NMR(600 MHz, DMSO-d6)δ: 6.91(2H, s, H-2, 2″), 8.89(1H, s, -OH), 9.23(2H, s, -OH), 12.42(1H, s, -COOH), 经与没食子酸对照品TLC检测,3种不同溶剂系统展开,发现斑点颜色、形状相同,Rf值一致,故鉴定为没食子酸。
化合物9:无色粉末(甲醇);ESI-MSm/z: 303.2[M+H]+, 301.3[M-H]-。1H-NMR (600 MHz, CD3OD)δ: 7.02 (1H, d,J=8.9 Hz, H-6), 6.52 (1H, d,J=2.5 Hz, H-5), 6.35 (1H, dd,J=6.3, 2.6 Hz, H-3), 3.84 (3H, s, 2-OCH3), 4.77 (1H, d,J=1.7 Hz, H-1′), 3.31~3.95 (6H, m, Hs-sugar);13C-NMR (150 MHz, CD3OD): 141.7(C-1), 152.8(C-2), 104.6(C-3), 155.3(C-4), 108.2(C-5), 120.6(C-6), 102.5(C-1′), 75.9(C-2′), 78.7(C-3′), 72.0(C-4′), 78.2(C-5′), 62.9(C-6′), 56.8(2-OCH3)。以上数据与文献[11]基本一致,故鉴定为异它乔糖苷。
化合物10:白色无定形粉末(甲醇);ESI-MSm/z: 697.2[M+Na]+, 1 347.4[M-H]-;1H-NMR (600 MHz, CD3OD)δ: 8.12 (1H, s, H-5), 7.05 (1H, m, H-8), 6.96 (1H, d,J=7.9 Hz, H-5′), 6.82(1H, s, H-2′), 6.77 (1H, s, 6′-H), 6.06 (1H, d,J=4.5 Hz, H-12β), 5.79 (1H, d,J=15.5, H-12α), 4.03 (3H, s, 6-OCH3), 3.72 (7-OCH3), 6.05 (1H, d,J=6.5 Hz, -OCH2O), 5.43 (1H, dd,J=15.5, 4.5 Hz,-OCH2O), 5.45 (1H, d,J=7.9 Hz, H-1″), 4.77 (1H, d,J=6.7 Hz, H-1‴), 3.42~4.23 (11H, m, sugar-Hs);13C-NMR (150 MHz, CD3OD): 138.2(C-1), 120.9(C-2), 133.5(C-3), 146.8(C-4), 103.5(C-5), 154.0(C-6), 152.2(C-7), 107.3(C-8), 129.7(C-9), 132.2(C-10), 172.7(C-11), 70.2(C-12), 130.9 (C-1′), 112.6(C-2′), 149.8(C-3′, 4′), 109.5(C-5′), 125.3(C-6′), 102.8(C-7′), 57.5(6-OCH3), 56.6(7-OCH3), 105.5(C-1″), 73.0(C-2″), 77.9(C-3″), 70.8(C-4″), 78.7(C-5″), 67.2(C-6″), 103.1(C-1‴), 71.9(C-2‴), 75.3(C-3‴), 68.8(C-4‴), 67.6(C-5‴)。以上数据与文献[12]基本一致,故鉴定为mananthoside I。
化合物11:淡黄色粉末(甲醇-水);Molish 反应呈阳性;ESI-MSm/z: 271.2[M+H]+, 269.3[M-H]-。1H-NMR(600 MHz, DMSO-d6)δ: 7.94(2H, d,J=8.5 Hz, H-2′, 6′), 6.98(2H, d,J=8.5 Hz, H-3′, 5′), 6.83(1H, s, H-3), 6.43(1H, d,J=2.5 Hz, H-6), 6.79(1H, d,J=2.5 Hz, H-8), 5.05~3.28(H-glucose);13C-NMR(150 MHz, DMSO-d6)δ: 164.3(C-2), 103.2(C-3), 182.2(C-4), 161.6(C-5), 99.8(C-6), 163.0(C-7), 94.7(C-8), 156.9(C-9), 105.5(C-10),121.3(C-1′),128.6(C-2′), 116.2(C-3′), 161.3(C-4′), 116.2 (C-5′), 128.7(C-6′), 63.5~99.6(C-glucose), 170.42(-C=O), 20.93(-CO-CH3)。以上数据与文献[13]基本一致,故鉴定为洋芹素-7-O-β-D-(6″-O-乙酰基)-葡萄糖苷。
化合物12:白色粉末;ESI-MSm/z: 803.4[2M+Na]+, 779.3[M-H]-。1H-NMR (600 MHz, CD3OD)δ: 0.79, 0.85 (each 3H, s, 12, 13-CH3), 0.93 (3H, s, 11-CH3), 1.23 (3H, s, 10-CH3), 1.47(1H, m, H-4ax), 1.55 (1H, dd,J=12.9, 7.5 Hz, H-2eq), 1.65 (1H, m, H-2ax), 1.87 (1H, d,J=12.5 Hz, H-4eq), 1.96 (1H, m, H-5), 3.97 (1H, m, H-3), 4.25 (1H, t,J=12.5, 6.5 Hz, H-9), 4.37 (1H, dd,J=7.9, 2.5 Hz, H-1), 5.57 (1H, dd,J=15.5, 6.5 Hz, H-7), 5.75 (1H, dd,J=15.9, 5.7 Hz, H-8), 3.12~3.89 (6H, m, Hs-sugar);13C-NMR (150 MHz, CD3OD): 40.9(C-1), 43.5(C-2), 76.1(C-3), 38.6(C-4), 36.5(C-5), 79.0(C-6), 134.7(C-7), 136.5(C-8), 69.8(C-9), 24.9(C-10), 25.6(C-11), 26.7(C-12), 17.5(C-13), 103.3(C-1′), 75.6(C-2′), 78.6(C-3′), 72.2(C-4′), 78.4(C-5′), 63.5(C-6′)。以上数据与文献[14]基本一致,故鉴定为turpinionoside A。
化合物13:淡黄色粉末(甲醇-水);ESI-MSm/z: 565.2[M+H]+, 563.1[M-H]-。1H-NMR(600 MHz, DMSO-d6)δ: 8.05(2H,d,J=8.5 Hz,H-2′, 6′), 6.89(2H, d,J=7.5 Hz, H-3′, 5′), 6.82(1H, s,H-3);13C-NMR(150 MHz, DMSO-d6)δ: 163.6(C-2), 104.0(C-3), 182.5(C-4), 158.7(C-5), 108.8(C-6), 161.3(C-7), 103.9(C-8), 155.2(C-9), 103.6(C-10), 122.3(C-1′),129.5(C-2′),116.4(C-3′), 161.2(C-4′), 116.8(C-5′), 129.4(C-6′), 74.6(C-1″), 70.5(C-2″), 75.1(C-3″), 70.3(C-4″), 71.6(C-5″), 74.7(C-1‴), 71.0(C-2‴), 73.9(C-3‴), 70.9(C-4‴), 81.7(C-5‴), 61.4 (C-6‴)。以上数据与文献[15]基本一致,故鉴定为corymboside。
化合物14:白色无定形粉末(甲醇);ESI-MSm/z: 505.3[M+Na]+, 963.2[M-H]-。1H-NMR (600 MHz, CD3OD)δ:5.27 (1H, d,J=4.5 Hz, H-1), 2.94 (1H, dd,J=7.9, 4.5 Hz, H-2), 3.85 (1H, dd,J=12.9, 8.5 Hz, H-3α), 3.67 (1H, dd,J=10.5, 5.9 Hz, H-3β), 6.77 (1H, s, H-2′), 6.55 (1H, d,J=7.5 Hz, H-5′), 6.67 (1H, dd,J=8.5, 2.5 Hz, H-6′), 6.76 (1H, s, H-2″), 6.57 (1H, d,J=7.5 Hz, H-5″), 6.63 (1H, dd,J=8.5, 2.5 Hz, H-6″), 3.64 (3H, s, 3′-OCH3), 3.75 (3H, s, 3″-OCH3), 4.16 (1H, d,J=7.5 Hz, H-1‴), 3.12~4.25 (6H, m, H-sugar);13C-NMR(150 MHz,CD3OD)δ:78.8(C-1),56.6(C-2),64.6(C-3),133.5(C-1′),113.4(C-2′), 149.0(C-3′), 146.9(C-4′), 115.7(C-5′), 121.9(C-6′), 131.7(C-1″), 115.8(C-2″), 148.9(C-3″), 146.4(C-4″), 115.9(C-5″), 124.0(C-6″), 56.9(3′-OCH3), 56.6(3″-OCH3), 101.8(C-1‴), 75.7(C-2‴), 79.8(C-3‴), 72.9(C-4‴), 78.5(C-5‴), 63.7(C-6‴)。以上数据与文献[16]基本一致,故鉴定为hovetrichoside A。
化合物15:白色无定形粉末(甲醇);5%FeCl3反应呈阳性;ESI-MSm/z: 485.1[M+H]+, 483.3[M-H]-,推测分子量484;1H-NMR(600 MHz,DMSO-d6)δ:6.96(2H,s,H-2′, 6′),7.02(2H,s,H-2″,6″), 3.33~5.57(H-glucose);13C-NMR(150 MHz, DMSO-d6)δ: 118.9(C-1′, 1″),109.2(C-2′, 6′), 109.2(C-2″, 6″), 145.6(C-3′, 5′), 145.6(C-3″, 5″), 139.1(C-4′, 4″), 63.3~94.5(C-glucose), 164.9(7′, 7″-C=O)。以上数据与文献[17]基本一致,故鉴定为1,6-二-O-没食子酰基-β-D-葡萄糖。
4 体外抗HBV活性测试
选择生长良好的HepG2.2.15细胞用胰蛋白酶消化成单细胞悬液,以1×105/mL密度接种于96孔细胞培养板(200 μL/孔),培养24 h(37 ℃,5%CO2)。取分离量较大的9个化合物和拉米夫定(阳性对照药物),适量DMSO溶解,DMEM培养液稀释成质量浓度分别为5、10、20、40、80、160 μg/mL的溶液,加到细胞培养上清中,培养96 h后换相同质量浓度的药物培养液(每个质量浓度重复3孔,200 μL/孔),收集用药后192 h的细胞培养上清,按照HBeAg、HBsAg ELISA试剂盒说明书测定吸光度值,计算抗原抑制率和半数抑制浓度(IC50)[18],MTT法进行药物细胞毒性测试,计算细胞存活率和半数细胞毒浓度(CC50)[19]。结果显示,化合物4、8对HepG2.2.15细胞分泌表面抗原HBsAg有一定抑制作用,IC50分别为(95.8±2.6)、(82.7±3.1) μg/mL;化合物15对细胞分泌E抗原HBeAg的分泌有显著抑制作用,IC50为(12.9±1.7) μg/mL,见表1。
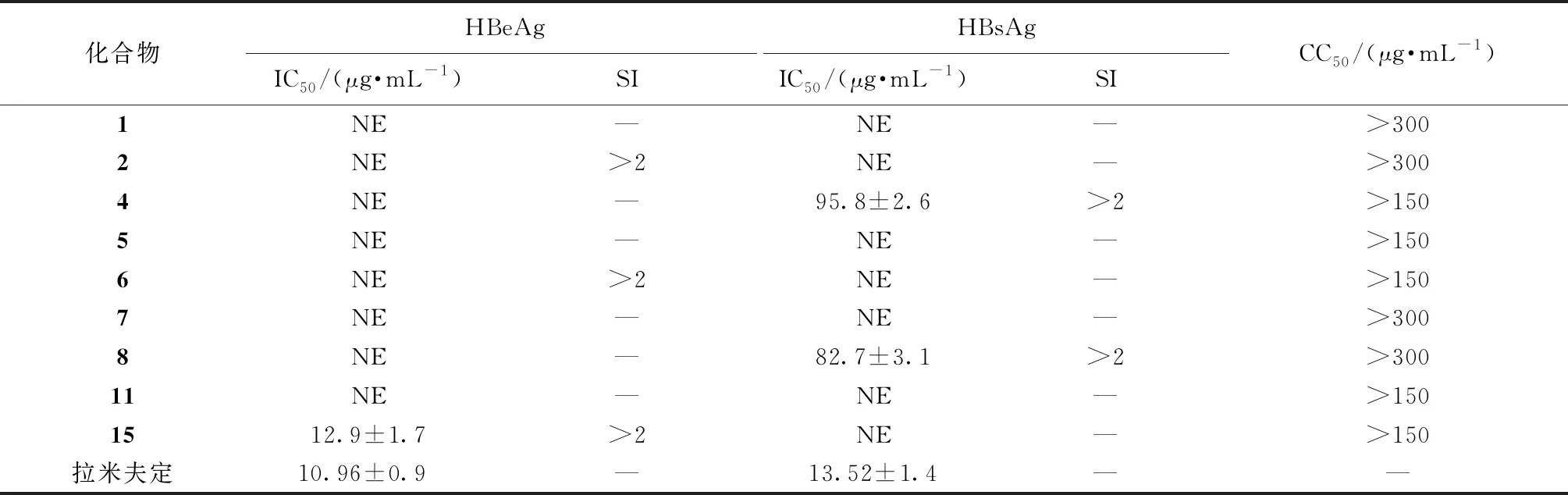
表1 各化合物体外抗HBV活性
5 讨论
从体外抗病毒实验结果来看,化合物4、8、15具有抗HBV活性,即白楸对肝炎具有治疗作用,也与民间用药经验相一致,具有可溯源性,表明该药材具有良好的开发利用前景。从目前的成分研究结果来看,白楸所含化合物大多为有机酸类、萜类及黄酮类,与前期预实验结果相符[20]。本研究发现,仅有少数化合物有抗HBV活性,而且只是从某一提取部位分离得到的化合物,不足以全面反映该药材的药理作用机制,下一步应对其他萃取部位进行全面的化学成分分析,阐明药理作用机制,以期为该药材的深度开发利用提供理论依据。
