大黄素纳米结构脂质载体在大鼠体内的药动学及组织分布
2021-10-26辛玉凤位恒超祝侠丽刘雅敏韩德恩
马 开, 辛玉凤, 田 萍, 位恒超, 祝侠丽, 刘雅敏, 韩德恩,3*
(1.河南省中医药研究院,河南 郑州 450004;2.河南中医药大学药学院,河南 郑州 450046;3.河南省中药特色炮制技术工程研究中心,河南 郑州 450046)
大黄素是一种游离型蒽醌化合物,为大黄主要化学成分之一[1],具有抗炎[2-3]、镇痛[4]、抗菌[5]、抗肿瘤[6]、保护器官[7]等多种药理作用,但该成分具有水溶性差、半衰期短、生物利用度低等缺点[8],从而限制了其临床应用。纳米结构脂质载体是在固体脂质纳米粒的基础上,以固体和液体混合脂质为载体制备的新型纳米载药系统,它克服了后者载药量低、贮存过程中药物易泄漏等缺陷[9],不仅具有生物兼容性良好、药物生物利用度高等优点,还有着缓释靶向作用[10],同时药物药动学和组织分布也会发生显著变化[11-13],开发前景良好。
课题组前期已对大黄素纳米结构脂质载体制备工艺进行优化[14],本实验在此基础上灌胃给予大鼠该制剂,采用超高效液相色谱-四级杆/静电场轨道阱高分辨质谱(UPLC-Q-Orbitrap HRMS)法测定不同时间点大鼠血浆及各组织中该成分血药浓度,考察其体内药动学及组织分布,以期为相关制剂后续开发及临床应用提供依据。
1 材料
超高效液相色谱-四级杆轨道肼高分辨质谱仪(UPLC-Q-Orbitrap HRMS,美国赛默飞世尔科技公司);MS105DU电子分析天平(十万分之一,瑞士梅特勒-托利多公司);UPD-Ⅱ-107优普超纯水机(成都超纯科技有限公司);VORTEX3旋涡混匀器(德国IKA公司);JW-3021HR高速冷冻离心机(安徽嘉文仪器装备有限公司);EFAA-DC24-RT氮吹仪(上海安谱科学仪器有限公司)。
大黄素、甲基异茜草素(批号分别为wkq16071004、wkq18012405,纯度>98%,四川省维克奇生物科技有限公司);肉豆蔻酸异丙酯(批号N18100621)、单硬脂酸甘油酯(批号N18051206)、大豆卵磷脂(批号N18061105)、泊洛沙姆188(批号N18110725)均购自南京都莱生物技术有限公司。甲醇、乙腈、甲酸均为色谱纯[赛默飞世尔科技(中国)有限公司]。
SPF级SD大鼠,雄性,体质量(235±20)g,购自济南朋悦实验动物繁育有限公司,动物生产许可证号SCXK(鲁)20190003,标准环境下饲养1周。动物实验方案获得河南中医药大学实验动物伦理委员会批准。
2 方法与结果
2.1 大黄素纳米结构脂质载体制备 参考文献[14]报道,精密称取3.27 mg大黄素、200.00 mg单硬脂酸甘油酯、148.68 mg肉豆蔻酸异丙酯,加入少量无水乙醇助溶,65 ℃下加热熔融,挥干乙醇,作为油相;精密称取100.00 mg大豆卵磷脂、173.48 mg泊洛沙姆188,水浴加热至60 ℃,作为水相,磁力搅拌(1 000 r/min)下将水相趁热滴加到乙醇挥尽的油相中,制成O/W型初乳,迅速用探头超声30 min(每工作2 s停止2 s),冰水浴冷却固化,定容至20 mL,过0.22 μm微孔滤膜,即得。
2.2 对照品、内标溶液制备
2.2.1 对照品溶液 精密称取大黄素对照品5.20 mg,置于100 mL量瓶中,甲醇超声溶解并定容至刻度,精密量取1 mL,置于10 mL量瓶中,甲醇稀释至刻度,摇匀,制成5.2 μg/mL贮备液,甲醇稀释至1.04、2.08、5.20、10.40、20.80、52.00、104.00、520.00、1040.00 ng/mL,即得。
2.2.2 内标溶液 精密称取甲基异茜草素对照品4.67 mg,置于100 mL量瓶中,甲醇超声溶解并定容至刻度,制成46.7 μg/mL贮备液,精密量取0.5 mL,置于100 mL量瓶中,甲醇稀释至刻度,摇匀,即得(质量浓度为0.233 μg/mL),4 ℃下冷藏备用。
2.3 分析条件
2.3.1 色谱 Waters ACQUITY UPLC®HSS T3色谱柱(2.1 mm×100 mm,1.8 μm);流动相0.1%甲酸-乙腈(15∶85);体积流量0.3 mL/min;柱温30 ℃;进样量5 μL。
2.3.2 质谱 电喷雾离子源(ESI),选择性离子监测模式(SIM);喷雾电压3.0 kV;离子传输管温度350 ℃;加热器温度300 ℃;鞘气体积流量35 arb,辅助气体积流量10 arb;碰撞能量45 V;定量离子(大黄素)m/z269.045 1;内标(甲基异茜草素)m/z253.049 8。
2.4 生物样本前处理 精密吸取50 μL血浆,置于1.5 mL离心管中,加入50 μL 0.233 μg/mL内标(甲基异茜草素)溶液,涡旋混合30 s,再加入400 μL蛋白沉淀剂(甲醇),涡旋混合3 min,12 000 r/min 离心5 min,取300 μL上清液,氮气吹干,残渣加100 μL甲醇复溶,12 000 r/min离心5 min,取上清液。
取组织样品1 g,加入3 mL 0.9% NaCl溶液进行匀浆,精密吸取匀浆液50 μL,置于1.5 mL离心管中,加入50 μL 0.233 μg/mL内标溶液,涡旋混合30 s,再加入400 μL蛋白沉淀剂(甲醇),涡旋混合3 min,12 000 r/min 离心5 min,取300 μL上清液,氮气吹干,残渣加100 μL甲醇复溶,12 000 r/min离心5 min,取上清液,待测。
2.5 方法学考察
2.5.1 专属性试验 取空白血浆/组织匀浆样品、含药血浆/组织匀浆样品(2.6 ng/mL大黄素)、给药1 h后血浆/组织匀浆样品加内标(甲基异茜草素)溶液,在“2.3”项条件下测定,结果见图1。由此可知,血浆、组织样品中无内源性物质或其他杂质干扰,专属性良好,可满足生物样品测定要求。
2.5.2 线性关系考察 取50 μL大鼠空白血浆/组织匀浆样品9份,加入“2.2”项下对照品溶液各50 μL,制成含0.5、1.0、2.6、5.2、10.0、26.0、52.0、260.0、520.0 ng/mL大黄素的样品溶液,按“2.4”项下方法处理,在“2.3”项条件下进样测定;质控样品制备方法同标准曲线,低、中、高质量浓度分别为2.6、26.0、260.0 ng/mL。以待测物与内标峰面积比值为纵坐标(Y),对照品质量浓度为横坐标(X)进行回归,结果见表1,可知各成分在各自范围内线性关系良好。
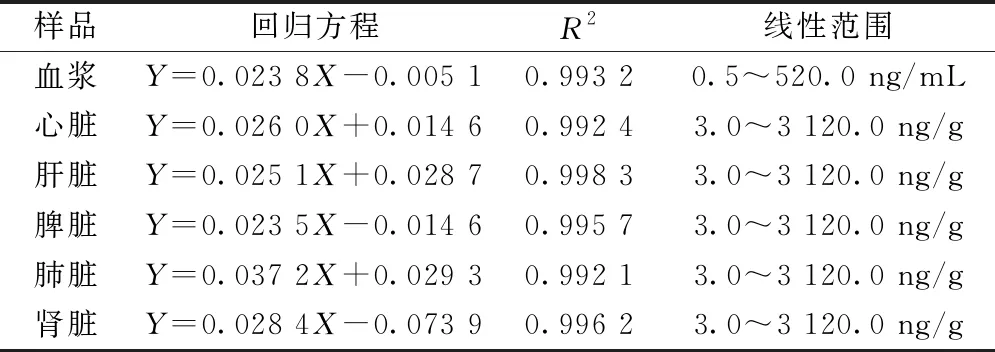
表1 大鼠血浆/组织中大黄素线性关系
2.5.3 准确度、精密度试验 取2.6、26.0、260.0 ng/mL质控样品溶液各5份,连续3 d在“2.3”项条件下进样测定,结果见表2,可知该方法准确可靠,重复性好,符合生物样品检测要求。

表2 大黄素准确度、精密度试验结果(n=6)
2.5.4 稳定性试验 取2.6、26.0、260.0 ng/mL质控样品溶液各5份,按“2.4”项下方法处理,在“2.3”项条件下进样测定,分别考察大黄素在-20 ℃下反复冻融3次、-80 ℃下冷冻保存30 d、室温下放置12 h的稳定性,结果见表3,可知该方法稳定性良好,符合生物样品检测要求。
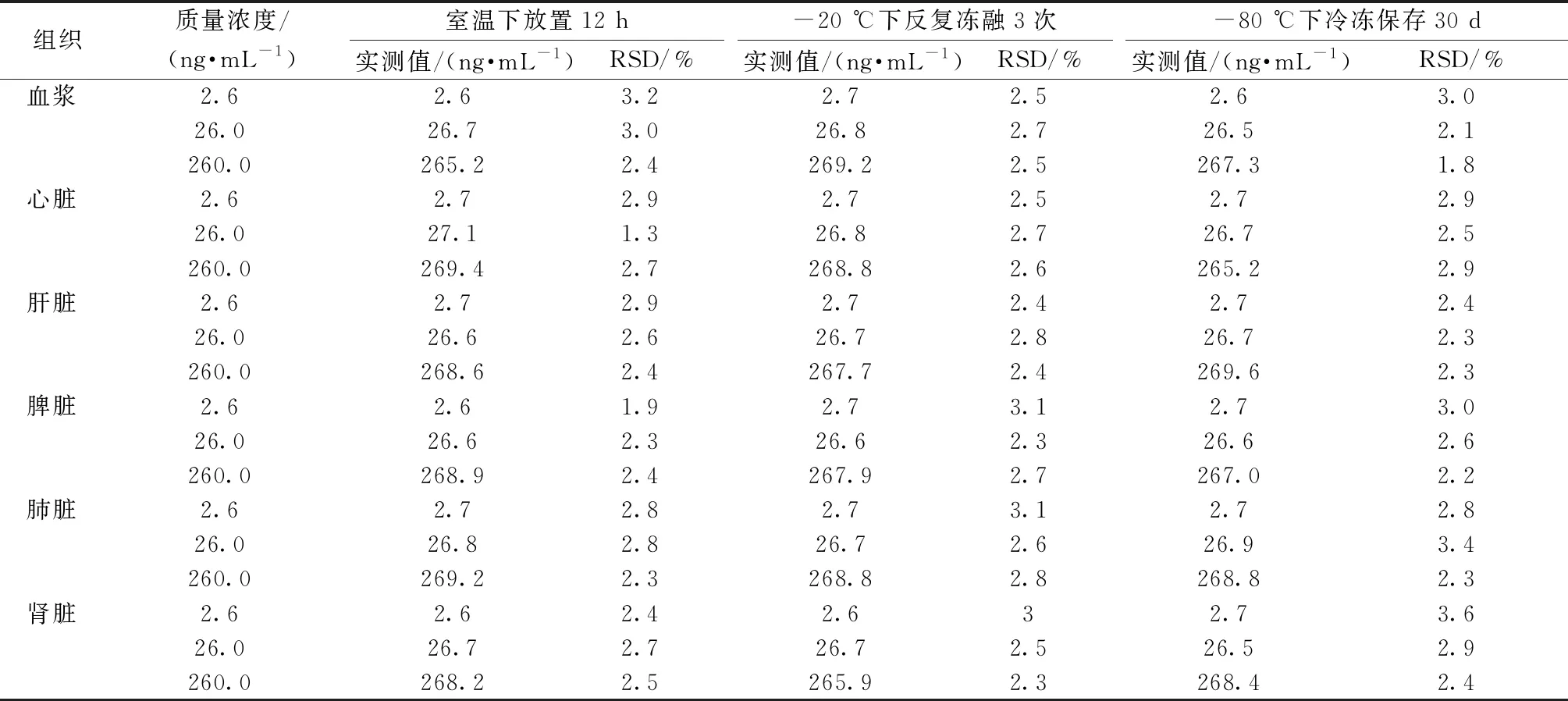
表3 大黄素稳定性试验结果(n=6)
2.5.5 提取回收率、基质效应试验 取2.6、26.0、260.0 ng/mL质控样品溶液,在“2.3”项条件下进样测定,得峰面积A;取空白血浆/组织适量,按“2.4”项下方法处理(不加内标),上清液中加入相应质量浓度的对照品、内标溶液,在“2.3”项条件下进样测定,得峰面积B;向50%乙腈中加入相应质量浓度的对照品、内标溶液,在“2.3”项条件下进样测定,得峰面积C,以(A/B)×100%计算提取回收率,(B/C)×100%计算基质效应,结果见表4,可知提取回收率良好,基质效应范围97.3%~101.3%,符合生物样品检测要求。

表4 大黄素提取回收率、基质效应试验结果(n=6)
2.6 药动学研究 12只大鼠随机分成2组,每组6只,给药前12 h禁食不禁水,1组灌胃给予大黄素混悬剂,剂量为10 mg/kg,另1组灌胃给予相同剂量大黄素纳米结构脂质载体混悬剂,于给药前及给药后0.083、0.25、0.5、1、2、4、6、8、10、12、24 h眼眶静脉窦取血各约0.3 mL,血液样品置于预先肝素化的1.5 mL离心管中,4 ℃、12 000 r/min离心5 min,取上层血浆,采用UPLC-Q-Orbitrap HRMS法测定大黄素血药浓度,绘制血药浓度-时间曲线,见图2。再通过DAS 2.0软件进行非房室模型拟合,SPSS 19.0软件进行统计学分析,药动学参数见表5,可知纳米结构脂质载体Cmax是原料药的1.39倍,相对生物利用度为182.98%,同时t1/2、MRT延长(P<0.01),有助于发挥其长效缓释作用。

表5 大黄素主要药动学参数
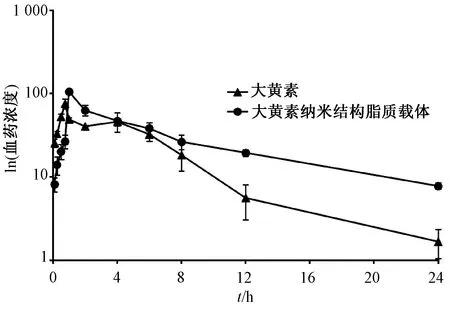
图2 大黄素血药浓度-时间曲线
2.7 体内组织分布研究 取24只大鼠,按“2.6”项下方法分组给药,分别于灌胃0.5、1.5、3、6 h后腹腔注射水合氯醛麻醉,每个时间点3只,再立即处死,取心脏、肝脏、脾脏、肺脏、肾脏,生理盐水洗涤至各组织表面无血色,滤纸将水分吸干,置于冷冻管中,液氮速冻15 min,-80 ℃下保存待用,采用UPLC-Q-Orbitrap HRMS法测定大黄素含量,结果见图3。由此可知,大黄素含量在肝脏中最高,其次在肺脏中,脾脏中最低;大鼠给予原料药0.5 h后,该成分在肝脏中的含量高于给予纳米结构脂质载体后,随着时间的推移逐渐逆转,而且后者下降速度明显慢于前者,表明纳米结构脂质载体在大鼠肝脏中具有一定的缓释靶向作用。

图3 大鼠各组织中大黄素含量
3 讨论
血浆样品常用的前处理方法有液-液萃取、固相萃取、蛋白沉淀,其中蛋白沉淀重复性好,成本较低,是蒽醌类成分生物样品预处理的常用手段[15-16]。本实验考察了甲醇、乙腈、乙酸乙酯对大黄素的提取回收率的影响,发现甲醇去除蛋白时杂质干扰少,提取回收率较高,符合生物样品测定要求。
药动学结果显示,大黄素混悬液Cmax为75.81 ng/mL,而其纳米结构脂质载体为105.77 ng/mL,可能是因为纳米结构脂质载体粒径较小,增加了与胃肠道黏膜的接触面积,有利于药物吸收;在大黄素纳米结构脂质载体中加入磷脂、泊洛沙姆188时,可提高胃肠道黏膜通透性,促进药物吸收[17],从而增加Cmax;两者AUC0~∞分别为398.56、729.27 ng/mL·h,相对生物利用度为182.98%,表明药物吸收程度大大提高;两者t1/2分别为9.06、2.36 h,体现了大黄素纳米结构脂质载体的缓释效应。
